非均相催化臭氧氧化降解废水中吡啶的研究
2021-11-17张立富陈洋
张立富,陈洋,2
(1.江苏吉华化工有限公司,江苏 盐城 224001;2.江苏南大华兴环保科技股份公司,江苏 盐城 224001)
0 引言
水是人类赖以生存的重要资源,我国是世界水资源短缺国家,全国400 多个城市缺水,人均水资源量仅为2 200 m3。而工业废水的不达标排放,导致水资源的大规模污染,加剧我国水资源短缺问题的严重性。吡啶为工业生产过程中的重要有机原料[1],其应用广泛,同时吡啶又是一种环境污染物,其废水COD浓度高、有机氮含量高、毒性高,常规方法难以处理[2]。目前常用于处理吡啶废水的方法包括物理化学法(吸附法、萃取法、膜分离法)[3-6]、生物法(生物活性炭法、厌氧)[7]、高级氧化法(光催化法、芬顿法)[8]等。此类方法存在处理效率低、不稳定、成本高等缺点。吡啶氮原子上有很强的电负性,可以吸附环上的电子变成缺电子体,导致其极难降解。因此本文利用高级氧化技术—催化臭氧氧化法降解吡啶废水,旨在为降解吡啶废水,缓解其对水体污染研究提供参考。
1 材料与装置
1.1 原水水质
实验使用水样为吡啶(AR, 99.0%) 溶液配制的模拟废水。吡啶浓度测定采用紫外可见分光光度法,即在吡啶的特征峰处,测定吡啶的吸光度,利用标准曲线法,得出吡啶浓度。
吡啶废水的降解率为:
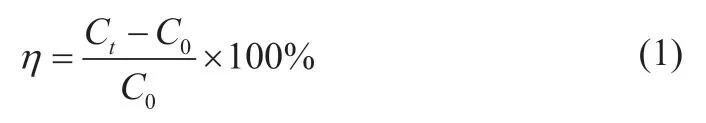
式中:C0为吡啶废水初始质量浓度(mg/L);Ct为吡啶废水处理后质量浓度(mg/L)。
按照10 mg 浓度梯度配置10~80 mg/L 一批吡啶溶液,测定吡啶在最大吸收波长256 nm 处的吸光度A,绘制吸光度A与浓度C的标准曲线图,如图1 所示。
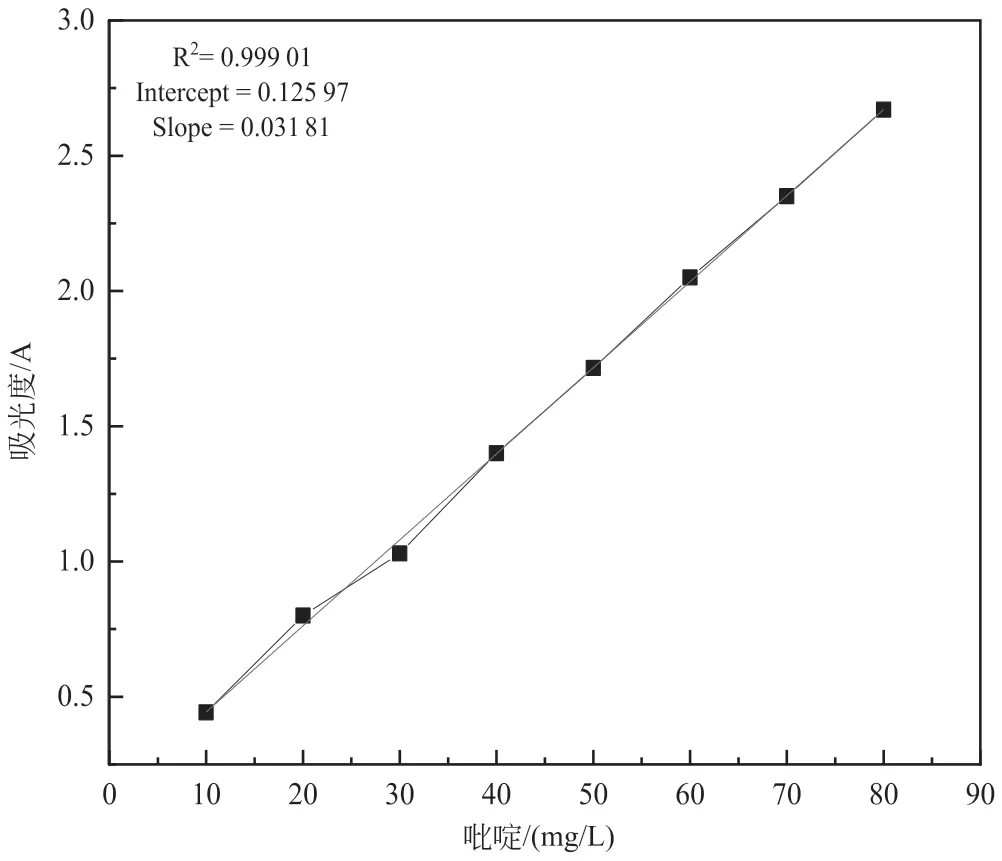
图1 吡啶的标准曲线
实验结果可知,吡啶浓度C与吸光度A在浓度为10~80 mg/L 范围内成正比。吸光度和吡啶浓度拟合得标准曲线方程:C=0.031 81A+0.125 97。
1.2 实验装置
实验室臭氧发生器为纯氧发生器,发生器臭氧产生范围为0~6 g/h,气流量范围为0~3 L/min;气体臭氧分析仪测量范围为0~200 g/m3。实验将废水加入催化臭氧氧化塔,依次打开氧气瓶阀门、臭氧发生器,反应过程取样检测吡啶浓度。具体工艺流程如图2 所示。

图2 工艺流程图
2 结果与分析
2.1 对比实验
实验对比O3、HX-01/O3、HX-02/O3、HX-03/O3、HX-04/O3对吡啶的降解效果。实验条件为pH=9,臭氧量为2.4 g/h,反应时间为3 h,吡啶初始浓度500 mg/L,结果如图3 所示。根据实验,市面商用催化剂催化臭氧较单独臭氧氧化降解吡啶的效果各不相同,其中,催化剂HX-02、HX-03、HX-04 无明显提升效果。催化剂HX-01 提升效果明显,反应3 h 时,氧化效果由单独臭氧的47.8% 提升至74.5%。出现此类现象的原因在于催化剂催化臭氧的机理分为两种:

图3 单独臭氧与催化臭氧吡啶降解对比图
(1) 臭氧分子吸附于固体催化剂表面上的反应位点,在反应位点上臭氧分解产生了羟基自由基,羟基自由基释放到溶液中氧化有机化合物。
(2) 溶液中的有机化合物吸附在固体催化剂表面,在活性位点上有机物受到臭氧分子的攻击,与臭氧发生氧化还原反应。前者催化剂表面多为金属离子,可通过扩大配位层、价层电子重排、反键分子轨道容纳外来电子对等方式接纳更多电子,从而实现臭氧分解生成·OH。后者催化剂多表现为孔隙比大,可吸附更多的有机物,实现有机物的固着,达到高效去除有机物的目的。由于吡啶难以被氧化,能够形成更多·OH 的HX-01 显然能够对吡啶起到有效的降解。
2.2 pH 对HX-01/O3 氧化降解吡啶的影响
实验控制条件臭氧量为2.4 g/h,反应时间为3 h,吡啶初始浓度500 mg/L,分别探讨pH=3、5、7、9、11,考察pH 对HX-01/O3氧化降解吡啶的影响,结果如图4 所示。根据实验结果,催化臭氧氧化降解吡啶受pH 的影响较大,在弱碱性条件下的降解吡啶废水的去除率明显高于酸性条件下的降解率。pH 对催化臭氧氧化吡啶的降解效果具体表现为pH=9>pH=7>pH=5。由于催化剂HX-01 为不饱和的金属离子配位,在酸性条件下,催化剂表面带正电荷,因为H+存在,降低并消耗了羟基自由基。而当pH 继续提升至11 时,降解率反而降低,因为HX-01 催化剂表面的·OH 表面带负电,弱碱时可以促进吡啶废水中的有机物吸附与分解,但是高浓度的OH-反而会抑制羟基自由基的形成,严重还会导致催化剂的失活。由此可见弱碱时pH=9 的条件下效果最优。

图4 不同pH下催化氧化降解趋势图
2.3 臭氧投加量对HX-01/O3 氧化降解吡啶的影响
实验控制条件反应时间为3 h,吡啶初始浓度500 mg/L,pH=9,分别探讨臭氧投加量为1.8、2.4、3.0 g/h,考察臭氧投加量对HX-01/O3氧化降解吡啶的影响,结果如图5 所示。根据实验,进口臭氧浓度在不断增大时,吡啶降解效果与也在不断升高。但对比臭氧投加量为2.4 和3.0 g/h 时,其对吡啶的降解趋势相近,而最优降解效果仅相差6%。由此可见并不是臭氧量越大越好,而根据实验,当臭氧投加量为2.4 g/h 时,臭氧利用效率更高、吡啶降解效率更高,所需要的反应时间也相对更短。因此最优臭氧投加量为2.4 g/h,此时反应2 h 时,最优降解效果为73.2%。
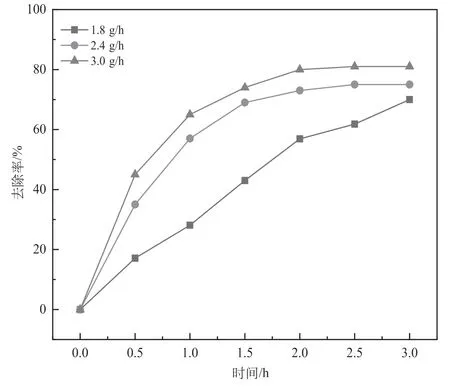
图5 不同臭氧投加量下催化氧化降解效果图
2.4 催化剂投加量对HX-01/O3 氧化降解吡啶的影响
实验控制条件反应时间为3 h,吡啶初始浓度500 mg/L,pH=9,臭氧投加量为2.4 g/h,分别探讨催化剂投加量为1.0、1.5、2.0、2.5 g/L,考察催化剂投加量对HX-01/O3氧化降解吡啶的影响,结果如图6 所示。根据实验结果,催化剂的投加量增加,能够提升吡啶降解效率的增加,但随着催化剂量的继续增加,吡啶的降解效果不会继续增加。主要原因在于,催化剂在反应体系中起到提高电子空穴的作用,其在投加量较低时,对单位时间进行催化臭氧形成·OH 的量较低,因此对吡啶的降解效果较差。而过量的投加,不仅导致催化剂的浪费,同时会导致出水压力的增加,增加投资成本。因此最优催化剂投加量为1.5 g/L。

图6 不同催化剂投加量下催化氧化降解效果图
3 结语
(1) 通过对比单独臭氧和催化臭氧发现,催化臭氧氧化能够明显提高单独臭氧对吡啶的降解效果,且对比四种催化剂发现最优催化剂为HX-01。
(2) 探索HX-01/O3氧化吡啶条件实验表明:pH、臭氧投加量、催化剂投加量对催化臭氧氧化降解吡啶效果的影响较大。最优反应条件为:反应时间为2 h、pH=7、臭氧投加量为2.4 g/h、催化剂投加量1.5 g/L,此时降解效果为73.2%。
