基于高通量测序及Biolog-ECO方法的雄安新区鲥鯸淀细菌群落结构与功能多样性分析
2021-11-17邓茹陈曦裘丽萍孟顺龙陈家长
邓茹,陈曦,裘丽萍,孟顺龙*,陈家长*
(1.上海海洋大学 水产科学国家级实验教学示范中心,农业农村部淡水水产种质资源重点实验室,农业农村部鱼类营养与环境生态研究中心,上海 201306; 2.中国水产科学研究院淡水渔业研究中心 农业农村部水产品质量安全环境因子风险评估实验室(无锡),中国水产科学研究院内陆渔业生态环境和资源重点开放实验室,江苏 无锡 214081)
水生生态系统中, 微生物群落在有机物分解和营养物质的转化中发挥着重要作用。浮游细菌和附着细菌在整个淡水生态系统的物质和能量循环中作用重要,它们在物质能量循环中既是分解者又是生产者[1], 一方面,细菌可分解有机物释放能量,以异养方式生长,它们扮演分解者的角色[2];另一方面,细菌可以利用可溶性有机物质(不能被真核藻类吸收)转换成颗粒有机物,然后由原生动物和微型浮游动物捕食后再传递到后生动物构成微食物环,此时细菌成为生产者[3]。此外, 无论是浮游细菌还是附着细菌,它们自身的增殖也为水体中的底栖动物、浮游动物等提供了直接的营养来源,在食物链中起着重要的作用。
随着分子生物学技术的推陈出新,方便快捷、经济可靠的微生物检测技术被越来越多的研究学者所接受。高通量测序技术能够获得全面的微生物群落信息,且能够更高效准确地解析微生物功能信息[4-5],目前,该技术已在淡水生态系统和海洋生态系统中得到良好的应用[6-7]。其中,Biolog-ECO平板法通过直接在微平板上培养微生物群体,测定微生物对不同碳源的利用程度,实时监测其引起的光吸收度变化,借以探究微生物的生理特征及其群落结构[8]。Biolog-ECO作为一种方便快速的微生物检验技术,已广泛应用于环境微生物检测、微生物生态研究等方面,用该方法可以获得微生物群落碳源利用能力的大量数据,从而反映微生物活性的丰富信息[9]。
湿地是自然界生物多样性最丰富的生态系统之一,与社会发展和人类福祉密切相关[10]。为了更好地了解微生物群落在大型浅水湖泊中的重要性,本研究中选择国家级新区雄安新区的水命脉——白洋淀中鲥鯸淀湿地为研究对象。目前,有关分析白洋淀细菌微生物多样性特征,利用具有生态功能的土著微生物帮助恢复湖泊生态系统的研究尚少,大部分均关注湖泊藻类、浮游动物的群落结构特征[11]。针对白洋淀鲥鯸淀生态现状,本课题组实施了生态修复工程,期望建设适宜微生物附着的功能载体,如棕榈片、网片、人工水草,以湿地天然芦苇基质为对照,以期提高湖泊生态系统的自我净化能力。本研究中,基于高通量测序技术对4种不同基质附着细菌及浮游细菌群落多样性及其群落组成和分布特征进行分析,并通过Biolog-ECO技术分析附着和浮游微生物对不同碳源的利用程度,旨在更好地了解水体浮游细菌与附着细菌在大型浅水湖泊生态系统中的相对重要性,为后续微生物资源的开发利用提供菌种资源和理论依据。
1 材料与方法
1.1 材料
试验样品于2019年10月采自雄安新区白洋淀国家级水产种质资源保护区鲥鯸淀(38°50′30″~38°51′0″N、115°59′20″~115°59′40″E)。
1.2 方法
1.2.1 样品采集 水样采集遵循遍布全湖的原则,共设置9个采样点(记为E1~E9),每个采样点设置3次重复采样。于水表面下0.5 m处采集水样,采集装置为2.5 L有机玻璃采水器和1 L无菌聚乙烯瓶,后将所采水样于4 ℃条件下运送至实验室。
1.2.2 样品处理 水样采用真空抽滤的方式过0.22 μm无菌滤膜,后将滤膜用无菌镊子转移至10 mL无菌离心管中,密封后于-80 ℃超低温冰箱中冷藏,待提取DNA。附着基质分别为棕榈片(A)、网片(B)、人工水草(C)、芦苇(D)和浮游细菌(E),每种基质设置3个平行。采样时将淀内附着基取出水面,用无菌刀片刮取附着基表面物质,置于无菌离心管中密封后,于-80 ℃超低温冰箱中冷藏,待提取DNA。
1.2.3 DNA提取 使用FastDNA旋转试剂盒和FastPrep仪器(MP Biomedicals, Santa Ana,CA)从样品中分离出DNA,DNA浓度和纯度利用NanoDrop 2000进行检测,利用10 g/L琼脂糖凝胶电泳检测DNA提取质量。
1.2.4 高通量测序 PCR扩增及其高通量测序采用细菌引物为338F: 5′ ACTCCTACGGGAGGCAGCAG 3′和 806R: 5′ GGACTACHVGGGTWTCTAAT 3′。随机选取样品进行预试验,以确保在最低循环数中绝大多数样品能够扩增出浓度合适的产物。PCR 正式试验采用TransStart Fastpfu DNA Polymerase(TransGen AP221-02),反应体系为20 μL。扩增程序为: 95 ℃下预变性3 min;95 ℃下变性 30 s,55 ℃下退火复性30 s,72 ℃下延伸40 s,共进行30个循环;最后在72 ℃下再延伸 10 min。所有样本反应结束后,每个样本再进行3个重复,将同一样本的 PCR产物浓度进行等量混样后使用20 g/L琼脂糖凝胶回收PCR产物,并进行电泳检测。利用Illumina公司的Miseq PE 300平台进行测序,委托上海美吉生物医药科技有限公司进行测序,对原始序列进行预处理,根据不同的相似度水平,对所有序列进行OTU划分,通常对97%相似水平下的OTU进行生物信息统计分析。运用Kruskal-Wallis秩和检验方法比较物种丰度,基于Bray-curtis距离算法对物种进行非度量多维尺度分析。
1.2.5 微生物对碳源的利用 Biolog-ECO板中平均每孔颜色变化率(average well color development,AWCD)主要是衡量微生物利用不同碳源的整体能力,亦反映微生物对31种碳源的利用能力和偏好。将适量的样品用质量分数0.85%的生理盐水按一定比例进行稀释,用8孔加样器将150 μL稀释后的样品加至Biolog-ECO微平板中,置于28 ℃恒温箱避光培养,采用 Beckman Beachmark plus 酶标仪,每24 h读板1次,连续读7次,分别读取培养24、48、72、96、120、144、168 h时Blank 590和Blank 750波长的数值。选择72 h的数据来分析不同样品中微生物对6大类碳源利用强度的显著性差异。
1.3 数据处理
采用Microsoft office和SPSS 25软件,对利用Biolog-ECO方法所得到Blank 590和Blank 750波长的数值进行数据处理。
2 结果与分析
2.1 浮游细菌与附着细菌群落结构组成特征
从21个样品中共检测出1 204 184个有效序列,其中,包括50门127纲257目482科957属1 844种,共计4 828 OTU。对门水平丰度求平均值,结果如图1(a)所示,合并丰度<1%的数值共12门菌群,分别为疣微菌门Verrucomicrobia、变形菌门Proteobacteria、蓝细菌门Cyanobacteria、放线菌门Actinobacteria、拟杆菌门Bacteroidetes、绿弯菌门Chloroflexi、浮霉菌门Planctomycetes、Saccharibacteria、厚壁菌门Firmicutes、酸杆菌门Acidobacteria、WS6和绿菌门Chlorobi。从门组成可知,附着细菌中,疣微菌门为第一优势菌门,变形菌门为第二优势菌门,之后为蓝细菌门;而浮游细菌中,蓝细菌门为第一优势菌门,放线菌门为第
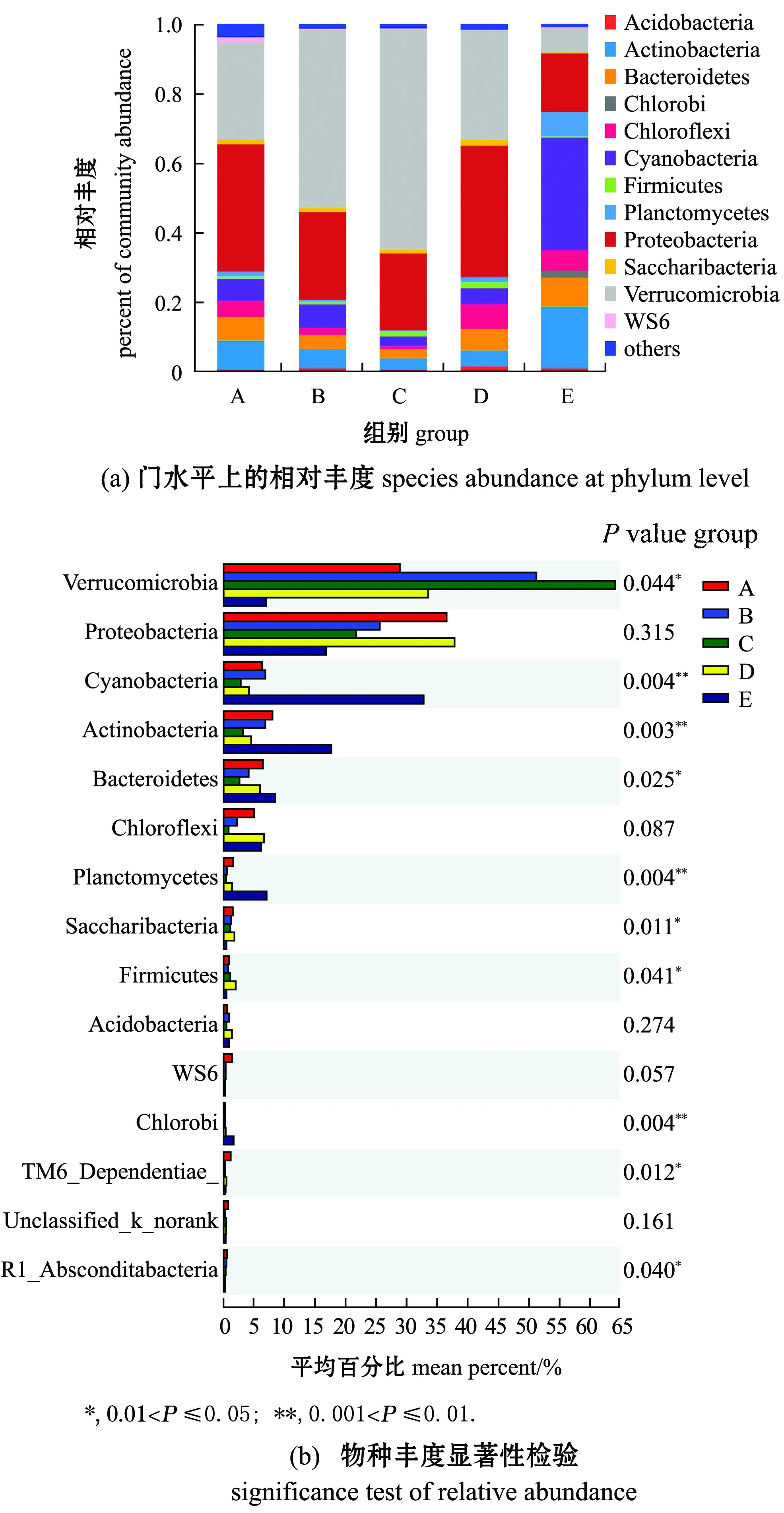
图1 门水平上相对分布及物种丰度显著性检验
二优势菌门,之后为变形菌门。因此,浮游细菌与附着细菌在组成及丰度上存在明显差异。
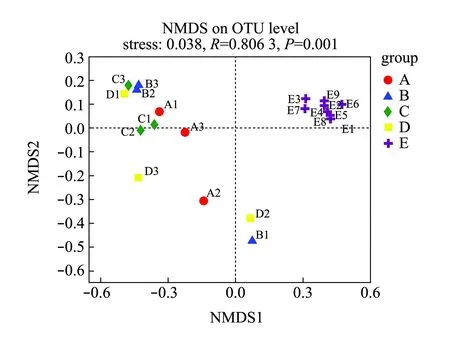
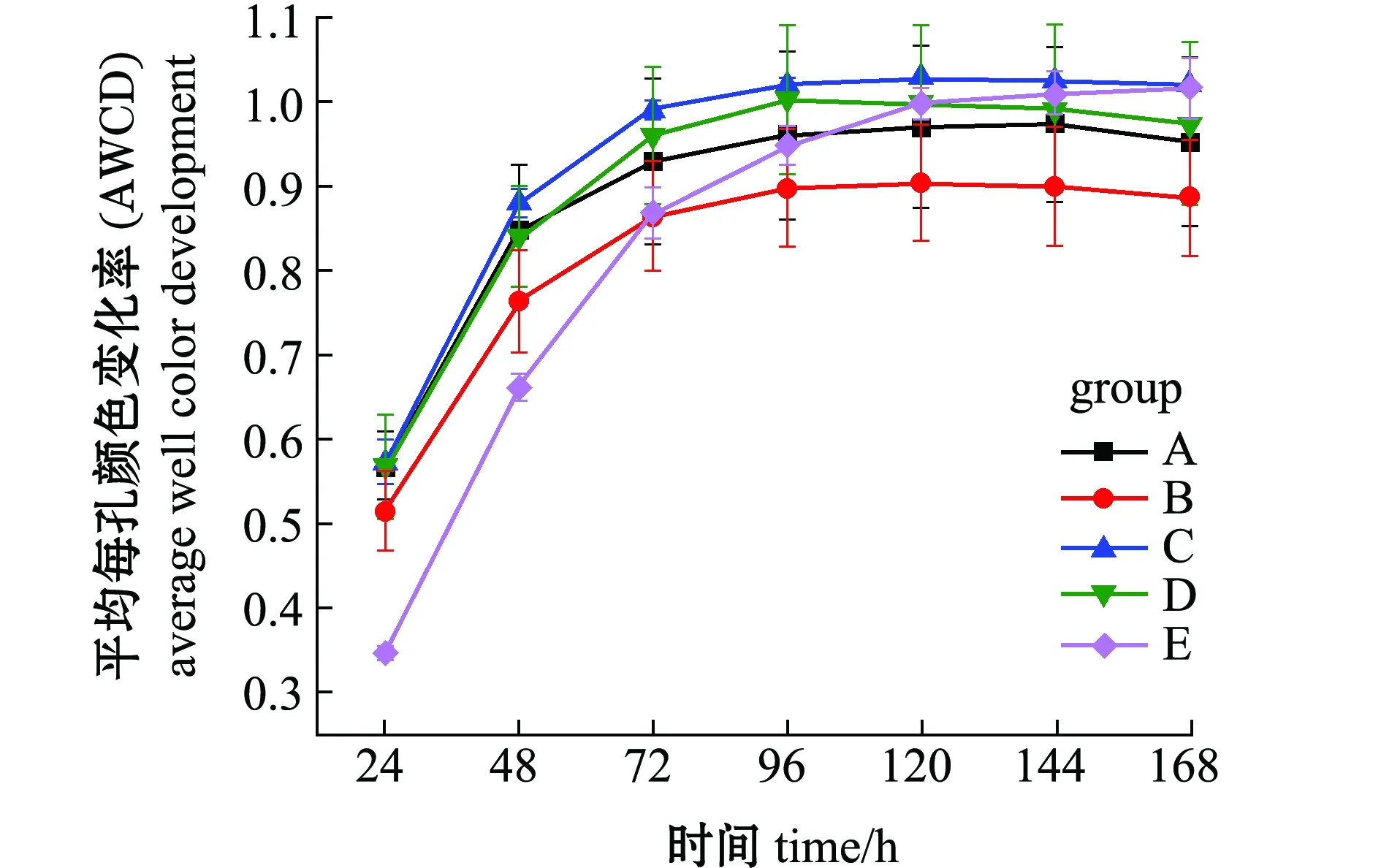
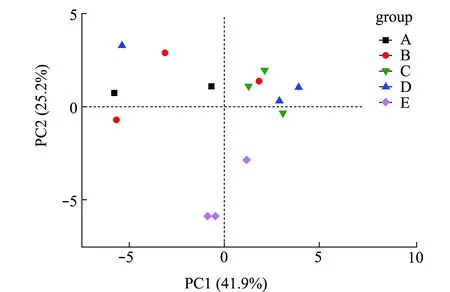
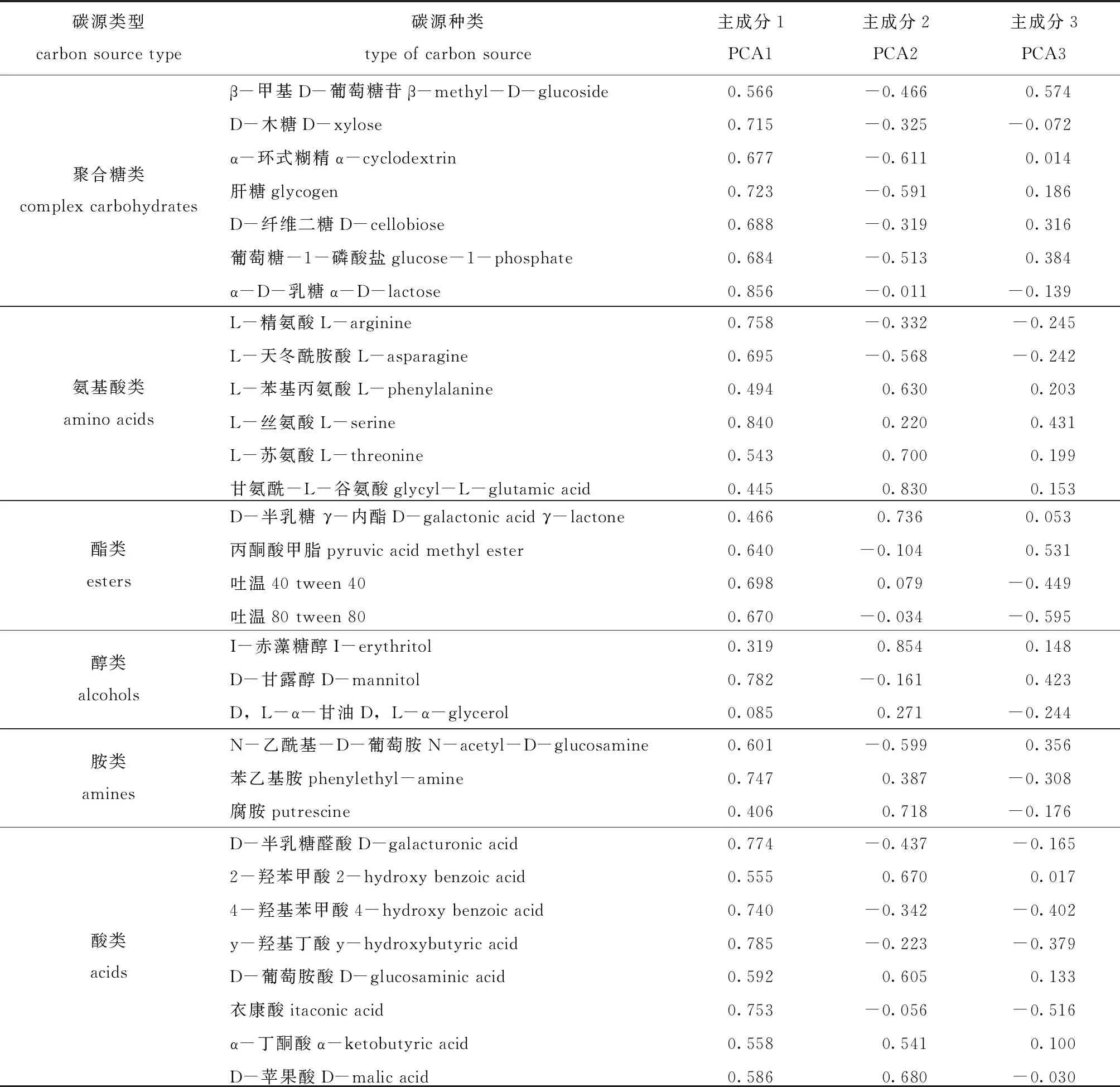
基于Kruskal-Wallis秩和检验方法比较物种丰度差异可知(图1(b)),浮游细菌与附着细菌组微生物群落中物种丰度表现出显著差异性,其中,浮游细菌组中疣微菌门、Saccharibacteria、厚壁菌门、TM6_Dependentiae、SR1_Absconditabacteria等物种丰度显著低于附着细菌组(0.01 通过高通量测序数据对测序结果进行比对,并对采集样品进行α-多样性分析,结果表明,所有样品的覆盖度均在99.1%以上,说明测序数据有效可靠,可以作为分析的依据。从表1可见:Sobs指数结果显示,浮游细菌和棕榈片的OTU数目显著高于人工水草、芦苇基质和网片附着基质(P<0.05);Shannon指数和Simpson指数反映物种的多样性,结果显示,浮游细菌和棕榈片基质附着细菌的多样性显著高于网片基质、人工水草和芦苇基质附着细菌(P<0.05),而Ace指数和Chao1指数反映物种的丰富度,结果显示,浮游细菌和棕榈片基质附着细菌的丰富度显著高于网片基质、人工水草和芦苇基质附着细菌(P<0.05)。 表1 微生物多样性指数分析 Beta多样性分析是根据Bray-curtis距离算法,对物种进行非度量多维尺度(non-metric multidi-mensional scaling,NMDS)的分析(图2),结果表明,样品在维度NMDS1和维度NMDS2能够较好地被区分开,其中,Stress值为0.038,表明具有较好的代表性,能较好地证明数据的可靠性。浮游细菌仅出现在第一象限,能较好地与附着细菌区分开来;人工水草基质和网片基质大部分分布在第二象限,棕榈片基质出现在第二、三象限,而芦苇基质分布在第二、三、四象限。表明附着细菌中棕榈片和芦苇基质的相似性较大,人工水草基质与网片基质相似性较大;而浮游细菌与附着细菌间的差异性最大(P=0.001)。 图2 相似性>97%的OTU水平上非度量多维度分析 从图3可见:浮游微生物及不同基质上的附着微生物对全部碳源的利用强度均随培养时间的延长而呈先增加后逐渐变缓直至停止趋势;24 h微生物活性较低,可看出浮游微生物的活性明显低于附着微生物的活性;48~120 h是微生物利用碳源的高峰期,平均每孔颜色变化率随培养时间延长呈先增加而后趋于稳定。从总体趋势来看,浮游微生物的变化幅度最大,这说明对碳源利用能力最强,且显著高于附着微生物对碳源的利用能力;不同基质上的附着微生物平均每孔颜色变化率由大至小依次为人工水草>芦苇>棕榈片>网片基质。表明人工水草基质上的微生物碳源代谢强度最高,而网片基质上微生物对碳源的利用能力最低。微生物群落代谢活性反映了微生物生存群落的特征,其平均每孔颜色变化率值变化趋势的差异说明浮游微生物与附着微生物间及不同基质上附着微生物间群落是存在明显差异。 图3 鲥鯸淀微生物全部碳源的利用情况 为研究浮游微生物及不同附着基质上微生物群落碳代谢的影响,选择Biolog-ECO培养72 h作为分析时间点进行PCA分析,提取3个主成分,第1主成分(PC1)为41.9%,第2主成分(PC2)为25.2%,第3主成分(PC3)为9.8%,3个主成分综合了全部31种碳源76.9%的信息,提取前2个主成分做PCA图(图4),以表征各组微生物群落碳源代谢特征,2个主成分积累贡献率达67.111%。由图4可知,附着微生物组主要分布在第一、二象限,而浮游微生物组主要分布在第三、四象限,说明附着微生物与浮游微生物间的微生物碳代谢特征差异明显。附着微生物组中人工水草基质与芦苇基质较近,说明相似程度较高,对不同碳源的利用能力较相似;而棕榈片及网片基质与其他基质的距离较远,说明相似度不高,差异较明显。 图4 不同微生物群落的主成分分析 Biolog-ECO板中包含的31种单一碳源按照代谢特性和化学结构分为6大类:聚合糖类(7 种)、氨基酸类(6 种)、脂类(4 种)、醇类(3 种)、胺类(3种)和酸类(8种)。表2列出了31种碳源与3个主成分间的相关系数,从表中可看出,微生物代谢基质主成分1相关系数0.55以上的基质有24种,相关系数大于0.75的有7种,其中,酸类3种,氨基酸类2种,聚合糖类1种,酯类1种; 主成分2相关系数0.55以上的基质有9种; 主成分3相关系数0.55以上的基质仅有1种,说明不同试验组微生物代谢功能群落结构的差异主要体现在与主成分1相关系数较高的基质上。与主成分1相关系数在0.80以上的为α-D-乳糖、L-丝氨酸,与主成分2相关系数在0.80以上的为甘氨酰-L-谷氨酸、I-赤藻糖醇。碳源的相关性越高,表明该碳源对不同微生物组群区分的贡献率越大,但是不能完全说明该碳源的实际利用程度也高,也有可能是不同微生物组群的碳源利用率差异性高。 表2 31种碳源与3个主成分之间的相关系数 本试验结果表明,附着细菌群落中变形菌门丰度比例高于蓝细菌门,而浮游细菌群落中蓝细菌门丰度比例高于变形菌门,蓝藻门在附着细菌群落中丰度比例明显低于浮游细菌群落,此结果与Grossart等[12]研究海洋硅藻浮游细菌及附着细菌群落结构的结果相反。不同基质附着微生物群落与浮游微生物群落间在优势微生物类群方面均有所不同,这表明特定环境可以影响微生物的组成。研究发现,水产养殖病害的发生与环境微生物群落组成密切相关[13],但环境因素对微生物群落和病原菌比例的影响还有待进一步研究。从鲥鯸淀细菌群落多样性分析发现,其总体上呈现浮游细菌的丰富度和多样性显著高于附着细菌,这与对太湖水体附着细菌和浮游细菌的丰度与分布特征的研究结果相反,这可能与采样时间、 采样点位环境因子状况有关,这也说明了不同湖区间的差异性。目前, 海洋生态系统中水体附着细菌的研究相对较多[14-15],已有的研究表明,附着细菌比浮游细菌在海洋水生生态系统中所起的作用更为重要。Tang等[16]对太湖有机集聚体上的附着细菌种类组成进行了研究,其结果表明,有机集聚体上的附着细菌在湖泊生态系统微食物环中的地位较为重要。因此,如何控制环境条件形成最有益的功能微生物群落显得尤为重要。 Biolog-ECO 平板中的平均每孔颜色变化率值反映了微生物群落利用不同单一碳源的整体能力和偏好,在碳源种类相同的条件下,对不同微生物利用碳源情况进行比较,可以反映出不同基质附着微生物及浮游微生物对不同类型碳源的利用强度的差异[17]。本试验结果表明,浮游微生物的平均每孔颜色变化率值明显高于附着微生物,说明浮游微生物的生物活性最活跃。以往的研究中,较少从碳源利用能力上比较附着微生物与浮游微生物群落结构差异,昝帅君等[18]探究了辽河口浮游细菌和附着细菌群落结构及多样性分析,研究发现,相对附着细菌而言,浮游细菌在河口生态系统物质循环和能量流动方面发挥着更加重要的作用。因此,全面了解环境中微生物群落特征对整个生态系统的循环非常重要。董媛媛等[19]在养殖水体中添加不同浓度的光合细菌发现,改变浮游微生物群落结构既能增强水体微生物对碳源的整体利用能力,又能节约养殖成本。可见鲥鯸淀浮游微生物利用碳源能力较强,说明淀内养殖环境较好,且较多的附着基质增加了湖泊生态资源的多样性,亦为微生物和鱼类资源等提供了优良的栖息环境。 Biolog-ECO平板法是将微生物群落功能多样性反映在微生物对不同碳源的利用程度上,其主成分分析可以有效反映微生物群落功能结构特征[20]。本研究中综合3个主成分结果可知,不同附着微生物与浮游微生物群落代谢功能起作用的主要碳源类型为氨基酸类、聚合糖类和醇类,不同微生物群落差异主要体现在对氨基酸类和聚合糖类碳源的利用上,其中以氨基酸类最为突出。有研究表明,不同碳源产生的胞外聚合物有较大差异[21],且水体中的藻类在光照和二氧化碳充足的条件下,可以产生大量的酯类和碳氢化合物[22],进一步影响参与微生物群落组成和微生物从不同碳源中的获益方式[23]。由于Biolog-ECO微平板技术依旧存在着一定的局限性,仅采用此技术很难完整反映生态环境微生物群落功能多样性的变化规律,有关不同基质上附着微生物与浮游微生物群落功能差异等方面的研究,还需进一步探索。 本研究中,通过高通量测序表明,浮游细菌与附着细菌存在明显的差异,同时发现浮游微生物的生物活性明显高于附着微生物,由此可见,微生物对碳源利用能力的影响因素之一是微生物群落结构间的差异。张哲等[24]研究发现,生态系统中微生物群落结构随添加碳源的不同会发生一定的变化,证明微生物群落组成与其对碳源的利用程度存在着较大的关联。其主要原因是由于不同微生物对不同碳源的需求量不同,因而造成环境中剩余碳源的差异。微生物群落是一个庞大的群体,需通过更加深入的研究来发现其对碳源利用的不同机制。探明鲥鯸淀生态系统中微生物的碳源利用能力不仅可以深入了解生态循环过程,而且可以较好地反映出水质综合状态的变化,进而提炼出更多的有用信息[25]。 1)位于雄安新区的鲥鯸淀内主要优势菌群为疣微菌门、变形菌门、蓝细菌门、放线菌门、拟杆菌门、绿弯菌门、浮霉菌、Saccharibacteria、厚壁菌门、酸杆菌门、WS6和绿菌门,且浮游细菌与附着细菌在组成及丰度上存在明显差异,其中,疣微菌门是附着细菌中的第一优势菌门,而蓝细菌门是浮游细菌中的第一优势菌门。 2)通过平均每孔颜色变化率值发现,浮游微生物的生物活性明显高于附着微生物,且相对附着细菌而言,浮游细菌在生态系统物质循环和能量流动方面发挥着更加重要的作用。 3)不同附着微生物与浮游微生物群落代谢功能起作用的主要碳源类型为氨基酸类、聚合糖类和醇类,不同微生物群落差异主要体现在对氨基酸类和聚合糖类碳源的利用上,尤以氨基酸类最为突出。2.2 细菌群落结构的多样性分析

2.3 微生物对6大类碳源总体利用的影响
2.4 不同微生物群落对不同碳源的利用情况
3 讨论
3.1 基于高通量测序的浮游细菌与附着细菌差异分析
3.2 基于Biolog-ECO方法的不同微生物群落功能多样性分析
3.3 不同微生物群落结构对碳源利用能力的影响
4 结论
