肝细胞癌免疫/靶向治疗中肿瘤评效标准比较
2021-11-16韩帅谷小磊李晓婷曲金荣崔湧孙应实
韩帅,谷小磊,李晓婷,曲金荣,崔湧*,孙应实
1.郑州大学附属肿瘤医院(河南省肿瘤医院)放射科,河南 郑州 450008;2.北京大学肿瘤医院暨北京市肿瘤防治研究所医学影像科 恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142;*通信作者 崔湧 yong.cui@outlook.com
肝细胞癌(hepatocellular carcinoma,HCC)的发病率居全球恶性肿瘤的第六位,死亡率居第二位[1],死亡人数占所有癌症的9%[2]。外科治疗是HCC的首选治疗方法[3],但由于HCC早期临床症状轻,不易发现,70%~80%的患者临床首诊时已为中晚期,失去了手术根治的机会,只能依靠全身性系统治疗。随着系统治疗药物不断发展,尤其分子靶向治疗及免疫治疗的出现使晚期HCC患者生存期显著提高,但由于上述疗法与传统化疗作用机制不同,治疗后的影像学改变也存在差异。选择合适的疗效评价标准准确、客观地评价疗效,及时识别获益患者,成为HCC免疫/靶向治疗的迫切需要。目前临床存在的评效标准主要包括实体瘤疗效评价标准(RECIST 1.1)、改良实体瘤评价标准(mRECIST)、欧洲肝病学会标准(EASL)、肿瘤体积评估标准(vRECIST)和三维定量强化体积评估标准(qEASL)。本研究拟比较以上5种评效标准在中晚期HCC患者免疫/靶向治疗疗效评价中的价值,并与患者生存期等进行对照,旨在筛选较为适合的HCC免疫/靶向治疗疗效评价标准,为临床诊疗提供可靠的评效方法。
1 资料与方法
1.1 研究对象 回顾性纳入2017年4月—2020年9月于北京大学肿瘤医院就诊的HCC患者54例,纳入标准:①HCC经临床或穿刺活检病理诊断明确;②经多学科诊疗团队确定不适合手术及局部治疗;③经免疫/靶向规律治疗≥6个月;④经规律CT随访,且影像显示至少1个可测量病灶(长径>10 mm)。排除标准:①治疗过程中伴有其他类型的治疗;②无规律CT检查随访;③CT扫描图像质量差,影响定量观测。其中男48例,女6例;年龄32~71岁,平均(55.1±8.6)岁。初诊23例,术后复发8例,术后复发后介入失败12例,介入治疗失败11例。美国东部肿瘤协作组(ECOG)评分[4]:12例1分,42例0分。巴塞罗那分期[5]:B期 6例,C期48例。肝功能Child-Pugh分级[6]:54例均为A级。38例伴有肝硬化,42例伴有肝炎病史(3例丙肝,39例乙肝)。11例甲胎蛋白(alpha-fetoprotein,AFP)正常,43例AFP升高。21例采用靶向药物治疗(索拉非尼),25例采用免疫+靶向治疗药物(信迪利单抗+仑伐替尼等),8例采用免疫治疗(PD-1等)。记录所有患者的无进展生存期(progression free survival,PFS),定义为患者从开始接受治疗到出现肿瘤进展或死亡的时间,随访时间截止到2020年9月30日。中位随访时间为8个月(2~32个月)。本研究经本院伦理委员会批准(批件号:2019YJZ29),豁免所有患者知情同意。
1.2 CT检查 采用GE Lightspeed 64 VCT或Discovery CT750 HD扫描仪,在治疗前及治疗后2个月均行平扫和多期动态增强检查。患者取仰卧位,扫描范围从膈顶至腹主动脉分叉处。扫描参数:管电压120 kV,自动管电流,螺距0.984,准直器宽度5 mm,扫描层厚5 mm。以高压注射器经肘正中静脉以3.0 ml/s注射碘海醇(含碘300 mg/ml)1.5 ml/kg,剂量90~120 ml。注射对比剂后分别延迟30 s、70 s、100 s行动脉期、门静脉期及延时期扫描。
1.3 肿瘤反应评估标准 RECIST 1.1测量肿瘤的最大径,无需评估肿瘤活性情况[7];mRECIST在动态增强CT动脉期评估肿瘤活性及坏死情况,测量肿瘤活性区域的最大径[8];EASL在动态增强CT动脉期测量肿瘤的整体面积及坏死区面积,去除肿瘤坏死区面积[9];vRECIST测量肿瘤的总体积,无需评估肿瘤活性情况[10];qEASL在动态增强CT动脉期测量肿瘤整体体积及坏死体积,去除肿瘤坏死区域体积[11],见图1、表1。
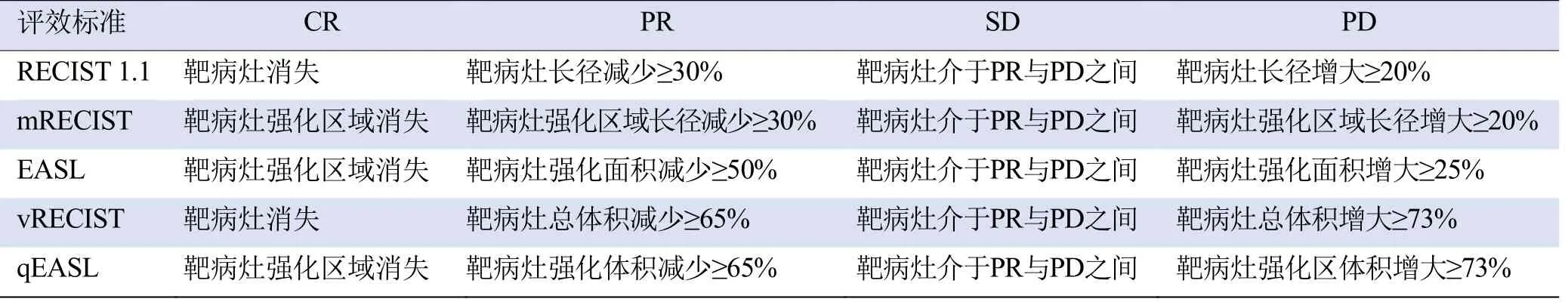
表1 肿瘤反应评估的5种评效标准
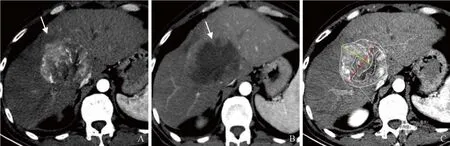
图1 男,39岁,HCC。免疫/靶向治疗前后CT图像及测量标准。A.治疗前动脉期CT图像显示肝内类圆形肿块,明显不均匀强化(箭);B.治疗2个月后动脉期CT图像显示肝内肿块体积增大,强化范围缩小,坏死区增加(箭);C.RECIST 1.1测量肿瘤最大径(红线),mRECIST测量肿瘤强化区域的最大径(黄线),EASL、qEASL测量肿瘤活性部分面积/体积(剔除坏死部分),vRECIST测量肿瘤总体积(不需要剔除坏死部分)
1.4 图像分析 由1名具有8年以上工作经验的放射科主治医师及副主任医师采用盲法独立阅片,在PACS工作站根据5种疗效标准共同确定每例患者的靶病灶(将可测量病灶定义为靶病灶,每个患者最多选择2个靶病灶[12]),当2名医师意见不一致时,由第3名具有20年工作经验的放射科主任医师决定。2名医师对所有患者治疗前及治疗2个月后CT图像进行独立测量,根据肿瘤动脉期强化区域范围,进一步观察门静脉期及延时期的强化方式,从而判定是否肿瘤活性部分,并在动脉期CT图像上测量RECIST 1.1、mRECIST和EASL,使用系统自带半自动测量软件测量vRECIST及qEASL(图1)。肿瘤评价疗效分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)、疾病进展(progressive disease,PD)。将所有患者分为治疗有效组(CR+PR)和治疗无效组(SD+PD),并根据公式(1)、(2)计算客观缓解率(objective response rate,ORR)和疾病控制率(disease control response,DCR)。

1.5 HCC肿瘤临床相关因素分组 按照性别、静脉(门静脉/下腔静脉)癌栓(是、否)、肝硬化(是、否)、 淋巴结转移(是、否)、远处转移(是、否)、肝炎(乙肝/丙肝)(是、否)、AFP正常(是、否)、肿瘤形态(不规则、圆形/类圆形)、肿瘤边界(清楚、模糊)、肿瘤动脉期强化方式(均匀强化、不均匀强化)、肿瘤紧邻肝被膜(是、否)进行分组。
1.6 统计学方法 采用SPSS 18.0软件。采用组内相关系数(ICC)评价2名阅片者之间的一致性,5种评价标准之间的一致性分析采用Kappa检验。计数资料组间比较采用χ2检验。符合正态分布的计量资料以±s表示,治疗前后两组比较进行配对t检验;不符合正态分布的计量资料以M(Q1,Q3)表示,治疗前后两组比较进行秩和检验。采用Kaplan-Meier法绘制生存曲线,采用Cox回归模型进行单因素及多因素分析,P<0.05为差异有统计学意义。
2 结果
2.1 5 种评效标准一致性分析及治疗疗效评价 2名医师采用5种评效标准对54例患者测量结果的信度好(ICC=0.962、0.968、0.922、0.931、0.84)。RECIST 1.1与vRECIST的一致性高(Kappa=0.804),mRECIST与RECIST 1.1、vRECIST的一致性差(Kappa=0.212、0.289),其余标准之间的一致性一般(Kappa=0.4~0.6),见表2。
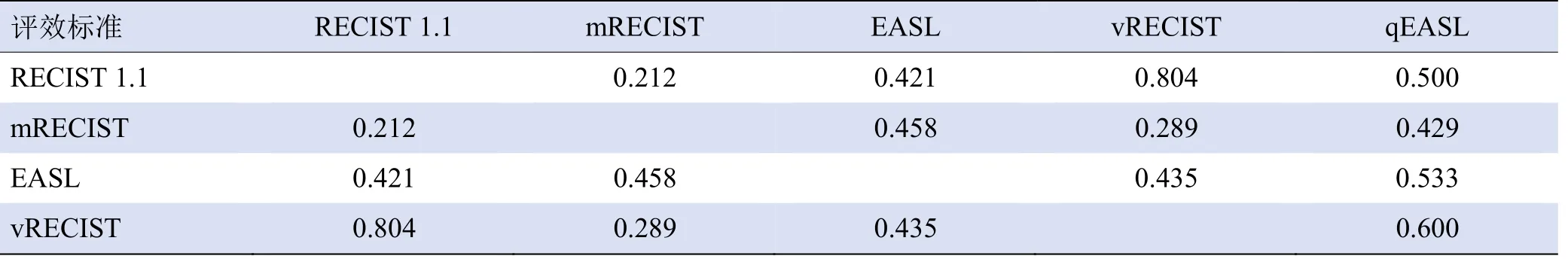
表2 5种评效标准评价HCC免疫/靶向治疗前后结果的一致性(Kappa值)
2.2 5种评效标准治疗疗效评价 54例HCC患者治疗前与治疗2个月比较,采用mRECIST时,治疗前后肿瘤变化差异有统计学意义(t=2.187,P<0.05),其余标准差异无统计学意义(P>0.05),见表3。

表3 5种评效标准评价HCC免疫/靶向治疗前后疗效比较
5种评效标准的ORR差异有统计学意义(χ2=23.46,P<0.001),其中采用RECIST 1.1及vRECIST的ORR明显低于其他3组评效标准,差异有统计学意义(χ2=15.708、8.199、7.053、13.067、6.000、4.960,P均<0.05),其他3种标准的ORR差异无统计学意义(χ2=2.55、1.824、0.064,P均>0.05)。5种评效标准间DCR 差异均无统计学意义(χ2=1.468,P>0.05),见表4。
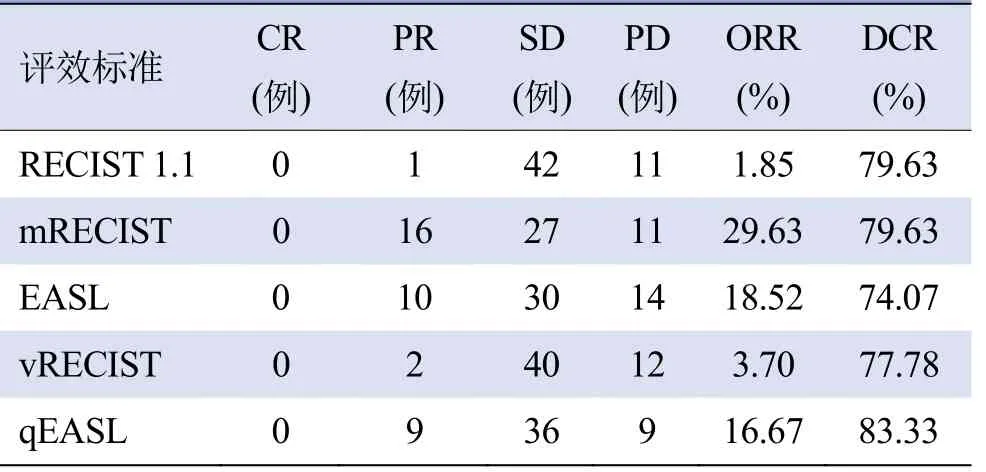
表4 5种评效标准评价HCC免疫/靶向治疗前后疗效结果
2.3 生存期单因素及多因素分析 mRECIST判断治疗无效组患者的PFS明显差于有效组,差异有统计学意义(P<0.05);EASL评价治疗无效组患者的生存曲线降低,但差异无统计学意义(0.05<P<0.15);其他3种评效标准差异均无统计学意义(P>0.05),见图2。临床相关因素中,当患者伴有静脉癌栓及远处转移时,生存较差(P均<0.05)。将单因素结果P<0.15的因素(mRECIST、EASL、是否伴有静脉癌栓、是 否伴有肝硬化、淋巴结转移、远处转移、AFP是否正常)代入多因素Cox方程,结果显示mRECIST、静脉癌栓、远处转移可独立预测中晚期HCC患者的生存期(表5、图3),其他指标均不能独立预测中晚期HCC患者治疗后生存时间(P>0.05)。
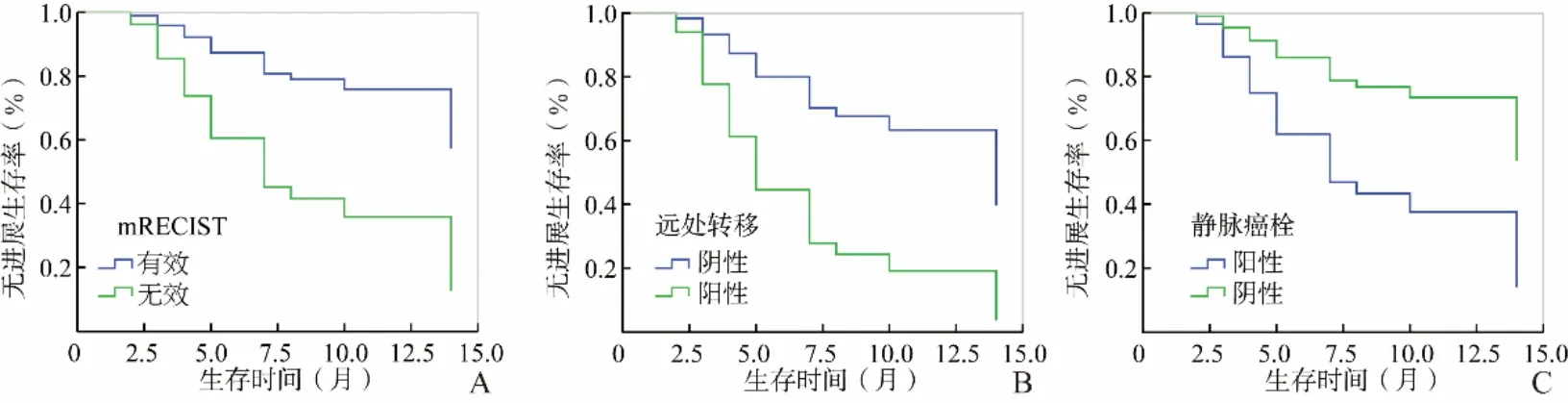
图3 中晚期HCC患者的生存曲线。A.采用mRECIST评价患者治疗是否有效;B.患者伴有远处转移;C.患者伴有静脉癌栓;HCC:肝细胞癌;mRECIST:改良实体瘤评价标准

表5 影响中晚期HCC患者PFS的单因素及多因素分析
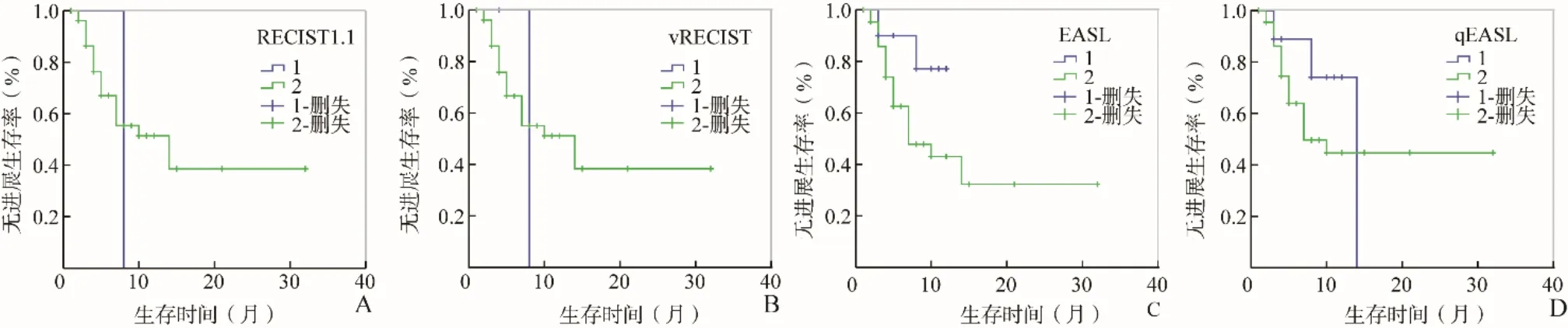
图2 中晚期HCC患者不同评效标准生存曲线。A.RECIST 1.1;B.vRECIST;C.EASL;D.qEASL;HCC:肝细胞癌
3 讨论
3.1 实体瘤疗效评价标准现状 生存时间是肿瘤长期疗效的参考指标,应用实体瘤疗效评价标准进行肿瘤疗效评估越发重要[13]。本研究中2名医师采用5种评效标准进行测量的信度均较好,提示临床应用均可靠。而经过靶向/免疫治疗的HCC患者,肿瘤早期可能仅表现出病灶密度减低,内部出现坏死,而不表现为肿瘤长径缩小,部分甚至会出现增大。目前RECIST 1.1应用最为广泛,但是RECIST 1.1与vRECIST仅关注肿瘤大小的变化,不考虑肿瘤的活性部分及坏死部分,因此存在一定的局限性[14]。本研究中,RECIST 1.1与vRECIST评估肿瘤疗效一致性高,与mRECIST的一致性差,与靳宏虎等[15]的研究结果一致,可能是因为mRECIST需要剔除肿瘤坏死部分,仅测量肿瘤活性部分。方义杰等[16]研究发现,采用RECIST评估病灶疗效而不能改变患者的生存时间。本研究也发现,在54例中晚期HCC患者中,采用RECIST 1.1与vRECIST时多数患者被评估为SD,明显低于其他3种评效标准,且评估治疗有效的患者也不能延长其生存期,提示对于免疫/靶向治疗的中晚期HCC患者,不考虑肿瘤坏死及活性部分的疗效评价标准有局限性,可能会低估患者的疗效,对指导患者治疗方案的选择具有一定的影响。
3.2 实体瘤疗效评价标准比较 本研究中,mRECIST、EASL及qEASL的一致性一般,与Zhao等[17]的研究结果大致相符。进一步分析显示,采用mRECIST评估肿瘤治疗前后大小有显著差异,而使用EASL及qEASL评估均无显著差异;54例中晚期HCC中,mRECIST的ORR稍高于EASL及qEASL,但无显著差异。Vincenzi等[18]研究发现mRECIST能较好地预测患者预后,而Zhao等[17]研究认为mRECIST及EASL均不能影响患者的生存时间。本研究发现,mRECIST评估治疗有效的患者生存期延长,且mRECIST评估患者治疗无效是独立影响生存时间的危险因素,EASL及qEASL评估有效的患者不能延长生存期,可能因为本研究纳入的研究对象均为中晚期HCC,经过免疫/靶向药物治疗后肿瘤的密度减低,坏死区通常不规则,强化部分边缘模糊,增加了边界勾勒的难度,因此对于二维及三维的测量及评估存在一定的影响;而mRECIST仅测量肿瘤活性部分的长径,操作简单,影响因素少,因此准确性更高,提示对于靶向/免疫治疗的中晚期HCC患者,采用mRECIST进行肿瘤疗效评估更准确、客观,可以初步判断患者治疗早期进展及是否有效,及时指导、提醒临床医师调整治疗方案。另外,Lee等[19]认为是否存在微血管侵犯是HCC术后复发和预后的重要因素,与本研究结果一致,提示中晚期HCC伴有远处转移、伴有静脉癌栓是患者生存期下降的独立危险因素,应加强对此类患者的随诊及综合治疗干预。
3.3 本研究的局限性 ①样本量较少,后续研究需扩大样本量进一步证实;②患者靶向/免疫治疗方案不完全统一,深入研究中将在扩大样本量的基础上进一步细化分层研究。
总之,与其他4种实体肿瘤评效标准相比,mRECIST更适用于对免疫/靶向治疗的中晚期HCC的疗效评估,可以较好地区分患者的长期预后,独立预测患者的生存时间,提示这种评效方法可能更准确。另外,当中晚期HCC伴有远处转移、静脉癌栓时,是独立预测患者生存期的危险因素。
