西伯利亚鲟和欧洲鳇肠道菌群的比较分析以及棉籽蛋白替代部分鱼粉对欧洲鳇肠道菌群的影响研究
2021-11-16邢薇罗琳
文/邢薇 罗琳
肠道作为一个大型的生态系统,存在数量巨大的微生物,肠道健康会直接影响到动物对饲料中营养物质的消化吸收以及机体自身的生长性能。肠道菌群是动物机体不可缺少的组成部分,在维持肠道健康、抵抗病原菌的入侵、调节物质代谢、能量吸收、器官发育以及机体免疫等方面发挥着重要作用。肠道菌群的种类和数量在动物健康时是处于稳定平衡状态的。
外界环境状态、遗传因素和食物的组成在很大程度上会影响到肠道菌群的结构以及多样性。钟雷等用不同含量的脱脂蚕蛹替代鱼粉饲喂后,使建鲤肠道菌群发生了改变。McKellep等分别用含有豆粕、菊粉和土霉素的饲料饲喂大西洋鲑3周,实验结束后发现鱼体后肠菌群的组成存在较大的差异,饲喂豆粕的大西洋鲑肠道菌群多样性和数量相对较为丰富一些。叶观林研究发现,当饲料中花生粕和脱粉棉籽蛋白替代鱼粉的比例分别超过30%和20%后,会使珍珠龙胆石斑鱼肠道中有益菌(拟杆菌科和毛螺旋菌科)的相对丰度降低,病原菌(弧菌科和伯克氏菌科)的丰度增加。另有研究发现,鱼类的食性对肠道微生物的组成和丰度会产生一定的影响。刘寒研究了不同食性鱼体肠道微生物的组成,发现尽管草食性和肉食性鱼类的核心优势菌(变形菌门、厚壁菌门、梭菌门和酸杆菌门)相同,但是不同食性鱼类肠道中这几种菌群丰度有明显差别。在相同条件下养殖的杂食性团头鲂肠道中梭菌属、盐单胞菌属及鲸杆菌属的比例相对较高,而肉食性鳜鱼肠道中鲸杆菌属和盐单胞菌属的比例较高,也就是说杂食性鱼类肠道微生物的多样性在一定程度上要高于肉食性鱼类。因此,了解不同条件与特性对鱼类肠道菌群的影响,对调控机体肠道菌群的组成有重要意义。
鲟鱼(Sturgeons)是软骨硬鳞鱼,现存23个种,分为4个属,其中鲟属(Acipenser)16种,铲鲟属(Scaphirhynchus)2种,鳇属(Huso)2种,拟铲鲟属(Pseudoscaphirhynchus)3种。西伯利亚鲟(A. baeriiBrandt)和欧洲鳇(H. huso)是我国鲟鱼养殖的两个主要品种。西伯利亚鲟属于鲟属,杂食性鱼类。Yun等研究结果显示给西伯利亚鲟饲喂全植物性蛋白饲料可以维持它的正常生长,也就是说尽管西伯利亚鲟是杂食性鱼类,但更偏向素食方面。Mohseni研究结果表明欧洲鳇偏肉食性,对饲料中蛋白质的需求量较高。Bour等用不同比例的豆粕替代鱼粉后,随着豆粕添加量的增加显著降低了欧洲鳇的生长性能,说明动物蛋白在欧洲鳇生长中起到了较为关键的作用。尽管西伯利亚鲟和欧洲鳇同属一个物种,但饮食习性有所不同,这可能与他们肠道微生物的组成有一定关联。
本研究旨在比较两种不同鱼粉添加量的饲料对欧洲鳇肠道菌群的影响,并分析其肠道菌群的组成,以及欧洲鳇和西伯利亚鲟在饲喂相同饲料情况下鱼体肠道微生物的组成情况,为今后在鲟鱼免疫、饲料营养等方面的研究提供依据,同时为西伯利亚鲟和欧洲鳇的健康养殖提供参考。
一、实验方法
(一)实验饲料配方与制备
本实验设计不同鱼粉含量(FM250高鱼粉:250g/kg;FM100低鱼粉:100g/kg)的两种等氮(410g/kg粗蛋白)等能(19.1MJ/kg)饲料(表1),按鱼体的大小制成2.0mm和3.0mm两种粒径的膨化颗粒。饲料于-20℃保存备用。
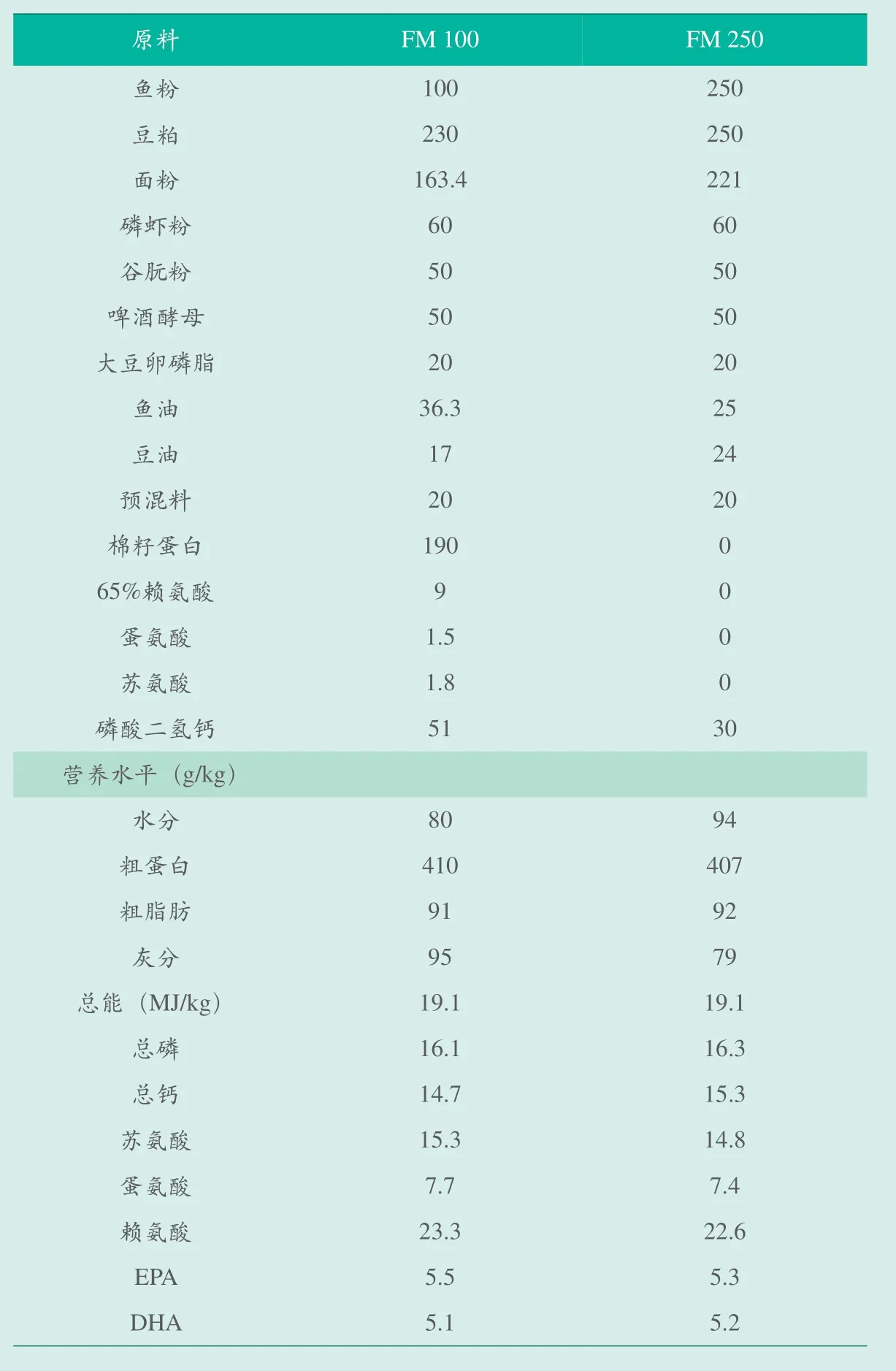
表1 饲料组成及营养水平(g/kg)
本实验设计了三个实验组:BL组(欧洲鳇,饲喂FM100)、BH组(欧洲鳇,饲喂FM250)和SH组(西伯利亚鲟,饲喂FM250)。
(二)养殖实验
本实验在北京中科天利水产科技有限公司循环水养殖车间进行。实验鱼为该公司提供的同一批次欧洲鳇和西伯利亚鲟(初始体重为37.5g)。按实验计划将鱼分为三个实验组(BL、BH和SH),每组设三个重复,养殖在同一水泥池的9个网箱(容积900L)中(20尾鱼/网箱),每天饱食投喂三次(8:00、13:00、18:00),养殖周期为16周。养殖条件:水温(18.0±1.0)℃,溶解氧>7.5mg/L,pH值(8.1±0.2),亚硝酸盐<0.1mg/L。
(三)样品采集
实验结束后,将鱼禁食2 4 h取样。分别在每个网箱中取两尾鱼,用300mg/L三氯叔丁醇麻醉后使用无菌剪刀进行腹部解剖,取带有内容物的肠道置于无菌1.5mL离心管中。于-80℃保存,用于提取总DNA。
(四)肠道细菌总DNA提取和生物信息分析
取肠道样品按照Power Fecal DNA提取试剂盒(Mo Bio,美国)说明书提取细菌基因组,用0.8%的琼脂糖电泳凝胶检测总DNA的纯度和质量,使用Malcom ES-2荧光分光光度计进行浓度测定。总DNA根据16SrRNA基因V3-V4引物:336F-806R (F:5’-GTACTCCTACGGGAGGCAGCA-3’;R:5’-GTGGACTACHVGGGTWTCTAAT-3’)在APPlied Biosystems GeneAmp 9700 PCR仪上进行PCR扩增。在北京奥维森基因科技有限公司Illumina Miseq平台进行高通量测序。
去除质量较差及不匹配的序列,得到有效数据。再用Mothur软件分析样品的α和β多样性指数,统计各组之间菌群的差异性。
(五)数据统计与分析
使用统计软件STATISTICA 7.0对数据进行单因素方差分析(one-way ANOVA),结果用平均值±标准误(Mean±SEM)表示,差异显著时通过Duncan’s进行比较,显著性水平为P<0.05。
二、结果与分析
(一)样品测序分析
BL、BH、SH组共获得了246700个高质量序列,每个样本的有效序列为13740个~28143个,有效序列长度主要分布在400bp~440bp之间。图1样本的稀释曲线逐渐平缓,说明测序的深度较为可靠,数据量也足够大,覆盖到了样本中大部分菌群。

图1 样本稀释曲线
(二)肠道微生物Alpha多样性分析
Alpha多样性分析,可以反映出肠道微生物菌落的丰富度和均匀度。Chao1、Observed species指数越大,肠道中微生物的丰富度就越高;Shannon指数、PD whole tree指数越大,肠道中微生物组成就越丰富,均匀度也更高。对BL、BH、SH三个实验组的α多样性指数统计(表2),每组样本的平均OTUs数目在191个到357个之间,覆盖率均大于99%。
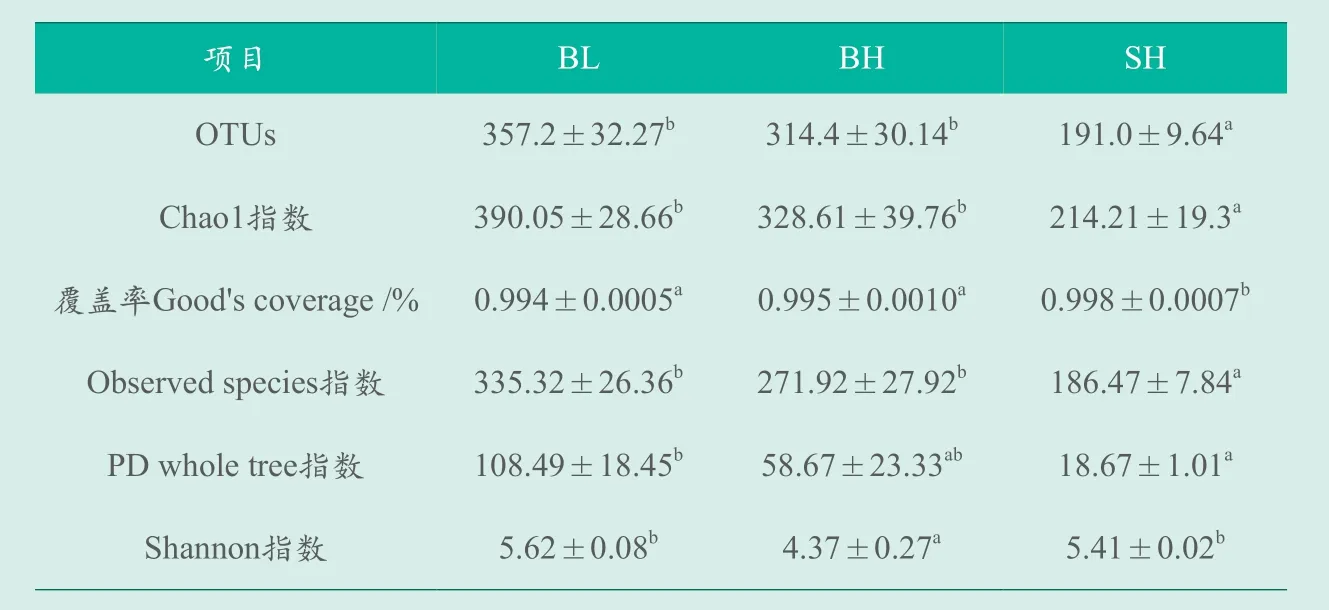
表2 鲟鱼肠道微生物α多样性比较
BH组的OTUs、Chao 1、Observed species、Shannon指数显著高于SH组(P<0.05),这两组样本的PD whole tree指数差异不显著(P>0.05)。结果表明,欧洲鳇肠道菌群的相对丰度要高一些,在相同的养殖条件下,即使饲喂相同的饲料,西伯利亚鲟和欧洲鳇肠道微生物的α多样性指数仍然存在显著差异。
BL和BH组在OTUs、Chao 1、Observed species、PD whole tree的指数都没有显著差异(P>0.05),但BH组的Shannon指数显著低于BL组(P<0.05),说明当欧洲鳇摄食低鱼粉饲料时能够增加其肠道菌群的丰富度和均匀度。
(三)肠道菌群结构的组成
根据样品的OTUs数绘制成Veen图(图2a),比较分析BL、BH和SH组间细菌的多样性。三组鲟鱼肠道样本中共有的OUTs数为243个,而BL和BH组共有的OUTs数是510个,SH和BH组共有的OUTs数是278个。在门水平上进行聚类分析,三组样本中相对丰度最高的五种菌群组成相似,为变形菌门、厚壁菌门、蓝藻菌门、拟杆菌门和放线菌门(图2b)。各组鲟鱼肠道菌群的相对丰度有所差别,BL组肠道中优势菌群由高到低依次为变形菌门>厚壁菌门>蓝藻菌门>拟杆菌门>放线菌门;BH组蓝藻菌门>变形菌门>厚壁菌门>放线菌门>拟杆菌门;SH组变形菌门>厚壁菌门>放线菌门>蓝藻菌门>拟杆菌门。

图2 OTUs分析
(四)肠道微生物β多样性分析
β多样性主要反映了样本间肠道微生物组成的相似性。非度量多维度分析(NMDS)是β多样性评价方式之一。每个点的间距可以反映出差异程度,在同一圆圈内的点代表着样本之间的差异不显著,没有交汇的圆圈内的点代表样本之间存在显著差异,两点之间的距离越近,相似度就越高。在图3中可以看出,BL组和BH组形成的圆圈有交集,说明这两组之间的差异性不显著,也就是不同的鱼粉添加量对欧洲鳇肠道微生物的组成没有显著影响。BH和SH组两组之间没有交集,表明在相同条件下即使给欧洲鳇和西伯利亚鲟饲喂相同饲料,两者肠道微生物的组成也存在着显著差异。
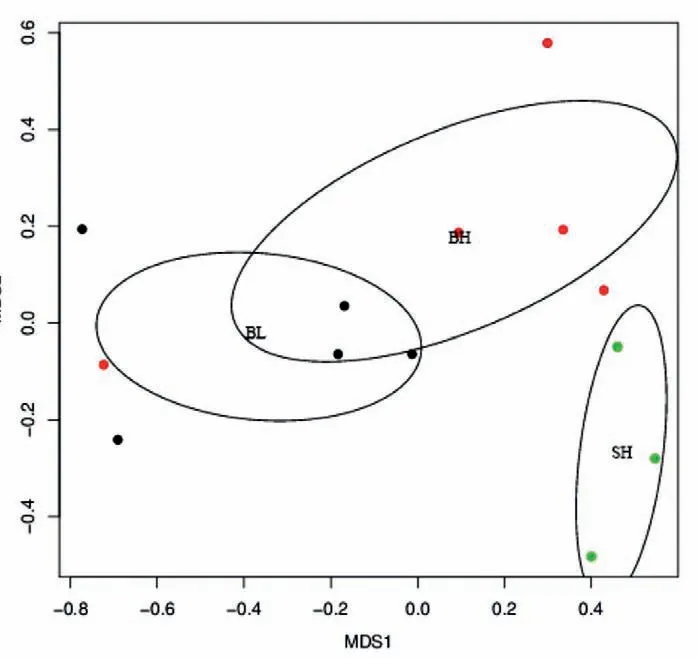
图3 鲟鱼肠道菌群的β多样性分析
(五)肠道微生物在门和属水平上的差异分析
LEfSe分析(linear discriminant analysis effect size, LEfSe)通常用于细菌分类领域,能够识别组间物种的丰度。本研究应用LEfSe分析BH、BL和SH三组之间门到属水平的菌群差异(图4)。分支进化图(图4a)显示了在BH、BL和SH三组鱼体中102个分类群的差异。图4b中,在门水平上,BL组和BH组肠道菌群的丰度有显著差异,BL组的鱼肠道中主要富集了γ-变形杆菌门和变形杆菌门;BH组的鱼肠道中放线杆菌门、棒状杆菌门和Norynebacteria富集。SH组鱼体肠道中芽孢杆菌目和芽孢杆菌属富集,与BH组存在显著差异(图4b)。

图4 LEfSe分析肠道微生物的差异
图5显示了在门和属水平上三组鲟鱼肠道菌群丰度的差异。图5a显示了在门水平上,BL组鲟鱼肠道中的变形菌门和拟杆菌门相对丰度显著高于BH组,蓝藻菌门和放线菌门的相对丰度显著低于BH组(P<0.05),两组厚壁菌门的相对丰度没有显著差异(P>0.05)。与BH组相比(图5c),SH组鲟鱼肠道中变形菌门和厚壁菌门的相对丰度显著增加(P<0.05),蓝藻菌门的相对丰度显著降低(P<0.05),拟杆菌门和放线菌门相对丰度没有显著差异(P>0.05)。
在属水平上(图5b),BL组假单胞菌属和柠檬酸杆菌属的相对丰度显著高于BH组(P<0.05);芽孢杆菌属、藤黄色杆菌属、葡萄球菌和海洋芽孢杆菌属在SH组鲟鱼肠道中的丰度显著高于BH组(P<0.05)(图5d)。Alpinimonas和不动杆菌属在三组鱼体肠道中没有显著差异(P>0.05)。
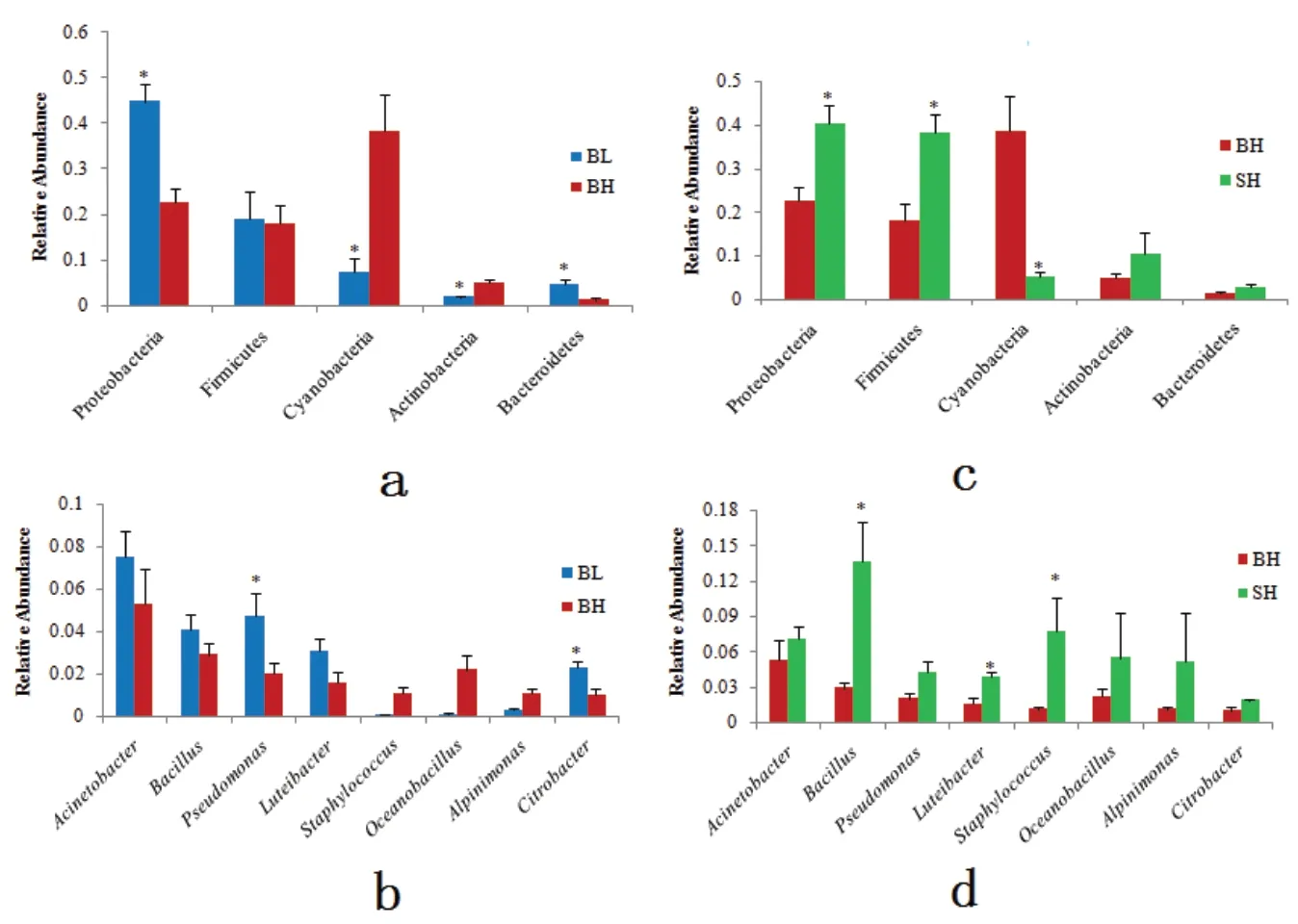
图5 道菌群在门和属水平上的差异
三、讨论
作为动物消化吸收营养物质的主要场所,肠道健康在动物的生长发育过程中较为关键。有研究者指出,肠道中的微生物可以通过分解食物获得营养物质用以提供动物体生长所需的能量,在维持机体的健康和消化吸收营养物质方面起到极为关键的作用。肠道微生物处于平衡状态时,可以维持动物体的健康状态,当其处于失衡状态时则有可能导致各种病害问题产生,因此研究鱼类肠道微生物的变化对实现鱼类健康养殖有较为重要的意义。
鱼类由于种类、食性、系统发育关系、所处水环境、生长阶段等因素的影响,其肠道菌群的结构和丰度在种内和种间也存在着一定的差异。在相同养殖条件下,排除环境及生长阶段的干扰,饲喂相同饲料的BH组和SH组鱼体肠道主要菌群在门水平上都是变形杆菌门、厚壁菌门、蓝藻菌门和放线菌门,与大多数鲟鱼肠道微生物群落组成的研究结果一致,但是两组鱼体肠道中优势菌群的相对丰度有所不同。Li等在关于鲤鱼的研究中发现,同一养殖条件下,不同种类的鲤鱼肠道菌群组成也有所差异。Hsu等用16SrDNA技术对三种不同鳗鲡肠道菌群的研究表明,不同种类的鳗鲡肠道菌群组成受到了其种质特性的影响。Navarrete等与Zhao等研究发现,宿主的基因也会对其肠道微生物组成产生影响。在本研究中,BH组和SH组鱼体肠道微生物α和β的多样性指数存在显著差异,尽管西伯利亚鲟和欧洲鳇摄食相同的饲料,但是两者肠道中微生物的多样性和丰富度有所不同,与Li等研究结果一致,说明鲟鱼的食性以及基因型比水环境更能影响肠道微生物群落的组成。
Catalán等在对大西洋鲑的研究中发现,分别饲喂添加鱼粉、豆粕及发酵豆粕的饲料后,鱼体肠道菌群的组成受到了外源饵料的影响。本研究中,排除环境及生长阶段的干扰,在相同养殖条件下,饲喂不同鱼粉添加量饲料的欧洲鳇,BL组和BH组鱼体肠道的优势菌在门水平上都是变形杆菌门、厚壁菌门和蓝藻菌门,但在相对丰度上差异显著,说明用不同饲料饲喂欧洲鳇,会对其肠道菌群丰度产生影响。BL组和BH组除Shannon指数外,其他α和β多样性指数都没有显著差异,也就是说,不同鱼粉添加量的饲料对同一种类鱼体肠道菌群的丰度影响不大。Estruch等研究发现植物性饲料替代鱼粉后,金头鲷肠道菌群的α多样性指数和物种系统发育距离没有显著差异,这与本研究的结果相似。BL组的Shannon指数显著高于BH组,说明低鱼粉的饲料能够提高欧洲鳇肠道菌群的多样性。
在门水平上,BL组鱼体肠道中变形杆菌门和拟杆菌门的丰度要显著高于BH组,蓝藻菌门的丰度显著低于BH组。有研究发现,在草食性动物体中,拟杆菌门是普遍存在的,与肉食性动物相比,草食性动物更容易积累拟杆菌。因此推断,BL组鱼体肠道中变形杆菌门和拟杆菌门的细菌丰富度较高可能是与BL组饲料中鱼粉被部分棉籽粉所替代有关。
在科和属的水平上,BL组鱼体肠道中的假单胞菌和柠檬酸杆菌的相对丰度显著高于BH组(P<0.05)。有研究指出,柠檬酸杆菌是一种重要的纤维素降解菌。在本研究中,欧洲鳇被饲喂低鱼粉饲料时,为了提高对饲料中纤维素的消化率,其鱼体肠道中柠檬酸杆菌的丰度增加了。Liu等研究发现,柠檬酸杆菌是草食性鱼类肠道最丰富的细菌之一。Wu等对草鱼的研究表明,在草鱼肠道中柠檬酸杆菌的量最为丰富;与饲喂酪蛋白饲料相比,饲喂豆粕的草鱼肠道中假单胞菌的丰度更高。本研究中欧洲鳇饲喂高植物蛋白饲料时,假单胞菌的数量也会增加。也就是说,饲料营养水平对欧洲鳇肠道菌群结构的影响要强于其自身的遗传因素。
四、结论
综上所述,作为同一科的两个不同物种,西伯利亚鲟和欧洲鳇之间食性的差异非常显著。本研究中,在相同的条件下饲喂相同饲料,两种鱼体的肠道菌群组成有所差异,表明了内源性因素对鱼体肠道菌群的影响要显著高于外源性环境因素。本研究还发现,与高鱼粉饲料相比,饲喂欧洲鳇低鱼粉饲料,更能增加其肠道菌群物种的多样性。因此,在鲟鱼养殖过程中,还应考虑饲料因素对鱼体肠道菌群的影响。
