CDE饮食诱导慢性肝损伤小鼠肝组织YAP信号对肝祖细胞增殖的影响*
2021-11-16沈镇扬王俊俊陆伦根蔡晓波
沈镇扬,王俊俊,陆伦根,蔡晓波
慢性肝病时,肝祖细胞的增殖形式主要表现为胆管反应[1-3]。Hippo信号通路与细胞增殖密切相关,Yes相关蛋白(Yes-associated protein,YAP)作为其核心效应分子在其中起到了重要的作用[4-9]。本研究构建了胆碱缺乏、乙硫氨酸补充(choline-deficient、 ethionine-supplemented, CDE)饮食小鼠模型,并采用免疫组化染色观察到模型组肝组织胆管反应增多,经Western blot和qPCR方法检测发现模型组肝组织YAP表达增高,免疫荧光染色进一步确定模型组肝祖细胞YAP表达增强。本研究在体外通过YAP过表达和敲减慢病毒感染肝祖细胞,并采用EdU和CCK8检测证明肝祖细胞YAP过表达能促进细胞增殖,而敲减YAP后细胞增殖减弱,以上研究为慢性肝病肝再生的调控机制和治疗研究提供了新的思路。
1 材料与方法
1.1 动物、病毒与试剂 6~8周龄雄性野生型C57BL/6J小鼠购自维通利华实验动物公司,饲养在上海市第一人民医院实验动物中心;过表达慢病毒和敲减慢病毒购自上海吉凯基因公司;William’E培养基、胎牛血清、青霉素和链霉素等细胞培养液均购自美国 Gibico公司;蛋白提取试剂,BCA 蛋白浓度测定试剂等购自上海雅酶生物公司;RNA 提取试剂、逆转录试剂和qPCR试剂均购自日本TAKARA公司;抗YAP抗体、荧光标记的二抗购自美国CST公司;抗GAPDH抗体和辣根过氧化物酶标记的二抗购自上海生工生物公司;抗CK19抗体购自武汉塞维尔公司;细胞计数试剂盒8-CCK8(日本Dojinto公司);EdU增殖检测试剂盒(广州锐博生物公司);免疫组化试剂盒(上海基因科技公司);HE染色试剂盒(武汉赛维尔公司)。
1.2 CDE饮食小鼠模型制备 将15只小鼠随机分成3组,每组5只。给予第一组小鼠正常饮食和饮水(wild type, WT组);给予第二组CDE饮食(CDE组);给予第三组相同CDE饮食,用于提取原代肝祖细胞(原代细胞提取组)。在造模3 w后,处死各组小鼠,取出肝脏,用于后续实验。
1.3 原代肝祖细胞分离与培养 参照先前文献报道的方法[10],在原代细胞提取组小鼠,取肝脏,采用两步灌注法和密度梯度离心法分离肝祖细胞。以1×106cell/ml密度接种于含William’s E完全培养基含10%胎牛血清、100 U/ml青霉素-链霉素溶液(美国 Gibico公司)、10 μg/ml胰岛素(上海翊圣公司)、30 ng/ml胰岛素样生长因子II和20 ng/ml表皮生长因子(美国PeproTech公司)]的培养皿中,放入37℃、5%CO2的培养箱中培养。5 d后,用克隆环挑取单克隆细胞集落,传代培养3代,获得稳定的肝祖细胞,用于后续实验。
1.4 肝组织蛋白表达检测 采用Western blot法,在肝组织中加入小钢珠和含PMSF的RIPA裂解液,在组织振荡裂解仪和超声裂解仪裂解组织,离心取上清,采用BCA法测定蛋白含量并调整浓度使其均一。在100℃金属浴煮沸10 min,充分变性,上样蛋白并行SDS-PAGE电泳。然后,将蛋白转移到PVDF膜上,加5%脱脂牛奶室温封闭1 h,用TBST洗涤5 min,3次。加抗YAP抗体或抗GAPDH抗体,4℃孵育过夜;用TBST洗涤5 min,3次;再加山羊抗兔辣根过氧化物酶标记的二抗,室温孵育1 h;用TBST洗涤5 min,3次;用超敏ECL化学发光液显影、拍照。
1.5 肝组织基因水平检测 采用实时荧光定量PCR法,用Trizol法提取组织RNA,测定各组RNA含量。取RNA 1000 ng,在37℃ 15 min 和 85℃ 5 s行逆转录,采用PCR法检测YAP mRNA水平,扩增所用的引物由上海生工生物公司合成,其序列见表1。

表1 qPCR引物序列
1.6 肝组织蛋白表达检测 采用免疫组化和免疫荧光法,取石蜡包埋组织切片,脱蜡、水化,用柠檬酸抗原修复液进行抗原修复,加内源性过氧化物酶阻断剂(武汉博士德公司)阻断15 min,加5%BSA室温封闭1 h,加抗CK19抗体,4℃过夜,再加生物素标记的二抗,室温孵育1 h,加DAB显色剂显色,苏木素复染核,封片后在光镜下拍照;在免疫荧光检测前,脱蜡水化抗原修复同前,加5%BSA室温封闭1 h,加抗CK19或抗YAP,4℃过夜,加荧光标记的二抗,室温避光孵育1 h,加DAPI染色10 min,用抗荧光淬灭封片剂(上海翊圣公司)封片,在荧光显微镜下观察。
1.7 慢病毒转染 将生长良好的肝祖细胞接种到24孔板,调整细胞密度为2×105/mL,37℃、5%CO2培养箱中培养,待细胞培养至50%融合度时,换新培养基。随机将细胞分为四组:分别加入YAP过表达慢病毒(YAP-overexpression,YAP-OE)、过表达空载体慢病毒(overexpression-control,OE-control)、YAP敲减慢病毒(short hairpin RNA-YAP,shYAP)和敲减空载体慢病毒(short hairpin RNA-control,sh-control)原液各10 μl,混匀后,在培养箱中继续培养3 d。在荧光显微镜下观察荧光强度。转染成功的细胞表达绿色荧光蛋白。对转染的细胞进行5 μg/ml的嘌呤霉素筛选,筛选完成后收集各组蛋白和RNA,进行后续Western blot和qPCR验证。
1.8 EdU细胞增殖检测 将各组肝祖细胞以5×104/mL密度接种在24孔板中,24 h后,根据制造商说明书要求处理细胞,在荧光显微镜下拍照观察,并计算各组细胞增殖率。
1.9 细胞活力测定 将各组肝祖细胞以2.5×104/mL密度接种在96孔板中,使用细CCK-8试剂盒,根据制造商说明书在12 h、24 h、48 h和72 h,用酶标仪测定450 nm波长处的吸光度(OD值),即细胞活力检测。
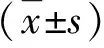
2 结果
2.1 各组小鼠肝组织病理学表现 野生型小鼠经CDE饮食喂养3 w后,肝组织炎症和胆管样增生反应较对照组明显;免疫组化检测显示,CDE组肝组织胆管反应增强(图1)。
图1 各组肝组织病理学表现A:WT组(HE,100×);B:CDE组(HE,100×);C:WT组(CK19染色,100×);D:WT组(CK19染色,400×);E:CDE组(CK19染色,100×);F:CDE组(CK19染色,400×)
2.2 各组小鼠肝脏YAP表达比较 在CDE造模3 w后,经Western blot和qPCR检测发现,CDE造模组小鼠肝组织YAP蛋白表达水平较对照组增强。与此同时,CDE造模组YAP mRNA水平较对照组提高了2.45倍(P<0.01)。免疫荧光检测提示,CDE造模组肝组织CK19和YAP共表达的细胞数较对照组增加(图2)。
2.3 各组肝祖细胞增殖能力比较 肝祖细胞稳定过表达YAP后,EdU检测发现在相同培养条件下,YAP-OE组EdU阳性细胞比例较OE-control组显著增加[分别为(0.41±0.05)和(0.25±0.06),P<0.01];CCK8检测提示随着培养时间的延长,YAP-OE组细胞增殖活性较OE-control组明显提高,在培养72 h时较对照组提高了1.78倍(P<0.01);在敲减YAP后,EdU检测发现在相同培养条件下,shYAP组EdU阳性细胞比例较sh-control组显著减少[分别为(0.25±0.04)和(0.13±0.02),P<0.01],CCK8检测提示随着培养时间的延长,shYAP组细胞增殖活性较sh-control组明显降低,在培养72 h时较对照组降低了1.92倍(P<0.01)。综合以上可知,肝祖细胞YAP过表达后其增殖能力显著高于YAP敲减组(图3)。
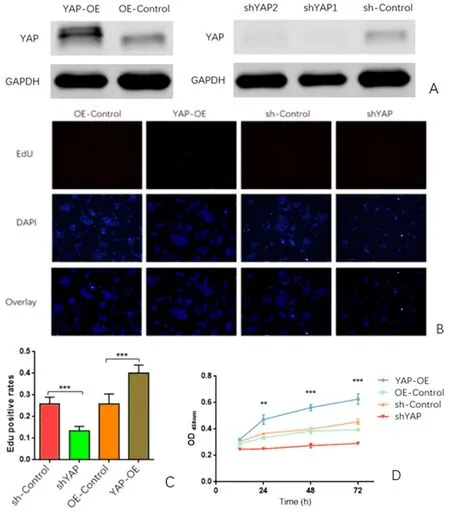
图3 各组肝祖细胞增殖能力比较A:各组YAP蛋白水平验证;B:EdU检测各组细胞增殖能力变化(100×);C:各组EdU阳性细胞比例差异;D:CCK8检测各组细胞增殖能力变化(与对照组比,**P<0.05,***P<0.01)
3 讨论
肝祖细胞是一种卵圆形、高核质比的细胞,位于肝实质细胞与汇管区交界的Hering’s 管,从形态和体积上类似于胆管上皮细胞。肝祖细胞具有肝细胞、胆管细胞双向分化潜能,同时表达胆管上皮细胞标志物CK7、CK19 和肝细胞标志物白蛋白、CK8、AFP,也表达干细胞标志物 CD133、OV6和NCAM 等。最近一个对人胚胎肝脏单细胞分析的研究进一步确认其存在[5,11]。在慢性肝损伤状态下,当正常肝细胞衰老或增殖被抑制时,肝祖细胞可分化成为成熟的肝细胞。由于在病理而非生理条件下参与肝脏的更新,因此被称为肝脏再生的次要机制或病理性再生[4,12]。因此,在慢性肝损伤时,肝祖细胞的有效增殖和分化或许是决定这些肝病患者预后的关键。
多种信号通路参与肝祖细胞增殖和分化的调控,如HGF/c-Met、FGF17、Hedgehog等[4]。Hippo信号通过调控细胞增殖、凋亡和干细胞自我更新来控制器官组织再生,该通路失调会导致器官持续性增生和肿瘤的发生等重大疾病。YAP转录共激活因子是Hippo信号通路关键效应分子,在该通路被激活时,YAP发生磷酸化修饰而滞留在胞质无法行使转录激活功能。相反,该通路被抑制后,非磷酸化修饰的YAP能够进入细胞核与转录因子TEAD等结合进而启动下游一系列促增殖、抗凋亡和细胞干性相关基因的表达。近年来,越来越多的研究显示YAP也参与肝脏炎症、纤维化和再生。在非酒精性脂肪性肝病,YAP活化的活性胆管细胞数量与肝纤维化进展相关。在化学损伤诱导的小鼠模型,肝细胞中上调的YAP水平被认为能促进肝脏炎症和纤维化。使用MST1/MST2抑制剂激活YAP,能增强对乙酰氨基酚和四氯化碳中毒或胆管结扎引起的急慢性损伤后的肝脏修复,并减轻肝纤维化。另一项研究表明,成年小鼠肝细胞活化的YAP过表达可触发其转分化为祖细胞样细胞,该细胞可能分化为胆管上皮细胞或再分化为肝细胞。总之,YAP 的激活可能通过两种不同的机制来促进肝脏再生:肝细胞增殖和转分化为祖细胞样细胞。
为进一步明确YAP对肝祖细胞的增殖是否有影响,本研究构建了慢性肝损伤模型来观察损伤情况下肝脏胆管反应程度与YAP表达之间的关系,研究结果显示损伤组肝脏YAP蛋白和基因水平明显增加,肝祖细胞YAP表达也显著高于对照组,表明肝组织特别是肝祖细胞YAP表达与慢性肝损伤时胆管反应相关。在体外,我们分离了原代肝祖细胞,并构建过表达和敲减YAP慢病毒载体感染的肝祖细胞,结果发现肝祖细胞过表达YAP后细胞增殖能力得到了显著的提升,而敲减YAP后肝祖细胞的增殖受到了显著的抑制。
