水溶性香豆素荧光底物的制备及在液滴数字式检测中的应用
2021-11-15匡小军伊京伟方晓霞赖东梅
匡小军,伊京伟,方晓霞,赖东梅,徐 宏
(1.上海交通大学生物医学工程学院,Med-X研究院,2.上海交通大学医学院,中国福利会国际和平妇幼保健院,上海200030)
随着人们对生命科学研究的日益深入,生物标志物的检测受到了越来越多的重视.由于受分析灵敏度的限制,目前传统的检测方法仅能检测到十分之一的人类已知蛋白[1],致使大量与疾病相关的低丰度生物标志物无法得到临床应用,因此开发高灵敏的检测方法至关重要.相较而言,液滴数字式检测方法(如数字式酶联免疫检测,ddELISA)的检测灵敏度极高、隔离分区不受限,是较有可能应用于临床的低丰度生物标志物检测技术[2,3].该技术采用结合有特异抗体的磁性微球捕获待测蛋白,通过稀释样本,使待测蛋白数量小于磁性微球数量.根据泊松分布,每个磁性微球表面至多捕获一个待测蛋白,并形成单磁球-单靶标蛋白的复合物;将形成的磁球-蛋白复合物或空白磁球逐一分隔到液滴分区微反应器中,此时每个分区根据内含物不同,分为仅有一个微球-待测蛋白复合物的“阳性”分区、仅有一个微球(不含待测蛋白)的“阴性”分区和仅有酶反应底物溶液的“背景”分区[4].通过结合在待测蛋白上的酶催化分区中的底物分子产生荧光信号,使“阳性”分区的信号强度区别于“阴性”分区,进而统计“阳性”分区和“阴性”分区的数量,结合泊松分布计算即可得到微球捕获的待测蛋白的绝对数目,从而实现待测蛋白的数字式定量检测.与传统的ELISA法和其它常用常见的检测方法[5,6]相比,此方法的灵敏度提高了上千倍,可检测低至amol/L水平的待测物[4],在生物检测中具有广泛的应用前景.
ddELISA需要通过酶催化底物分子来使含有目标蛋白的阳性分区荧光信号区别于无目标蛋白的阴性分区,但大部分常用的荧光底物分子,如常见的荧光素、试卤灵和香豆素等[7,8]的水溶性较差,而ddELISA检测中各个水相分区均需要通过油相进行分隔,酶催化后的荧光分子易从水相的液滴渗透扩散至进入周围的油相,进而扩散到邻近的液滴分区中,致使阳性液滴的荧光信号扩散到阴性液滴,阴性和阳性信号无法准确区分而严重干扰检测结果[8~10].目前最常见的底物分子为4-甲基伞形酮磷酸酯(4-MUP),因其催化产物4-甲基伞形酮(4-MU)具有出色的荧光性能而广泛应用于ddELISA中,然而目前研究表明其存在荧光分子扩散的局限,导致检测时间窗口短、检测线性范围小,限制了其在基于液滴的酶促检测体系中的应用[8,11,12].
目前降低荧光泄露的方法主要有微加工阵列物理隔离液滴,或加入BSA和糖等抑制扩散的分子,以及对底物分子进行改性等方法.微阵列方法设计液滴储液腔以隔离单个液滴,减少了阳性液滴与阴性液滴间的串扰,但这种方法加工过程繁琐,且在固定的芯片面积下隔离液滴数量有限,不利于大规模应用[11].加入BSA和糖[13,14]等虽然也可以降低扩散,但由于反应体系的改变,可能会影响反应动力学和分区的稳定性,且不能完全杜绝扩散的影响.对底物改性、增加荧光产物的水溶性是简单易行、可大规模应用的方法[9,13].研究表明,荧光分子的扩散速率除了与液滴间的荧光分子浓度梯度有关外,还与荧光分子辛醇-水分配系数(Partition coefficient,lgD)相关,在相同的液滴体系下,lgD越小说明荧光分子的水溶性越高,扩散速率越小[8].因此,可以根据染料分子的辛醇-水分配系数预测其在液滴中的扩散.如在香豆素的环上修饰亲水性分子以降低其辛醇-水分配系数.Woronoff等[9]将磺酸基团和羧酸基团修饰在香豆素环上,得到的香豆素类荧光分子的lgD均较低,在液滴中可以稳定保持数天;而未经修饰的香豆素在2.1 s时即扩散了50%.Najah等[15]同样将磺酸基团引入香豆素环中,发现底物可以在液滴内孵育长达24 h而不影响检测.但是上述工作合成香豆素的方法均采用磺酸等亲水性较强的基团,需要多步反应,过程较为复杂,不易于推广.因此,基于已有的香豆素衍生物制备新的具有抑制扩散能力的香豆素底物,可以简化合成路径,方法更易推广,具有良好的应用前景.
本文通过模拟计算发现,将4-甲基伞形酮(4-MU)的4位甲基改成乙酸甲酯基团(7-羟基香豆素-4-乙酸甲酯,C-2)后,无需再改为羧酸等亲水性更强的基团即可实现降低扩散的效果,其荧光特性也未改变.在液滴中的扩散实验也证实C-2具有优良的抑制扩散的特性,可以稳定地存放1 d以上而不影响对应阴、阳液滴的判读;而4-MU在液滴中,5 min即发生明显扩散.以C-2为催化产物制备的碱性磷酸酶底物7-二羟基磷酸酯香豆素-4-乙酸甲酯(C-4)具有与以4-MU为催化产物的碱性磷酸酶底物4-MUP相似的酶催化性能.对本课题组前期构建的球刷酶[11]的数字检测也证明了C-4底物比4-MUP底物具有较好的抑制扩散性能和更优的检测性能.Scheme 1给出球刷酶数字式检测示意图.

Scheme 1 Schematic of droplet based digital detection
1 实验部分
1.1 试剂与仪器
7-羟基香豆素-4-乙酸(纯度97%)购自上海阿拉丁生化科技股份有限公司;O,O-二甲基磷酰氯(纯度96%)、四甲基碘硅烷(TMSI,纯度99.9%)、4-甲基伞形酮(4-MU,纯度98%)、4-甲基伞形酮磷酸酯(4-MUP,纯度98%)、碱性磷酸酶(AKP,来源于牛肠粘膜,BioUltra)和1-乙基-3-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDC,BioUltra)购自德国Sigma-Aldrich公司;其余合成C-4所用试剂均为分析纯,均购自国药集团化学试剂有限公司,未经任何后处理;三(羧甲基)氨基甲烷盐酸盐缓冲溶液(Tris-HCl,100 mmol/L,pH=9.0,1 mmol/L MgCl2),2-(N-吗啡啉)乙磺酸缓冲溶液[MEST,10 mmol/L,pH=5.0,含0.05%(质量分数)Tween-20],磷酸盐缓冲溶液[PBST,10 mmol/L,pH=7.4,含0.05%(质量分数)Tween-20].
Dx-Drp8M型液滴生成仪,中国卡尤迪公司;IX83 Olympus型荧光显微镜,日本奥林巴斯公司;Photometrics Prime BSI型CCD相机,美国Photometrics公司;SpectraMax i3x型酶标仪,美国Molecular Devices公司;AvanceⅢ600 MHz型核磁共振波谱仪(1H NMR,13C NMR),瑞士Bruker公司;Q-TOF Premier型高分辨质谱仪(HRMS),美国Waters公司.
1.2 实验过程
1.2.1 碱性磷酸酶底物7-二羟基磷酸酯香豆素-4-乙酸甲酯(C-4)的合成 碱性磷酸酶底物C-4的合成步骤见Scheme 2.

Scheme 2 Syntheses of alkaline phosphatase substrate 7⁃(dihydroxyphosphoryloxyl)coumarin⁃4⁃acetic acid methyl ester(C⁃4)
参照文献[16]方法合成化合物C-2上的酯基.1H NMR(600 MHz,DMSO,25℃),δ:10.60(s,1H),7.52(d,J=8.7 Hz,1H),6.80(dd,J=8.7,2.3 Hz,1H),6.73(d,J=2.3 Hz,1H),6.24(s,1H),3.95(s,2H),3.65(s,3H),与文献[16]报道相符.
在氮气保护下,将50 mg(0.214 mmol)化合物C-2溶解于10 mL干燥的二氯甲烷中,加入295.8 mg(2.14 mmol)碳酸钾,在冰浴下搅拌均匀;逐滴加入0.046 mL(0.428 mmol)O,O⁃二甲基磷酰氯,室温下反应过夜.反应结束后过滤,用蒸馏水洗涤滤液,收集有机相,有机相经无水硫酸钠干燥,旋转蒸干溶剂后得到粗产物,粗产物经硅胶柱层析分离纯化[洗脱剂:V(二氯甲烷)∶V(乙酸乙酯)=10∶1]得到产物C-3,产率为58%.1H NMR(600 MHz,CDCl3,25℃),δ:7.59(d,J=8.9 Hz,1H),7.26~7.19(m,2H),6.38(s,1H),3.94(s,3H),3.91(s,3H),3.78(s,2H),3.77(s,3H);13C NMR(125 MHz,CDCl3),δ:168.88,159.91,154.69,153.24,147.32,125.91,116.62,116.39,116.20,108.85,55.25,55.19,52.82,38.00;HR-MS(ESI-QTOF),(M+H)+(计算值),m/z:343.0583(343.0583).
在氮气保护下,将40 mg(0.12 mmol)化合物C-3溶解于8 mL干燥的二氯甲烷中,冰浴下逐滴加入72 mg(0.36 mmol)四甲基碘硅烷,室温下搅拌反应3 h,加入8 mL 3 mmol/L HCl淬灭反应;再搅拌反应12 h;用氯仿清洗反应液,直到有机相和水相均呈无色为止,收集水相,经冷冻干燥后得到产物C-4,产率为53%.1H NMR(600 MHz,D2O,25℃),δ:7.65(d,J=8.8 Hz,1H),7.24~7.16(m,2H),6.39(s,1H),3.98(s,2H),3.69(s,3H).
1.2.2 球刷酶SP-AKP的制备 参照文献[17]方法,在粒径为116 nm的二氧化硅纳米颗粒表面聚合丙烯酸链段,得到聚合物为300的球刷SP-300.参照文献[11]方法制备SP-AKP.将80μL MEST(AKP浓度为2 mg/mL)加入至120μL含20 mg球刷SP-300的MEST中,于37℃旋转反应15 min;产物用MEST清洗2遍后,加入120μL 0.5 mmol/L EDC的MEST溶液,室温下反应2 h;所得产物用PBST缓冲液洗3遍,保存在200μL Tris-HCl缓冲液中.AKP的偶联量检测使用BCA方法,收集原液、反应上清液和每一步的洗涤液上清液.采用每30 s测得的酶催化底物C-4产生的荧光强度变化(λex=370 nm,λem=465 nm)计算AKP和SP-AKP的催化活性.
“红船精神”是激励我们大胆探索、创新创业的强大思想武器。首创精神昭示我们,在社会发展的历史进程中,我们不能因循守旧、安于现状,必须勇立潮头、敢为人先,坚持用时代发展要求审视自己,以改革精神创新发展理念,以创新的精神永葆党的生机和活力。面对新挑战、新机遇、新形势和新任务,我们要坚持和发扬“红船精神”,有敢于突破前人的勇气和智慧,自觉克服安于现状、不思进取的思想观念,坚持用创新的理论成果武装头脑,用创新的思想观念谋划工作,紧紧扭住发展不放松,与时俱进,勇于改革创新,不断推进建设中国特色社会主义的伟大事业。勇于改革创新,敢为人先,始终保持共产党人的首创精神,夺取新征程上的更大胜利。
1.2.3 底物的酶催化性能检测 将荧光产物4-MU和C-2溶解于100μL Tris-HCl缓冲液中,浓度为50μmol/L,采用酶标仪测定其荧光光谱并绘制荧光标准曲线.使用不同浓度的底物(0.01 nmol/L~2μmol/L),光栅确定为λex=9 nm,λem=15 nm,在最佳激发波长处激发,在最佳发射波长处检测荧光强度用于绘制标准曲线(C-2:λex=370 nm,λem=465 nm;4-MU:λex=365 nm,λem=455 nm).
先用Tris-HCl缓冲液配制系列浓度底物C-4和4-MUP(浓度为0.1μmol/L~200μmol/L),同时用Tris-HCl将AKP浓度稀释至所需浓度,然后混合底物和酶,使总体积为100μL.在室温下使用酶标仪测试酶催化动力学,光栅确定为λex=9 nm,λem=15 nm,每隔30 s测试一次,共测试30 min(C-4:λex=370 nm,λem=465 nm;4-MUP:λex=365 nm,λem=455 nm).通过荧光产物的荧光标准曲线得到催化过程中荧光产物的浓度,进而通过米氏方程(Michaelis-Menten equation)拟合得到酶催化反应常数.
1.2.4 液滴生成和检测方法 液滴生成装置由液滴生成仪和对应的液滴生成芯片组成,每个芯片一次性可以做8个通道,每个通道10 min可以生成约3×105个液滴,每个液滴直径为50μm,体积为65 pL.检测系统包括荧光显微镜和CCD相机.
液滴生成芯片采用经典的流体聚集液滴制备方法,使用的是“十字形”单水相芯片结构,油相为配备的氟化油,水相需要先混合底物和球刷酶再加入水相通道中.首先,用Tris-HCl缓冲液稀释系列浓度的SP-AKP溶液,再将5 mmol/L的底物与SP-AKP溶液按体积比1∶1混合后加入20μL至水相孔中,同时向油相孔中加入60μL氟化油.将芯片放入仪器约10 min即可制得所需的油包水液滴.然后,将液滴加入液滴储存腔室内,在室温下孵育,液滴中SP-AKP催化底物生成荧光产物使得液滴产生荧光信号.最后,利用倒置荧光显微镜在10倍物镜下使用CCD相机拍摄荧光图片(曝光时间固定为20 ms),同时拍摄液滴的明场图片用于分析(曝光时间固定为10 ms).液滴的荧光信号读取及分析使用Image J软件.
2 结果与讨论
2.1 荧光产物C⁃2的荧光性质及底物C⁃4的酶催化性能
如图1(A)所示,经过在线ACD/I-Lab模拟计算(https://ilab.acdlabs.com/iLab2/index.php)发现,在pH=9的环境中,C-2和4-MU的辛醇-水分配系数lgD分别为0.35和0.78,表明C-2具有更好的水溶性.
为避免改性对染料荧光性质的影响,首先对C-2的荧光光谱、荧光强度与浓度的标准曲线进行了检测和对比.由图1(A)可见,修饰后的C-2与4-MU相比,最佳激发峰和发射峰均略有右移,但与文献[7]报道的4-MU的λex=372 nm和λem=445 nm相近.从2种荧光物质的荧光标准曲线图[图1(B)]也可看出,在相同条件下,修饰后的C-2荧光性能略优于4-MU.以上结果表明,在香豆素4位上修饰的乙酸甲酯基团并未对香豆素荧光性能产生显著影响.
进一步探究了其对应C-4底物的酶催化活性.通过分别配制不同浓度的底物溶液,加入相同量的碱性磷酸酶后,根据荧光产物的摩尔量计算反应速率,进而拟合得到酶催化的米氏方程:

式中:v0[mol/(L•s)]为反应初始速率;Km(mol/L)为米氏常数;vmax[mol/(L•s)]为酶反应最大速度;[S](mol/L)为底物浓度.

Fig.1 Basic property characterization of 4⁃MU,C⁃2,4⁃MUP,C⁃4 and SP⁃AKP
通过方程拟合,可以得到米氏常数(Km)和最大催化速率vmax,酶催化的速率常数Kcat(s−1)按照下式计算:

式中:Etotal(mol/L)为加入酶的总浓度.
由图1(C)可见,修饰后的C-4底物和4-MUP底物的米氏常数分别为8.88和11.33μmol/L,最大反应速率分别为1.94和1.17 nmol/(L·s),由式(2)计算得到C-4底物和4-MUP底物酶催化反应常数分别为936和1552 s−1.结果表明,与未修饰的4-MUP底物相比,修饰后的C-4仍具有较高的酶催化活性,具备应用于ddELISA检测的潜力.此外,两底物的催化速率与文献[7,18]报道的数据略有差异,可能是由于使用的酶不同导致的.
本文采用前文[11]方法制备SP-AKP,经过BCA法测得球刷偶联酶的浓度为608.7μg APK/mg球刷,每个SP-AKP纳米颗粒含有大于1×10−4个AKP分子.图1(D)结果显示,SP-AKP固定酶的催化活性是自由酶AKP的0.26倍,即相当于每个SP-AKP含有2600个AKP,具有较强的催化性能.上述结果均与文献[11,19]结果吻合.
2.2 荧光产物C⁃2的防扩散性能
为验证荧光分子C-2在液滴中的防扩散性能,以含有2 mmol/L C-2或4-MU的液滴作为初始阳性液滴,以不含有荧光产物的液滴作为阴性液滴,将初始阳性液滴与阴性液滴以体积比1∶4混合后通入液滴储存腔中,并在不同时间点统计阳性液滴和阴性液滴的荧光强度和比例.将初始阴性液滴荧光分布峰进行高斯拟合,得到高斯拟合的平均值和标准差,取平均值加上10倍标准差得到的数值作为阳性/阴性液滴的划分阈值.由图2(A),(C)和(E)可见,4-MU组的液滴在5 min时即出现4-MU从阳性液滴扩散进入阴性液滴的现象,导致阳性液滴荧光信号降低而阴性液滴荧光信号增强的现象,从而使部分阴性液滴被误认为阳性液滴;在第10 min时,已有60%以上的阴性液滴由于扩散导致的信号增强而被辨别为阳性液滴;在60 min时,由于所有液滴均有荧光信号,阴阳性液滴已无法区分.与4-MU组相比,C-2组在24 h时仍维持20%的初始阳性液滴比例[图2(B),(D)和(E)].由图2(D)可见,阴性液滴的荧光强度始终维持在2500以下,而阳性液滴平均荧光强度维持在15000以上,阳性/阴性液滴区分显著,证明C-2在液滴中的防扩散性能显著优于4-MU,可实现24 h以上的稳定检测及阴性液滴和阳性液滴的准确读取.
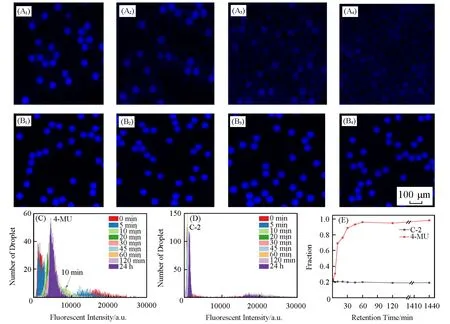
Fig.2 Characterization of fluorescent product(C⁃2 and 4⁃MU)leakage in droplets
已有研究表明,在以氟化油为油相的液滴体系中,香豆素染料在液滴中的保留时间与辛醇-水分配系数(lgD)有关,lgD越小的荧光分子在液滴中的保留时间越长,越不容易扩散[8,9].实验中发现,4-MU和C-2的lgD分别为0.78和0.35,虽然2种荧光物质均倾向于溶解在油相中,但是与4-MU相比,C-2的lgD更小,在液滴中的保留时间更长.小分子荧光染料C-2和4-MU在氟化油的溶解度较低[19],且C-2长时间放置也会引起背景的微弱增强[图2(D),放置24 h后背景液滴的荧光强度有所增加],可见C-2与4-MU在氟化油体系中的扩散可能是染料在水油界面的扩散所致[8].但由于液滴体系的酶促数字式检测所需时间相对较短,通常在十几分钟至1小时内均可完成[7],在此期间C-2几乎无扩散,因此C-2对应的碱性磷酸酶底物C-4有望应用于液滴体系的酶促数字式检测中,从而改善现有4-MU荧光分子扩散的情况.
2.3 液滴数字式检测中的底物防扩散性能
在验证了对应荧光产物的防扩散性能后,进一步对2种底物在液滴数字式检测体系中的防扩散性能进行了验证.在2.5 mmol/L底物终浓度下,测试了不同孵育时间下的液滴荧光强度分布,结果如图3(A)和(B)所示.将SP-AKP分散液与5 mmol/L的底物按体积比1∶1混合后,加入液滴生成仪中生成液滴;在室温下孵育不同时间后,将液滴放入液滴存储腔中进行观察.在随机分布中,当目标物SPAKP的浓度较低时,每个液滴中装载的SP-AKP数量服从泊松分布.大部分液滴均没有装载SP-AKP(阴性液滴),只有少部分的液滴装载1个或多个SP-AKP(阳性液滴).使用理论上每个液滴中装载的平均SP-AKP的数量(λT)来计算SP-AKP的浓度,λT使用泊松分布公式计算[19]:

式中:fon为阳性液滴占总液滴的比例.
由于4-MUP扩散性较强,实验选用较低的SP-AKP浓度(平均每个液滴可以分配0.04个SP-AKP,即理论λT=0.04),结果如图3(A)所示.由于4-MUP酶促荧光产物4-MU的扩散,使得阳性液滴与阴性液滴荧光强度分布峰难以区分,故采用统一阈值的方法.以阳性峰和阴性峰区分较为明显的10 min为基准,将阳性峰和阴性峰相交处的荧光强度确定为区分阳性和阴性液滴的阈值,以此阈值作为其余时间点的阳性和阴性液滴的划分界限.图3(C)和(D)分别为孵育不同时间下的液滴荧光强度分布和实际计算得到的λT.可以看出,4-MUP在实际孵育过程中,阳性液滴的荧光强度逐渐升高,实际计算的λT也逐渐升高,在孵育10 min时与理论λT最为接近.后续由于荧光产物4-MU的扩散影响,孵育10 min后实际计算的λT超过了理论λT,说明大量的阴性液滴由于荧光强度增加而被划分为阳性液滴.从图3(A)中30 min的液滴荧光图也可看出阳性液滴出现明显扩散现象,导致其周围的阴性液滴荧光强度显著增加,难以与阳性液滴区分,从而影响检测结果.该结果与文献[11]报道一致.

Fig.3 Characterization of 4⁃MUP and C⁃4 in droplets over time
由图3(B)与3(E)可见,与4-MUP相比,C-4在10 min时即可较好区分阴性液滴与阳性液滴,且随着孵育时间的延长,阳性液滴的荧光强度逐渐增加,而阴性液滴荧光强度基本不变;孵育20 min时阳性液滴信号峰已与阴性液滴完全分离;延长孵育时间至60 min时,阳性液滴和阴性液滴依然可明显区分.由图3(F)可见,从5 min到60 min,实际计算的λT与理论λT均较为吻合,即无阴性液滴被识别为假阳性液滴的情况发生.
以上结果可证明,合成的C-4可在液滴体系中酶促产生不易扩散的C-2荧光分子,且在不同的检测时间均可得到准确的λT值.与4-MUP相比,C-4体系对检测时间的选取可操作性较大,更有利于ddELISA检测,实现信号的准确判读.
2.4 模拟液滴数字式检测中的性能对比
为了探究底物C-4在ddELISA检测中的检测性能,以4-MUP底物作为参照,使用球刷酶SP-AKP模拟待测物进行数字式检测.根据2.3节所得结果分别选择10和20 min作为4-MUP和C-4的孵育时间.图4(A),(C)和(D)示出了4-MUP在模拟数字式检测中的结果.由于4-MUP的酶催化荧光产物4-MU扩散性较强,较难区分阳性峰和阴性峰.故实验中以最低λT(0.0007)时的结果为标准,对此条件下的阴性液滴峰进行高斯拟合,采用阴性液滴峰的平均值加上10倍标准差作为区分阴阳性峰的阈值,所有浓度均使用该阈值.由图4(A)和(C)可见,随着SP-AKP浓度的增加,即理论λT的增加,实验所得实际λT也随之增加.然而由于荧光产物4-MU的扩散,即使在较低λT(0.0007)时,依然存在荧光物质扩散的现象[见图4(A)],阳性液滴和阴性液滴判读困难,导致每个浓度的变异系数(CV)均高于20%.在理论λT低于0.069时,检测得到的实际λT低于理论λT,说明部分阳性液滴由于荧光扩散的影响被划为阴性液滴.但是在高浓度时由于阳性液滴数量较多,大量荧光产物4-MU扩散进入阴性液滴,部分阴性液滴因荧光强度升高而被划为阳性液滴,导致最终计算得到的实际λT远大于理论λT.从结果来看,4-MUP的检测时间较难控制,且在不同SP-AKP浓度下均会受到扩散的影响,阴性、阳性峰区分不明显,判读误差大,难以应用于基于液滴的酶促数字式检测中.
底物C-4则展示了优异的数字式检测性能.由图4(B)可见,随着SP-AKP浓度的增加,均能明显区分阳性峰和阴性峰.由图4(E)可以看出,实际得到的λT与理论λT符合,一致性高,除背景CV略大于20%,其余浓度下的检测CV均低于10%.即使在高浓度λT=0.55的检测中,CV仅为6%,依然保持了较低的变异系数.以背景加3倍的标准差计算检出限(LOD),发现该检测体系LOD达到了29.9 amol/L[图4(F)],与相同体系使用微阵列隔离液滴降低扩散的方法相比降低了一个数量级[11],显著优于传统的酶促数字式检测体系.本文方法的线性范围为29.9 amol/L~14.5 fmol/L,检测范围近3个数量级,也比微阵列隔离的数字式检测方法显著提升.以上结果均证明,本文构建的底物C-4适用于基于液滴的酶促数字式检测,并可达到比传统数字式检测方法更优的检测性能与线性范围.
3 结 论
对香豆素荧光产物进行简单改造,即合成了水溶性较高的荧光产物C-2,降低了荧光产物的辛醇-水分配系数;改造后的荧光产物C-2在液滴中具有显著的抑制荧光扩散作用,即使存放24 h仍无明显扩散现象.作为对比,常用的4-MU在液滴中扩散明显,在5 min时即出现明显的扩散.在液滴数字式检测SP-AKP时发现,改性后底物C-4可有效抑制荧光产物的扩散,确保了数字式信号读取的准确性,检出限低至29.9 amol/L,检测性能显著优于以4-MU为底物的数字式检测系统,且对于高浓度的SP-AKP检测依然表现出低变异系数和高一致性的优良性能.因此,底物C-4有望替代4-MUP用于数字式检测应用中.此外,本文方法还可拓展到以C-2为荧光产物的其它酶底物的合成中,如半乳糖苷酶等.