重组酶聚合酶扩增技术及其在生命科学领域的应用
2021-11-15施宁雪靳晶豪陈孝仁
施宁雪,靳晶豪,陈孝仁*
(扬州大学 园艺与植物保护学院,江苏 扬州 225009)
自1983年引入经典的聚合酶链式反应(Polymerase chain reaction, PCR)方法以来,核酸扩增技术已经渗入到生命科学的各个领域当中[1]。普通的PCR技术需要通过连续的温度变化(变性、退火与延伸)来实现核酸的扩增,而这些繁琐的变化过程需要借助于如PCR仪这样精密的循环仪器,这便将实验限制在传统实验室内。自1990年以来,大量的等温核酸扩增技术得到应用,如环介导等温扩增技术、单链置换扩增技术[2]、多重链置换扩增技术、滚环扩增技术[3]、依赖解旋酶的扩增技术[4]、基于核酸序列的扩增技术以及重组酶聚合酶扩增技术[5]等,这些等温核酸扩增技术与基于PCR的核酸扩增技术相比,具有特异性高、灵敏度强、操作简单、反应时间短、不需要特殊仪器且反应最佳温度适中(37~42 ℃)等优点。
其中值得注意的一项技术是RPA (Recombinase polymerase amplification,重组酶聚合酶扩增)技术。它由Piepenburg等[6]于2006年开发,虽引入时间较晚,但其具有的多项优点使得检测操作可以在现场进行,而不是仅限于实验室内,因而迅速得到大众的青睐。2014年,由英国Twist DX公司推出的商业化RPA试剂盒使检测更加方便,同时结合多种探针,扩大了RPA技术的应用范围[7]。本文对RPA技术的原理、应用及其发展前景等进行综述。
1 RPA技术介绍
1.1 反应原理
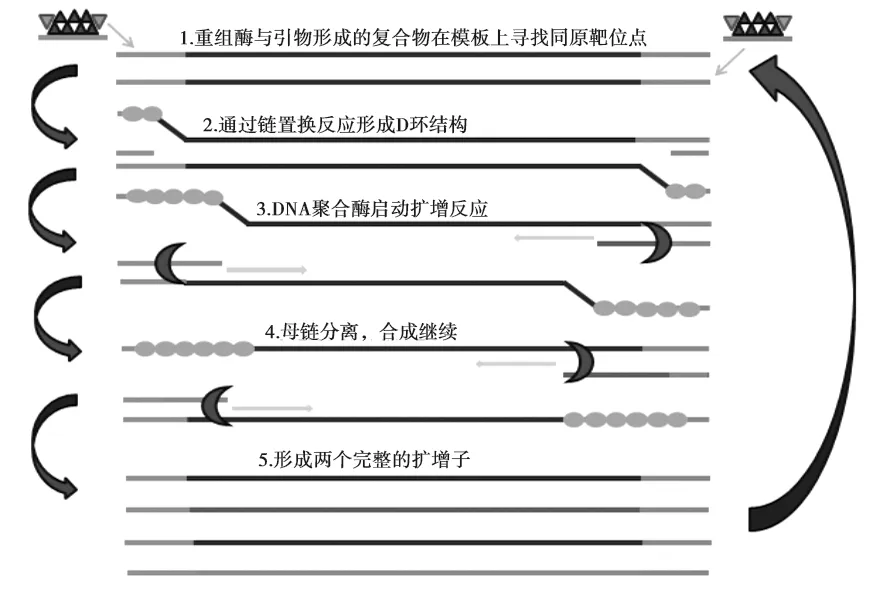
该技术的反应原理如图1所示。RPA反应主要依赖来源于T4噬菌体的重组酶UvsX和重组酶负载因子UvsY(辅助蛋白)、单链结合蛋白(Single-stranded DNA-binding protein, SSB) Gp32、链置换DNA聚合酶Bsu (BacillussubtilisPol)或Sau (StaphylococcusaureusPol),然后以T4噬菌体核酸复制机制为原理实现模板的扩增。首先,在ATP (Adenosine triphosphate)的参与下引物与重组酶UvsX形成核蛋白丝复合物,该复合物在目标双链DNA中双向扫描寻找同源序列,一旦找到同源序列,重组酶会将此位置的双链DNA解离,并形成D环结构;此时的D环一侧为双链,发生链置换反应,而另一侧为单链,由SSB蛋白Gp32稳定;然后核蛋白丝复合物主动水解ATP使其构象发生变化,重组酶解离后引物3’端暴露,此时DNA聚合酶Bsu与引物3’ 端结合,DNA扩增反应启动形成新的互补链。在这个反应中,正向引物和反向引物分别介导的反应过程是同时进行的,新形成的单链与原始链互补配对,形成完整的扩增子代。扩增子代会不断重复此步骤,扩增产物成指数型增长,整个过程一般在20 min内即可完成。反应中由于SSB蛋白与UvsX之间存在引物结合位点的竞争,而UvsY辅助蛋白能够侵入SSB蛋白覆盖的引物,从而阻止SSB蛋白与引物结合所发生的重组现象并可促进UvsX与引物的结合[6,8]。
1.2 引物设计原则
(1)与普通PCR相比,RPA反应所需引物相对较长,一般在30~35 bp,过短会影响重组酶的生物活性,过长则会增加形成二级结构的可能性;
(2)引物的GC含量在30%~70%,避免形成二级结构与发卡结构等;
(3)引物5′ 端的前3~5个核苷酸避免出现连续的鸟嘌呤,最好是胞嘧啶,能促进重组;
(4)引物3′ 端的后3个核苷酸最好是胞嘧啶和鸟嘌呤,有助于提升聚合酶的稳定性;
(5)避免出现回文序列和连续重复等特殊序列[9,10]。
2 RPA技术产物的检测方式
2.1 琼脂糖电泳凝胶检测法
最初采用此方法检测RPA扩增产物。除了需要添加重组酶、单链结合蛋白与DNA聚合酶之外,其余成分与普通PCR相同。通常在37 ℃条件下反应20 min即可获得大量目的片段。由于反应液中的酶类、蛋白以及拥挤试剂(crowding agents)会影响目的片段在琼脂糖凝胶中的迁移[11],因此首先需要通过去污剂或DNA纯化试剂盒对扩增产物进行纯化处理后方可进行凝胶电泳检测,最后在凝胶成像仪下对目的条带进行检测。虽然该方法操作难度低,且仅需要一对引物即可完成,但电泳凝胶检测延长了整个检测时间。
2.2 实时荧光定量检测法
该方法是目前检测RPA产物最常见的方法。相比于基础的RPA反应体系,实时荧光定量检测法需在RPA扩增体系中加入一个核酸外切酶Ⅲ (Exonuclease Ⅲ,EXO)和exo探针,继而可通过荧光信号的变化实现模板扩增的实时检测。探针长45~52 bp,两侧分别携带一个荧光基团和一个淬灭基团,中间为无碱基位点,可以是四氢呋喃(Tetrahydrofuran, THF)或dSpacer,在探针的3′末端有阻断剂,防止聚合酶从末端延伸。当探针完整时,荧光微弱;当无碱基位点被核酸外切酶切开时,淬灭基团被释放,荧光基团荧光强度增强,此时模板的实时扩增即被检测到[12,13]。
2.3 侧流层析试纸条检测法
与其他检测方法相比,侧流层析试纸条检测法(Lateral flow dipstick-RPA, LFD-RPA)的检测仪器小巧,方便携带。该方法将免疫技术、分子杂交技术、胶体金标记技术以及侧流层析技术结合于一体,利用三明治夹心法进行检测。相比于基础的RPA反应体系,LFD-RPA扩增体系中需要加入一个核酸外切酶Ⅳ (Endonuclease Ⅳ, NFO)、nfo探针和带有地高辛或生物素标记的反向引物。探针长46~52 bp,5′端标记荧光基团,3′端磷酸化处理,中间有一个无碱基位点。首先扩增产物被生物素标记,然后与荧光基团标记的特异性探针杂交。核酸外切酶Ⅳ切开nfo探针的无碱基位点,产生自由的羟基端与DNA聚合酶结合启动延伸,形成带有探针荧光基团与生物素的双标记扩增子。然后利用侧流层析试纸条对扩增产物进行检测[12,13]。
试纸条上有一条含有生物素抗体的检测线与一条含有固定抗体的对照线。当扩增子的荧光基团FAM(6-carboxy-fluorescein)与FAM抗体的金标物结合形成免疫复合物时,免疫复合物由于层析作用会向下扩散,首先流经检测线,扩增目的片段中的生物素标记会与检测线中的生物素抗体结合显色。之后流经对照线,会与对照线上的特殊抗体结合显色。此反应一般在37~39 ℃条件下进行,5~15 min就可以完成检测,且检测结果肉眼直接可判,适用于现场检测[14]。
2.4 酶联免疫吸附技术检测法
酶联免疫吸附技术(Enzyme linked immunosorbent assay, ELISA)检测法利用抗原和抗体的特异性反应,将可溶性的抗原或抗体吸附到固相载体上,从而进行定性和定量检测。通过探针与标记产物的特异性结合,用比色免疫分析法进行分析。该技术综合了RPA和ELISA两种技术的特点,不仅在特异性、灵敏度方面表现出较大优势,还操作简单,不需要热循环与产物纯化等过程[13],可在短时间内检测大量样品,适用于资源匮乏的现场检测。
2.5 PCR检测法
DNA提取时间较长,而且有时也会产生扩增抑制剂影响实验结果。在RPA-PCR检测法中,RPA引物能够直接从简单处理过的植物中扩增靶标和一些侧翼区域,再利用PCR引物直接从RPA反应中以指数形式扩增目标。该方法可以降低反应速率,促进靶标的扩增[15]。
3 RPA技术的应用
随着RPA技术的发展,在食品安全监测、人畜病害防治、植物病害诊断等方面开始采用RPA技术进行相关检测,出现了大量的应用报道。
3.1 在食品安全方面的应用
Lutz等[16]最早将RPA与离心微流控盒相结合,用于金黄色葡萄球菌(Staphylococcusaureus)耐药基因(mecA)的全自动分析,引起食品安全研究者的注意。此后该技术不断应用于食源性病毒、食源性致病菌、转基因植物等方面的检测,为食品安全领域的检测提供了新的思路。
3.1.1 食源性病毒的检测 食源性病毒指的是以食物为载体,导致人类疾病的病毒,包括以粪-口途径传播的病毒或者是以畜产品为载体传播的病毒。只要有微量的食源性病毒即可导致机体发病。PCR技术可以检测出此类病毒,但由于耗时较长、需要特殊的仪器设备等不适用于现场检测,而RPA技术的出现则解决了这一难题,使检测该类病毒变得更快、更便捷且准确性高。Liu等[17]将口蹄疫病毒(Foot-and-mouth disease virus, FMDV)的3D基因作为RPA的靶标序列,运用侧流层析RT-RPA技术在15 min内通过手心加热成功检测出该病毒,灵敏度与实时RT-PCR相同,并且与经典猪瘟病毒、猪繁殖与呼吸综合征病毒、猪圆环病毒2和伪狂犬病病毒等无交叉感染。Gao等[18]以猪肝为研究对象,建立了用于检测基因型4的戊型肝炎病毒(Hepatitis E virus, HEV)的实时荧光定量逆转录结合重组酶聚合酶扩增技术(Quantitative real-time reverse transcription combining recombinase polymerase amplification assay, qRT-RPA)方法,与qRT-PCR相比,两者检测限相同,然而后者耗时60 min,前者只需 3 min,且前者回收率比后者高,为室外HEV的检测提供了快速方法。在样品制备和处理步骤中存在或可能引入了许多物质(例如抑制剂),会干扰核酸扩增,当RPA反应体系中这些物质较多时反应会被强烈抑制。针对此问题,Ahmed等[19]优化了反转录重组酶聚合酶扩增技术(Reverse transcription recombinase polymerase amplification, RT-RPA),检测出H5N1禽流感病毒;Moore等[20]也利用RT-RPA检测出诺如病毒Gll.4。
3.1.2 食源性致病菌的检测 食源性致病菌是指以食品为传播媒介,可以引起食物中毒的致病性细菌,直接或间接污染食品及水源,人经口可感染,从而导致食物中毒。食源性致病菌的样品处理通常需要冗长的富集步骤,对于生长缓慢的致病菌而言,需要的时间更长,而RPA技术能够快速检测出致病菌,提高了检测效率。Hice等[21]使用磁性离子液能够快速浓缩和提取沙门氏菌(Salmonella),为RPA检测提供了致病菌的富集方法。Li等[22]基于LFD-RPA,利用沙门氏菌特有的fimY基因[23]作为靶基因,在短时间内能够用肉眼直接观察到检测结果。Wang等[24]通过改进LFD-RPA系统,在基因组上设计引物对,检测单核细胞增生李斯特菌(Listeriamonocytogenes),能消除引物二聚体的假阳性信号,为检测其他病原体提供了方法。Maestu等[25]首先利用免疫磁分离技术进行样品的预处理,然后用qRPA (Real-time recombinase polymerase amplification)来检测李斯特菌,该方法既可以从复杂的食品基质中分离和浓缩出不同的病原体,去除抑制性化合物,也可以降低背景微生物的发生率。Hu等[26]基于LFD-RPA技术能够快速检测出生牛乳样品中的大肠杆菌(Escherichiacoli) O157∶H7,具有很高的灵敏度。除此之外,RPA技术还可用于副溶血性弧菌(Vibrioparahaemolyticus)[27]、金黄色葡萄球菌[28]、克罗诺杆菌(Cronobacter)[29]、布鲁氏菌(Brucella)[30]、空肠弯曲菌(Campylobacterjejuni)[31]等的检测。
3.1.3 转基因植物及其产品的检测 目前,转基因技术正快速应用于作物遗传育种,导致越来越多的转基因植物和食品流向市场,快速识别转基因植物及其产品需要合适的检测技术。RPA技术凭借自身优势被优先选用于转基因食品的检测。Wang等[32]以GTS 40-3-2大豆为研究对象,开发了一种简单可视、基于体热孵育的RPA检测技术,利用NaOH方法提取大豆DNA后,再用手心温度进行孵育,然后加入荧光染料,最后在紫外线工具照射下即能目测荧光结果。Xu等[33]根据花椰菜花叶病毒35S启动子和根癌农杆菌胭脂碱合酶基因(NOS)终止子的调控序列,设计了两组RPA引物,并建立了用于转基因作物筛选和检测的实时RPA检测方法。Li等[34]应用荧光RPA技术,研发出了转基因玉米Bt11的快速检测方法,根据Bt11外源插入DNA以及插入位点旁侧序列设计RPA引物及探针,可以特异性区分出转基因玉米品系。此外,RPA检测方法也用于转基因水稻[35]、大豆[36]、棉花[37]等的检测。
3.1.4 其他方面的检测 除了上述类型的应用之外,其他与食品相关的检测也运用了RPA技术。如:Santiago等[36]还将ELISA技术与RPA技术结合,应用于过敏源(如榛子、花生、大豆、番茄和玉米)的检测。Jauset等[38]以羽扇豆过敏源β-粘连蛋白为研究对象,创新建立了适体重组酶聚合酶扩增(Aptamer-recombinase polymerase amplification, Apta-RPA)的检测方法,使用针对β-粘连蛋白的第二种适体(β-conglutin binding aptamer II, β-CBAII),利用适体亲和力和特异性,将β-CBAII用于快速检测β-粘连蛋白,为检测食品中过敏源提供了新的思路。Cao等[39]使用SYBR Green I荧光染料与RPA技术,在37 ℃的条件下,可以有效、快速地识别出掺入羊肉和牛肉的1%猪肉,并且结果可视化,可用于肉类掺假的检测。
3.2 在人畜病害方面的应用
自Euler等[40]用RPA检测出土拉弗朗西斯菌(Francisellatularensis)后,该技术渐渐广泛应用于导致人畜病害的病毒、细菌、寄生虫等方面的检测,有力地推动了人畜病原体的现场检测工作。
3.2.1 病毒的检测 病毒病的暴发会对人畜造成巨大的伤害,因此在造成损失前检测出这些病毒至关重要。RPA技术可用于多种病毒的即时检测且无交叉感染。Zhang等[41]首次建立了登革热病毒(Dengue virus, DENV)的RT-LFD-RPA检测法,能同时检测4种血清型的登革热病毒,具有较好的重复性,检测限都低于10拷贝/反应。Li等[42]使用引物和exo探针快速实时检测了反刍兽疫(Peste des petits ruminants, PPR),与实时RT-PCR的灵敏度相同,与PPR的4个谱系都没有交叉反应,特异性较高。Kong等[43]通过生物传感器集成的可穿戴微流控设备,用手腕温度可进行人类免疫缺陷病毒(Human immunodeficiency virus,HIV)DNA的RPA扩增,再借助手机的荧光检测系统,在24 min内即可完成检测,适用于有限环境资源中的HIV即时检测。Nybond等[44]将等温扩增人腺病毒(Human adeno virus,HADV) DNA与纸基垂直微流控装置(Paper-based vertical flow microarray,VFM)结合,能减少分析物在转移过程中受到的阻碍,接着利用功能化金纳米粒子对扩增子进行比色检测,且该装置能够重复利用,适用于即时诊断。刘文俊等[45]首次建立了动物A型流感病毒(Influenza A virus,IAV)的LFD-RPA检测方法,该方法不依赖任何仪器设备,操作简单、快速,可为基层实验室临床快速检测和流行病学研究提供帮助。目前RPA技术还适用于猴痘病毒(Monkeypox virus)[46]、新城疫病毒(Newcastle disease virus)[47]、鲤春病毒血症病毒(Spring viremia of carp virus)[48]、非洲猪瘟病毒(African swine fever virus)[49]、犬细小病毒(Canine parvo virus)[50]等的检测。
3.2.2 细菌的检测 RPA技术与其他多种方法结合,可更好地实现样品的处理和信号扩增,有效减少实验步骤和时间。Higgins等[51]通过结合内部扩增对照模板,利用双重RPA能检测出肺炎链球菌(Streptococcuspneumonia)、脑膜炎奈瑟氏菌(Neisseriameningitidis)和流感嗜血杆菌(Haemophilusinfluenza),并成功展示了双重RPA测定法的临床诊断实用性。Chen等[52]开发了用于检测尿液中铜绿假单胞菌(Pseudomonasaeruginosa)、奇异变形杆菌(Proteusmirabilis)等的碟式RPA芯片,可同时检测两个样本,加快了尿路感染病原菌的诊断。由于叠氮溴化丙锭可以穿过死亡细菌细胞膜并在强光下与DNA结合,Chen等[53]用叠氮溴化丙锭RPA法,消除了从死细胞中提取的DNA对检测结果的影响,在20 min内能够检测到化脓性链球菌(Streptococcuspyogenes)和无乳链球菌(Streptococcusagalactiae)。Saxena等[54]对鼻疽伯克霍尔德菌(Burkholderiamallei)进行了LFD-RPA检测,具有较高的灵敏度,对于早期及时控制、治疗人类和动物疾病至关重要。除此之外,RPA也成功运用于鲍曼不动杆菌(Acinetobacterbaumannii)[55]、结核分枝杆菌(Mycobacteriumtuberculosis)[56]、炭疽芽孢杆菌(Bacillusanthracis)[57]、溃疡分枝杆菌(Mycobacteriumulcerans)[58]、胞内劳森菌(Lawsoniaintracellularis)[59]等的检测。
3.2.3 寄生虫的检测 由于大多数寄生虫体积较小,甚至用显微镜观察都不够清晰,而利用不同的探针、引物设计,RPA技术能准确检测出这些寄生虫。Cui等[60]利用LFD-RPA成功检测到犬类血液中的吉氏巴贝斯虫(Babesiagibsoni),灵敏度是常规PCR的20倍。Crannell等[61]开发了多重RPA方法,从粪便样品中提取寄生虫的DNA后,能够同时检测出贾第鞭毛虫(Giardia)、隐孢子虫(Cryptosporidium)和阿米巴虫(Entamoeba),也可以通过重新设计引物和探针序列检测出其他多种靶标寄生虫。Lalremruata等[62]通过RT-RPA检测到低密度的恶性疟原虫(Plasmodiumfalciparum),与LAMP和普通PCR相比,具有高度准确性和灵敏度,对于防止该类疾病的传播具有重要意义。Gunaratna等[63]在提取杜氏利什曼原虫(Leishmaniadonovani) DNA时加入了磁珠,随后与RPA检测技术结合,大大缩短了实验时长,适合于现场检测。RPA不仅能检测以上寄生虫,还应用于日本血吸虫(Schistosomajaponicum)[64]、弓形虫(Toxoplasmagondii)[65]、吕氏泰勒虫(Theilerialuwenshuni)[66]、克鲁氏锥虫(Trypanosomacruzi)[67]等的检测。
此外,RPA技术还应用于立克次体[68]、支原体[69]、癌症[70]、等位基因[71]等方面疾病的快速检测。
3.3 RPA技术在植物病害诊断方面的应用
自Zhang等[72]首次应用RPA检测李痘病毒(Plum pox virus, PPV)以来,该技术获得了植物病害研究者的关注,将其用于病毒、细菌、真菌、线虫等病原物的检测,促进了植物病害诊断工作的顺利开展。
3.3.1 植物病毒的检测 常规的植物病毒病诊断主要依赖病害症状的观察和核酸、血清学等技术手段。现有环介导等温扩增(Loop-mediated isothermal amplification, LAMP)、PCR等核酸方法可以检测植物RNA和DNA病毒,与这些方法相比,RPA检测法无需高温变性,且仅需两个引物即可完成扩增,检测更方便。Jiao等[73]应用RT-RPA技术快速检测出辣椒脉斑驳病毒(Chilli veinal mottle virus, ChiVMV),此方法特异性高,不与马铃薯Y病毒、番茄斑点枯萎病毒和烟草脉带花叶病毒等相关病毒发生交叉反应,并且其灵敏度比常规RT-PCR方法高约10倍。Ivanov等[74]通过调整底物浓度、组分混合顺序和反应温度等,成功检测出马铃薯X病毒(Potato virus X, PVX),且灵敏度是传统侧流层析技术的260倍,也适用于多种RNA病毒的检测。Kumar等[75]从粗提取液中有效检测出柑橘黄化花叶病毒(Citrus yellow mosaic virus, CYMV),建立了检测该病毒的免疫捕获RPA方法,该方法可作为检疫和芽接过程中的有效病毒检测技术。Wang等[76]通过RPA和金纳米粒子(AuNP)探针相结合的可视化DNA诊断方法,在20 min内能够检测到番茄黄化曲叶病毒(Tomato yellow leaf curl virus, TYLCV),提供了高度敏感和稳定的DNA诊断技术。此外,RPA技术还用于检测玉米褪绿斑驳病毒(Maize chlorotic mottle virus)[77]、菜豆荚斑驳病毒(Bean pod mottle virus)[78]、樱桃病毒(Cherry virus A)[79]、香蕉束顶病毒(Banana bunchy top virus)[80]、苹果茎沟病毒(Apple stem pitting virus)[81]等。
3.3.2 植物病原细菌的检测 经验丰富的研究人员能够通过观察植物细菌病害的典型症状来诊断植物病害,并通过在专门的培养基中分离培养来鉴定病原物,该方法大多数时候是准确的,但是耗时较长。与之相比,RPA技术可以快速准确地检测出病原物,并且整体检测成本较低。Scherer等[82]利用RPA技术检测出导致番茄细菌斑点病的多种病原菌(Xanthomonasgardneri,X.euvesicatoria,X.perforans和X.vesicatoria)。基于柑橘黄龙病菌(Candidatusliberibacterasiaticus,CaLas)的16S rRNA基因,Ghosh等[83]优化了反应温度和时间,建立了一种灵敏可靠的黄龙病LFD-RPA技术。Lau等[84]以丁香假单胞菌(Pseudomonassyringae)感染的植物样品为研究对象,基于固相载体可逆化固定法,从植物样品中提取总基因组DNA,通过RPA快速等温扩增靶病原体DNA序列,随后与金纳米颗粒DNA标签杂交,再使用链霉亲和素包被的磁珠富集产物,最后用差分脉冲伏安法进行基于金纳米颗粒的电化学评估,能够灵敏地检测到植物病原菌DNA,比传统的PCR、电泳凝胶检测法灵敏10000倍。Ahmed等[85]直接利用被感染的植物材料,而无需进行DNA的分离,通过LFD-RPA技术检测出26种果胶杆菌(Pectobacteriumspecies)和12种非果胶杆菌,未出现假阳性或假阴性结果,表现出较高的特异性。
3.3.3 植物病原真菌的检测 RPA技术具有高度特异性,可以克服植物病原真菌检测中样品交叉污染造成的影响。Lau等[86]以被感染的番茄和拟南芥为研究对象,通过在纳米金颗粒表面涂覆拉曼报告子和DNA探针,制备了表面增强拉曼散射(Surface-enhanced raman scattering, SERS)纳米粒子,随后与RPA技术结合,进一步开发了反应快速、特异性强且灵敏度高的即时单管RPA/SERS测定法,用于灰葡萄孢(Botrytiscinerea)、尖孢镰刀菌(Fusariumoxysporum)等真菌的多重检测。Burkhardt等[87]应用RPA技术检测出菜豆壳球孢(Macrophominaphaseolina),在200多种染病草莓上进行了验证,为草莓和土壤中的菜豆壳球孢检测提供了新的方法。Austin等利用冻干试剂检测了橡树疫霉(Phytophthoraramorum)。Yu等[88]利用LFD-RPA技术快速检测辣椒疫霉(Phytophthoracapsici),可以在5 min内获得可扩增的DNA,该测定法有望作为诊断试剂盒得到进一步开发,用于现场或资源有限的实验室的病样检测。Dai等[89]使用一对引物PSYPT-F和PSYPT-R扩增大豆疫霉(Phytophthorasojae)Yptl基因的特定片段,通过对多种卵菌和真菌的测试,验证了该方法具有较高的特异性。Mustafa等[15]将RPA与PCR技术藕联,通过放大疫霉属中高度保守的atp9~nad9序列间的间隔子,成功检测出草莓疫霉(Phytophthorafragariae)。RPA技术不仅能够检测以上病菌,还能检测出油菜茎基溃疡菌(Leptosphaeriamaculans)[91]、草坪草根部感染的真菌(例如Gaeumannomycesavenae,Magnaporthiopsispoae和Ophiosphaerellakorrae)[92]、冬生疫霉(Phytophthorahibernalis)[93]、致病疫霉(Phytophthorainfestans)[94]等。
3.3.4 植物线虫的检测 利用经典形态学方法准确鉴定根结线虫的种类对检测人员技术水平要求较高,而同工酶表型分析和常规分子鉴定通常需要使用先进的仪器和软件,因而使得线虫的现场检测具有一定难度。目前RPA技术逐渐用于检测线虫,但相关报道较少。Chi等[95]通过LFD-RPA检测发现爪哇根结线虫(Meloidogynejavanica)的纯化基因组DNA的检测限为1 pg,其灵敏度约是常规PCR检测的10倍。Cha等[96]从松木中快速提取出松材线虫(Bursaphelenchusxylophilus)基因组DNA,然后利用带有光学传感器的电池固定式恒温装置,获取来自RPA反应的荧光吸收,在25 min内可完成检测。RPA技术有望为线虫提供一种高效快捷的检测方法。
4 RPA的技术特点
与传统PCR技术相比,作为一种新型的核酸扩增技术,RPA具有以下优点:
(1)反应可以在恒温条件下进行。与普通PCR不同,RPA技术利用了生物酶的活性,不需要经过一系列的高温变化过程,整个扩增过程可以在37~42 ℃的恒温条件下进行。
(2)耗时短。与其他多种扩增技术相比,RPA的显著特点就是可以在5~20 min内完成检测。
(3)操作简单。已经开发出的各类RPA试剂盒便于操作。例如,RPA TwistAmp®Basic 试剂盒的基础反应体系含有DNA扩增所需的各类试剂,只需要加入引物与模板即可进行检测[97]。RPA技术有多种检测方式,如在上述体系中加入探针就可以实现实时荧光定量RPA,在RPA TwistAmp®Basic RT中添加逆转录酶,也可以对RNA模板进行扩增。
(4)灵敏度高。在不需纯化和富集样品的条件下,RPA可以检测低至几个拷贝的核酸模板。
除了以上几种优点外,RPA技术也具有以下几种缺点:
(1)RPA产物在使用琼脂糖凝胶电泳进行检测时首先需要纯化,否则易造成拖带。
(2)RPA产物在使用侧流试纸条进行检测时,需先将产物稀释从而使层析效果更佳,也能避免非特异带影响。
(3)目前没有专门设计RPA引物和探针的软件。
(4)由于RPA反应的最适温度在37~42 ℃,若是同时进行大量样品的检测,没有办法准确控制每个扩增循环的起点[98]。
5 展望
RPA技术作为一种新型的检测技术,在公共卫生的现场检测、食品安全检测、植物病害诊断等方面显示出巨大的应用潜力。所有的等温扩增方法都存在着3个重要的步骤,即样品制备、扩增和检测,当然RPA技术也不例外。由于该技术问世才10多年,体系尚不够成熟,在上述3个环节中都存在诸多不足,有待进一步改进。首先,在样品制备方面可以关注在样品制备中能否做到浓缩以及进一步的样品纯化,使得实验简化、结果准确。其次,RPA技术的一个大难题就是引物的设计,目前没有专门的引物设计软件,大多数实验中用到的引物可能还是传统PCR中所使用的,可能会带来实验的误差[99]。最后,在RPA的检测技术方面,目前已经有传统的电泳凝胶法、实时荧光定量、侧流层析等多种方法可以使用,在未来是否可以将RPA技术与其他技术结合用于检测,或是开发其他材料使检测成本更低,这也有待进一步的开发。相信随着对RPA技术的深入研究,日趋成熟的RPA技术未来一定能够更好地发挥它的作用。
