lncRNA-H19通过靶向miR-106a-5p在骨关节炎软骨基质降解和钙化中的调控作用
2021-11-15刘旭剑王东来李增怀冯奇常富军冯建刚
刘旭剑,王东来,李增怀,冯奇,常富军,冯建刚
(1.河北医科大学第四医院骨科,河北 石家庄 050011;2.中国人民解放军联勤保障部队第980医院骨科,河北 石家庄 050000)
骨关节炎(osteoarthritis,OA)是一种慢性退行性关节疾病,其发病机制涉及机体的各种生理和病理过程[1],但其确切发病机制尚不清楚。研究[2-4]指出,长链非编码RNA(long non-coding RNA,lncRNA)和microRNA(miRNA)的表观遗传修饰对OA的发生及发展中发挥着重要作用,如软骨组织中的miR-16/SMAD7轴可通过下调lncRNA MEG3的表达水平加速OA的进展[4],且还可通过上调miR-146a和miR-98促进OA的进展[3]。此外,携带miR-140-5p的外泌体可促进OA大鼠软骨细胞的增殖和迁移,而不扰乱细胞外基质的分泌[5]。lncRNA-H19具有调节细胞增殖、分化和代谢等生物学功能,可能是刺激软骨恢复的潜在靶点,在胶质瘤细胞中可通过miR-138/HIF-1α轴上调lncRNA H19而促进细胞增殖、迁移[6];lncRNA H19可通过对TNFAIP8的正向调节,改变EMT的级联反应,促进乳腺癌细胞的增殖、迁移和侵袭[7];lncRNA-H19在OA软骨组织中的高水平表达可调控miR-675,进而影响软骨的合成和分解代谢[8]。OA患者的miR-106a-5p表达下降,而增加miR-106a-5p的表达可改善前交叉韧带横断(anterior cruciate ligament transaction,ACLT)所致OA模型的组织学体征[9]。本研究拟探讨lncRNA-H19靶向miR-106a-5p在调节OA软骨基质降解和钙化中调控作用,旨在为OA软骨细胞变性的诊断和治疗提供潜在的靶点。
1 资料与方法
1.1 试剂与耗材
TRIzol试剂盒购置美国Invitrogen公司,PrimeScript TM RT Master Mix和LipofecamineTM2000试剂盒购置Eurofins MWG Operon公司(德国),HC-A人软骨细胞系购置上海奥路生物技术有限公司,Dulbecco’s Modified Eagle’s Medium(DMEM)/F12培养基购于德国Biochrom AG Seromed公司,SYBR qPCR Mix和细胞计数试剂盒8(Cell Counting Kit-8,CCK-8)(购置日本TaKaRa公司),磷酸酶检测试剂盒购置中国建成生物工程公司,BCA试剂盒购置美国赛默飞世尔科技公司,聚偏氟乙烯(PVDF)膜购置美国Millipore公司。Bax抗体、Bcl-2抗体、MMP-1抗体、MMP-13抗体、II型胶原α1(COL2A1)抗体、GAPDH及相关二抗均购置美国Abcam公司。
1.2 一般资料
采集2014年3月至2020年3月在河北医科大学第四医院接受关节置换术的30例原发性膝关节骨关节炎患者的软骨组织样本作为病例组。纳入标准:(1)均符合原发性膝关节骨关节炎诊断标准[10];(2)均行膝关节镜手术治疗;(3)发病于膝关节;(4)体重指数18~24 kg/m2。排除标准:(1)合并类风湿性关节炎者;(2)严重高血压、高颅压、Ⅱ型呼吸衰竭者;(3)心功能不全、心动过缓或严重的心律失常者;(4)严重的电解质紊乱者;(5)合并糖尿病、恶性肿瘤者;(6)局部感染、凝血功能异常者。另选同期30例截肢患者的关节软骨组织样本作为健康对照组。本次研究均经医院伦理委员会批准,患者知情并同意。30例原发性膝关节骨关节炎患者中,男性17例,女性13例,平均年龄50.63岁(39~72岁)。30例截肢患者中,男性19例,女11例,平均年龄48.85岁(29~73岁)。两组年龄、性别等资料比较,差异无统计学意义(P>0.05)。
1.3 实时定量聚合酶链式反应(quantitative reverse transcription polymerase chain reaction,RT-qPCR)
采用TRIzol试剂盒从临床骨关节炎软骨组织、健康软骨组织和软骨细胞中提取完整的RNA,先预冷磷酸盐缓冲盐溶液(phosphate buffered saline,PBS)清洗2~3遍,加入1 mL Trizol裂解细胞15 min,待贴壁细胞完全脱落后,移至2 mL EP管,并使用紫外分光光度计测量RNA浓度。按照PrimeScript TM RT Master Mix试剂盒的说明书,在40 ℃反应6 min,65 ℃反应25 min,35个循环条件下合成互补DNA(complementary DNA,cDNA),得到cDNA产物,保存于-80 ℃,用于进一步的qPCR实验。RT-qPCR反应体系总量为20 μL,其中cDNA产物2 μL,50×ROX 0.4 μL,SYBR qPCR Mix 10 μL,上游引物0.8 μL,下游引物0.8 μL,RNase水添加至20 μL。U6作为miR-106a-5p的内参,β-actin作为mRNA表达的内参,每个实验设3个重复,每个样本重复3次。采用2-ΔΔCt法计算表达水平。所用引物及片段大小如下:lncRNA-H19 (650bp):F:5′-ATC GGT GCC TCA GCG TTC GG-3′,R:5′-CTG TCC TCG CCG TCA CAC CG-3′;ALP (454 bp):F:5′-CCC TTC ACT GCC ATC CTG TAC-3′,R:5′-CCA TGG AGA CGT TCT CTC TCT CA-3′;OCN (294 bp):F:5′-GGC AGG GAA GTC AGG GTA G-3′,R:5′-CCC GTG GTT TCC TGG TC-3′;BSP (450 bp):F:5′-ATG CCT GCC TTG TAC CAC GAG C-3′,R:5′-TCC ATC GAA GAA TCA AAG CAG AG-3′;miR-106a-5p (23bp):F:5′-AAA AGU GCU UAC AGU GCA GGU AG-3′,R:5′-AAC CAT GAC CTC AAG AAC-3′;U6 (75bp):F:5′-CGC AAG GAT GAC ACG CAA ATT CG-3′,R:5′-AAC GCT TCA CGA ATT TGC GT-3′;β-actin (325 bp):F:5′-ATC ACT GCC ACC CAG AAG AC-3′,F:5′-TTT CTA GAC GGC AGG TCA GG-3′。
1.4 细胞培养和转染
HC-A细胞在含10%胎牛血清的DMEM/F12培养基中于37 ℃、5% CO2的潮湿无菌培养箱中培养,每两天更换一次培养基。将细胞接种到6孔的培养皿中。24 h后,当细胞密度达到70%时,将细胞分为H19干扰组(si-H19,5’-TTC ATG TTG TGG GTT CTG GGA GCC-3’)、阴性转染组(si-Control,5’-TGA TGT CTA GCG CTT GGG CTT TG-3’)、miR-106a-5p mimic组(miR-106a-5p,5′-AAA AGU GCU UAC AGU GCA GGU AG-3′)、mimic阴性对照组(miR-106a-5p-NC,5′-CAG UAC UUU UGU GUA GUA CAA-3′)、miR-106a-5p抑制剂组(inhibitor,5′-CUA CCU GCA CUG UAA GCA CUU UU-3′)和阴性抑制剂对照组(inhibitor-NC,5′-CAG GAC AGC UUC GAG UUA ATT-3′)组,所有序列均有生工生物工程(上海)股份有限公司合成。将最终浓度100 nmol/L的LipofecamineTM2000 si-H19、si-Control、miR-106a-5p mimic、miR-106a-5p-NC、inhibitor、inhibitor-NC、inhibitor+si-H19、inhibitor-NC+si-H19转染细胞并孵化6 h,然后转入完全培养基培养24 h。
1.5 细胞增殖实验
转染si-H19或si-Control后,收集细胞,以每孔1 000个细胞的密度接种到96孔板中,分别培养0、24、48或72 h。每孔加入终浓度为10%的CCK-8试剂盒溶液,避光孵育1 h。最后,采用全自动酶标仪ALISEI(意大利SEAC公司生产)在450 nm波长下检测吸光度(optical density,OD)值,以表示细胞增殖情况。
1.6 细胞凋亡实验
si-H19和si-Control转染后,收集对数生长期的细胞并消化,然后用冷PBS洗涤两次,用1 mL联合缓冲液重悬使细胞密度为1×106/mL。将100 μL的细胞悬浮液加入5 mL的流管中,加入10 μL的Annexin-V-FITC和10 μL的碘化丙啶(propidium iodide,PI)染色。随后,在室温下避光孵育15 min。使用BD FACS流式细胞仪(BD Biosciences,San Jose,CA,USA)分析细胞凋亡率。所有测定均在3个独立实验中进行。
1.7 Western blot分析
提取转染细胞的总蛋白,用BCA试剂盒测定蛋白浓度。变性后,用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离总蛋白,并转移到PVDF膜上。在5%脱脂牛奶中封闭后,将膜与Bax、Bcl-2、MMP-1、MMP-13、COL2A1和GAPDH一抗在4 ℃下孵育过夜。然后用含Tween 20的Tris缓冲盐水(150 mM NaCl tris buffered saline Tween,TBST)洗涤膜,与二抗在室温下孵育2 h,用TBST洗涤。最后,用增强化学发光(ECL)检测试剂反应后,检测蛋白条带。使用Image J软件对条带的灰度值进行分析,首先,将所有条带扣除背景影响;然后用目标蛋白的灰度值除以其对应泳道的内参照条带灰度值,以此作为该组的目标蛋白相对表达量,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参。
1.8 基质金属蛋白酶活性检测
提取细胞裂解液,根据制造商的说明,实验严格按照pro-MMP-1和MMP-13 ELISA试剂盒说明书进行,采用酶联仪在450 nm波长出依序测量各孔的OD值,在加终止液后15 min以内进行检测。试剂盒的灵敏度分别为0.02 ng/mL和0.009 ng/mL。
1.9 碱性磷酸酶(alkaline phosphatase,ALP)测定
采用ALP检测试剂盒法检测ALP活性。每个转染组的细胞用PBS洗涤,用含20 mM Tris-HCl(pH 8.0)、150 mM NaCl、1% Triton X-100、0.02% NaN3和1 Triton抑肽酶的溶液裂解。用移液管取相同体积的裂解液,37 ℃孵育15 min,采用分光光度计测定ALP活性。
1.10 统计学分析
2 结果
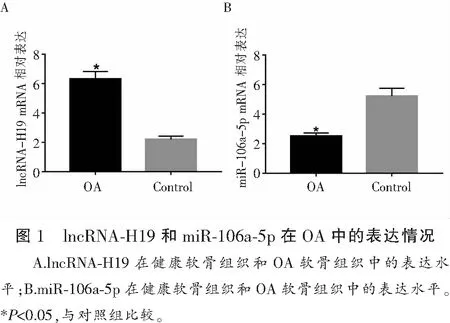
2.1 lncRNA-H19和miR-106a-5p在OA中的表达情况
与健康组织中lncRNA-H19 mRNA相比,OA软骨组织中lncRNA-H19 mRNA的表达明显升高,差异有统计学意义(t=43.225,P<0.05);而与健康组织中miR-106a-5p mRNA相比,OA软骨组织中miR-106a-5p mRNA的表达明显降低(t=74.447,P<0.05)。见图1。
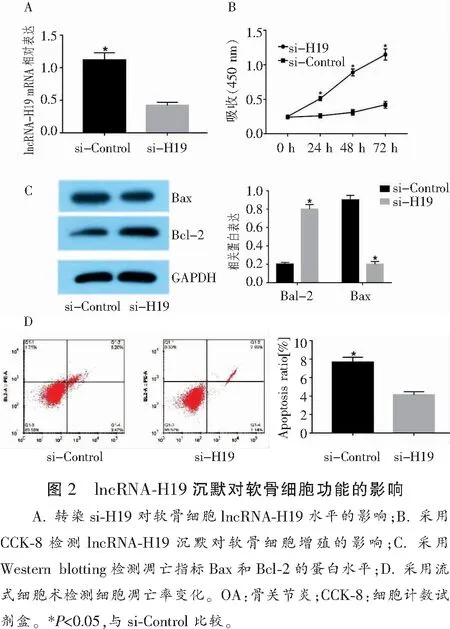
2.2 lncRNA-H19对细胞增殖、凋亡的影响
si-H19转染后,可显著抑制lncRNA-H19 mRNA的表达(P<0.05),并且可显著促进细胞增殖,且至少维持72 h(P<0.05)。流式细胞仪检测结果显示,转染si-H19沉默lncRNA-H19可以显著抑制细胞凋亡(P<0.05)。而si-H19在HC-A细胞中可导致Bax低表达,Bcl-2高表达,差异有统计学意义(P<0.05)。见图2。
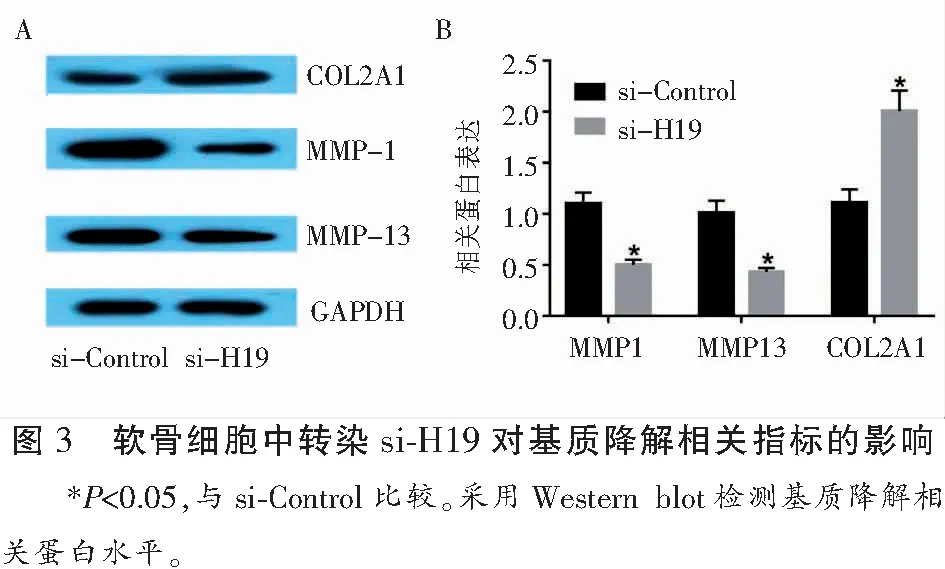
2.3 lncRNA-H19对细胞外基质相关基因的影响
si-H19转染HC-A细胞后,MMP-1和MMP-13的表达被抑制,COL2A1的表达增加,差异均有统计学意义(P<0.05)。见图3。
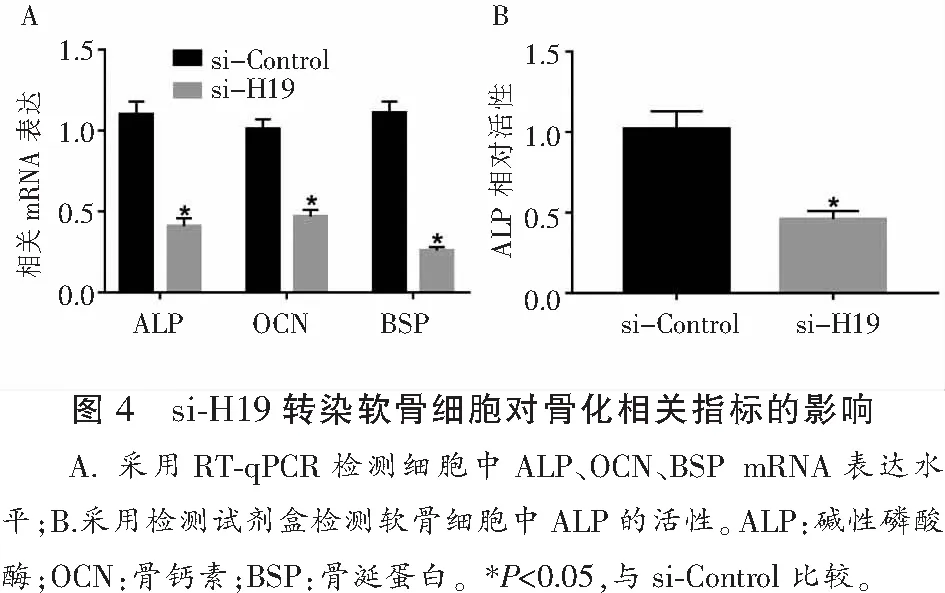
2.4 lncRNA-H19对软骨细胞骨化相关指标的影响
转染si-H19后,ALP、OCN和BSP mRNA水平显著下调(P<0.05)。转染si-H19也能抑制软骨细胞的ALP活性,差异有统计学意义(P<0.05)。见图4。
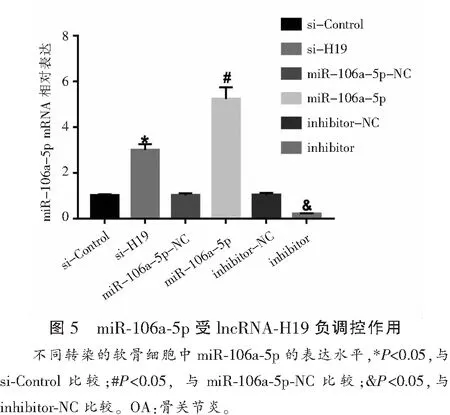
2.5 miR-106a-5p受lncRNA-H19负调控作用
转染si-H19可显著上调miR-106a-5p mRNA的表达水平(P<0.05)。转染miR-106a-5p mimic可上调miR-106a-5p mRNA的表达,转染miR-106a-5p inhibitor可抑制miR-106a-5p mRNA的表达。见图5。
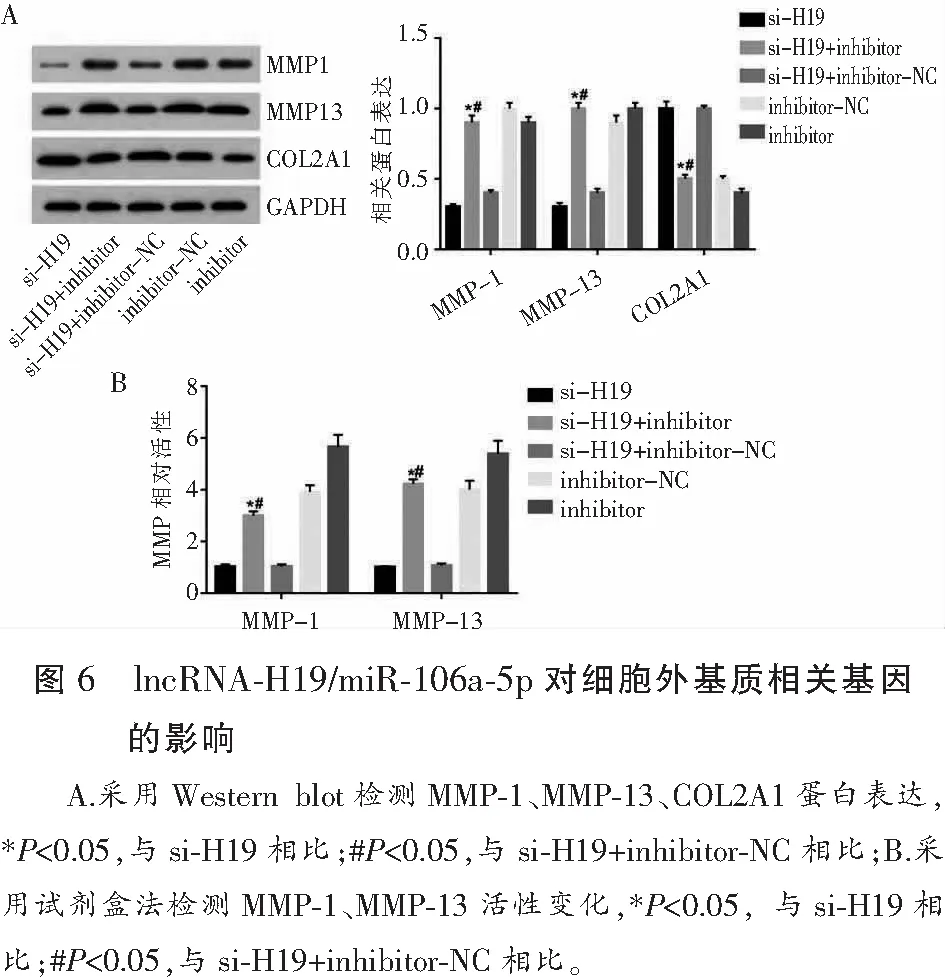
2.6 lncRNA-H19/miR-106a-5p对细胞外基质相关基因的影响
转染miR-106a-5p inhibitor和si-H19后,与si-H19组相比,miR-106a-5p inhibitor组MMP-1和MMP-13表达水平和活性均上调,COL2A1表达水平下调,差异均有统计学意义(P<0.05)。此外,与si-H19+inhibitor-NC组相比,si-H19+miR-106a-5p inhibitor组MMP-1和MMP-13表达水平和活性均上调,而COL2A1表达下调,差异均有统计学意义(P<0.05)。见图6。
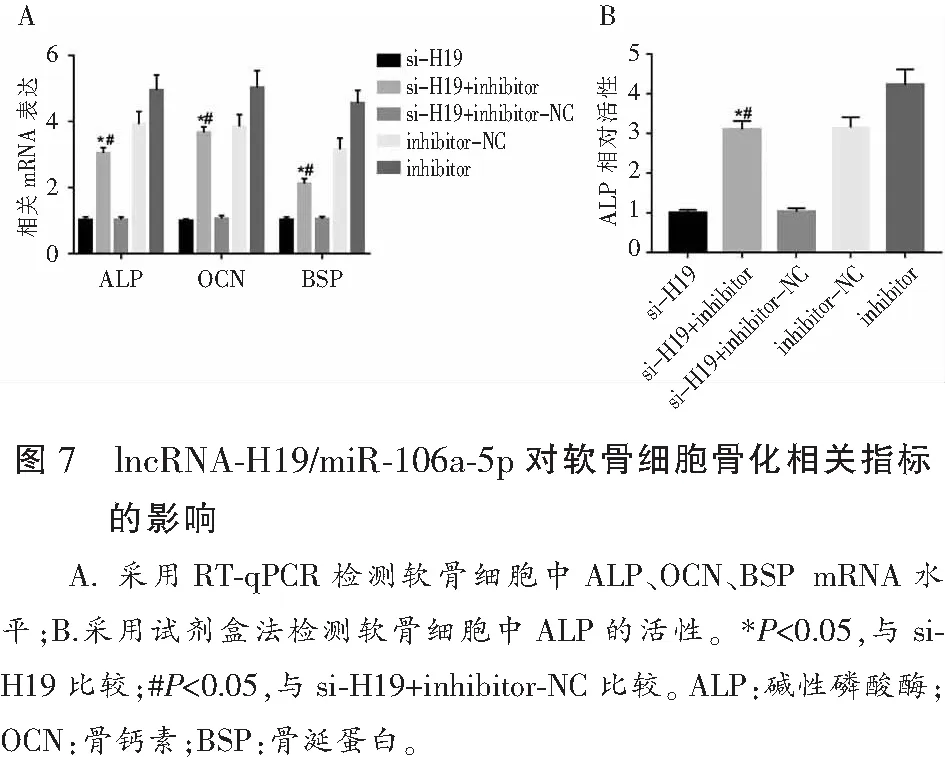
2.7 lncRNA-H19/miR-106a-5p对软骨细胞骨化相关指标的影响
转染miR-106a-5p inhibitor和si-H19后,与si-H19组相比,miR-106a-5p inhibitor+si-H19组ALP、OCN、BSP mRNA水平均上调(P<0.05),软骨细胞ALP活性明显增加(P<0.05)。与si-H19+inhibitor-NC组相比,miR-106a-5p inhibitor+si-H19组的ALP、OCN、BSP mRNA水平显著上调(P<0.05),软骨细胞ALP活性明显增加,差异均有统计学意义(P<0.05)。见图7。
3 讨论
OA以软骨结构和功能退化为主要特征,病变部位多为关节周围组织,最终可能导致关节疼痛和功能活动受限,是老年人常见的关节退行性疾病[11]。然而,关于OA的治疗效果和预后并不理想。常用的非甾体抗炎和镇痛药只能通过减轻疼痛和炎症来提高患者生活质量,关节内注射激素或透明质酸也只适用于缓解OA炎症症状[12-13]。因此,对OA发病机制的深入研究可以为该病的治疗提供详细的理论依据。本研究结果表明,OA软骨组织中lncRNA-H19表达上调,而沉默lncRNA-H19可明显抑制软骨细胞凋亡,促进软骨细胞增殖,并下调MMP-1和MMP-13的表达水平,上调COL2A1的表达。沉默lncRNA-H19可抑制软骨细胞ALP、OCN、BSP mRNA水平和ALP活性。另外,OA软骨组织中miR-106a-5p表达下调,沉默miR-106a-5p显著逆转了沉默H19对软骨细胞基质降解和钙化标志物的抑制作用。提示lncRNA-H19高表达可能通过调节软骨细胞增殖、凋亡、基质降解和钙化过程参与OA的发展,同时与miR-106a-5p低表达密切相关。此外,miR-106a-5p的负调控被证明是lncRNA-H19调控OA软骨基质降解和钙化的重要机制之一。
MMP蛋白酶家族在骨性关节炎的病理过程中起着重要作用,广泛分布于人体,其主要功能是控制细胞外基质成分的降解,是生理重建和病理损伤过程的主要因素之一[14-15]。在OA中,MMP在软骨细胞、滑膜细胞和破骨细胞中表达,密切参与软骨基质大分子的水解,包括II型胶原和多糖,最终破坏关节软骨细胞外基质的结构和功能的完整性。MMPs是OA关节软骨破坏的重要因素,骨关节炎患者滑膜液和软骨中MMPs的浓度升高,与骨关节炎的严重程度呈正相关[16]。MMP-1是软骨基质降解的限速酶之一,也是最典型的II型胶原,可降解胶原纤维三螺旋区的胶原,并诱导其他MMP家族成员的激活。MMP-13,在结缔组织中表达,而在健康软骨组织中很少表达或不表达,只有在软骨成骨的过程中,MMP-13的分泌才能降解软骨基质,达到成骨的目的。此外,MMP-13是一种强效蛋白酶,对细胞外基质中的胶原和非胶原物质具有特殊的降解作用,尤其是对II型胶原[17]。因此,MMP-13是裂解U型胶原最有效的蛋白酶。近期研究[18]证实,MMP-13不仅在受损软骨中过表达,而且在滑膜组织、钙化软骨中表达上调。本研究发现,沉默lncRNA-H19可明显下调MMP-1和MMP-13的表达水平,而过表达miR-106a-5p同样可下调软骨细胞中MMP-1和MMP-13的表达,提示lncRNA-H19和miR-106a-5p可能通过调节细胞外基质参与OA的发生发展。
此外,本研究还发现lncRNA-H19沉默显著抑制了软骨细胞中OCN、BSP的表达水平,并抑制了ALP活性,与Zhou等[19]研究相符。本文进一步研究发现,抑制miR-106a-5p可以部分逆转lncRNA-H19沉默导致的ALP活性、OCN、BSP表达水平的下调,提示抑制miR-106a-5p的表达可促进细胞成骨分化与先前的研究[9,20]基本一致综上所述,lncRNA-H19在OA软骨组织中表达上调,lncRNA-H19可能通过抑制miR-106a-5p的表达,促进细胞外软骨基质的降解和钙化,从而参与OA的发生发展。
