基于微阵列和生物信息学分析的茯苓多糖对Lewis肺癌小鼠差异表达miRNA的影响
2021-11-15张旭裕钟诚蒲有为杨中伟鲍依稀
张旭裕,钟诚,蒲有为,杨中伟,鲍依稀
重庆医科大学附属第二医院,重庆 400010
肺癌是世界范围内发病率最高的癌症之一[1]。肺癌在男性中发病率居世界首位,仅次于女性乳腺癌的发病率[2]。目前除手术外,放疗、化疗和靶向治疗也是肺癌患者的常见治疗方法[3]。然而,这些疗法常伴有严重不良反应,严重影响患者的生活质量。研究发现,中药多糖具有抗肿瘤、抗氧化和免疫调节的作用[4-8]。其中,茯苓多糖(Poria polysaccharide)具有多种生物活性,包括免疫调节及抗肿瘤作用[9-11],但其机制尚未阐明。
microRNAs(miRNAs)是一类小的单链、进化保守的非蛋白质编码RNA,在调控基因表达、细胞周期、生物发育时序等方面起重要作用[12]。miRNA微阵列技术具有灵敏度高、特异性强、线性范围宽等优点,使用通用的实时定量反应条件进行高通量miRNA表达谱分析,检测miRNA表达谱改变对于破译差异表达基因的生物学背景极其重要。本研究通过miRNA微阵列技术,寻找茯苓多糖干预后小鼠脾脏免疫相关miRNA差异并预测靶点基因,探索关键基因的生物学功能和信号通路,为茯苓多糖的免疫治疗提供依据。
1 实验材料
1.1 动物
C57BL/6雌性小鼠10只,4~6周龄,体质量18~22 g,购自重庆医科大学实验动物中心,动物许可证号SYXK(渝)2018-0003。饲养于重庆医科大学实验动物中心SPF级动物房,温度(23±1)℃,相对湿度40%~70%,12 h光照,自由摄食饮水。
1.2 药物
茯苓,购自重庆万鑫药房连锁有限公司,批号20191008,由重庆医科大学中药学院王刚教授鉴定为多孔菌科真菌茯苓Poria cocos(Schw.)Wolf的干燥菌核。
1.3 主要试剂与仪器
TriPure分离试剂(货号11667157001)、DNA酶(货号M0303S)、All-in-OneTMmiRNA第一链cDNA合成试剂盒(货号QP013)、All-in-OneTMqPCR混合液(货号QP001)、All-in-OneTMqPCR引物,美国GeneCopoeia公司。Light cycler480ⅡRT-PCR System(瑞士Roche公司),UV-NanoDrop®8000分光光度计(美国Thermo公司),TP650普通PCR仪(日本Takara公司),5810R高速冷冻离心机(德国Eppendorf公司),SHZ-Ⅲ旋转蒸发仪(中国Chongye公司),FD-1A-50真空冷冻干燥机(中国Bilon公司)。
2 实验方法
2.1 茯苓多糖制备
精确称取200 g茯苓于烧杯中,加入2 000 mL蒸馏水,80 ℃水浴提取2 h,过滤,重复2次,合并提取液,离心去沉淀,减压浓缩。冷却后加4倍体积无水乙醇,置于4 ℃冰箱中沉淀24 h。离心取沉淀,用少量蒸馏水溶解,加入1/5体积的sevag试剂(氯仿∶正丁醇=4∶1),电动搅拌器快速搅拌10 min,4 000 r/min离心3 min,取上清液,不断重复除蛋白数次,直到除尽。取上清液在纯水中透析36~48 h,浓缩,冷冻干燥,即得茯苓多糖。
2.2 造模、分组及给药
Lewis肺癌细胞(LLC)由陆军军医大学第二附属医院方军教授提供。细胞用含10%胎牛血清、1%青链霉素的DMEM培养基置于37 ℃、5%CO2培养箱中培养。将LLC消化处理,配制成4.0×106个/mL细胞悬液,每只小鼠右腋皮下注射100 μL细胞悬液。将10只小鼠随机分为生理盐水组和茯苓多糖组,每组5只。待肿瘤体积增长至1 cm3后,生理盐水组予生理盐水灌胃,茯苓多糖组予茯苓多糖(200 mg/kg)药液灌胃。每日1次,连续灌胃4 d停1 d为1个周期,连续4个周期。观察小鼠精神状态,每2 d监测小鼠体质量及肿瘤体积。20 d后,脱颈处死小鼠,收集肿瘤、脾脏和胸腺组织称重,计算肿瘤抑制率[(1-茯苓多糖组平均肿瘤质量÷生理盐水组平均肿瘤质量)×100%]、脾脏指数[脾质量(g)÷体质量(g)×100%]、胸腺指数[胸腺质量(g)÷体质量(g)×100%]。
2.3 miRNA微阵列分析及靶标预测
取80~100 mg脾脏组织,加入液氮研磨至粉末状,转移至装有1 mL TriPure的1.5 mL离心管,振荡混匀后室温静置5 min。加入0.2 mL氯仿,振荡混匀15 s,室温静置3 min,4 ℃、12 000 r/min离心15 min。弃上清,空气干燥RNA沉淀约5 min,加入适量DEPC溶解RNA沉淀。分光光度计测定RNA浓度和纯度。配制1%TAE琼脂糖凝胶进行RNA电泳,检测RNA完整性。使用DNaseⅠ除去RNA样品中污染的基因组DNA,进行miRNA反转录。配制miRNA反转录反应液,短暂离心后37 ℃孵育1 h,85 ℃灭活处理5 min,用灭菌水稀释5倍,-20 ℃冰箱保存备用。PCR检测采用标准三步法,以20 μL反应体积进行qPCR引物阵列分析,每个阵列都是一组针对89个与肺癌免疫进展密切相关的经优化验证的qPCR引物。此外,MsnoRNA U6、MsnoRNA U68、MsnoRNA U70、MsnoRNA U49A、MsnoRNA U72和阴性对照均用作标准化表达结果的参考因子。
使用ΔΔCt方法对不同样品的基因进行相对定量。ΔΔCt=AveΔCt(测试)-AveΔCt(对照)。2-ΔΔCt值是不同样品之间目标基因表达水平的差异倍数。通过GeneCopoeia在线数据分析系统(http://www.gene copoeia.com.cn/product/qpcr/analyse/)分析miRNA表达水平。使用生物信息学在线软件(http://www.bio informatics.com.cn/)进行聚类分析。筛选|Fold change|>1.5的miRNA。使用TargetScan 7.1(http://www.targetscan.org/)、miRDB(http://mirdb.org/)、miRWalk(http://mirwalk.umm.uniheidelberg.de/)数据库预测各差异miRNA的靶点基因,并取交集汇总。
2.4 GO和KEGG富集分析
通过DAVID数据库(https://david.ncifcrf.gov/)对下游靶点基因进行GO功能及KEGG通路富集分析。P<0.05表示差异有统计学意义。
2.5 蛋白相互作用网络构建及关键基因分析
通过STRING数据库(http://string-db.org/)构建PPI网络,并使用Cytoscape 3.8.0软件进一步分析。使用CytoHubba模块通过不同排秩方法筛选Hub基因。
3 统计学方法
使用SPSS26.0统计软件进行分析。实验结果以±s表示,多组比较用方差分析,两两比较用t检验。P<0.05表示差异有统计学意义。
4 结果
4.1 茯苓多糖对小鼠肿瘤和免疫器官指数的影响
与生理盐水组比较,茯苓多糖组小鼠脾脏指数、胸腺指数明显升高(P<0.05),肿瘤质量明显减轻(P<0.05),见表1,肿瘤抑制率为16.75%。肿瘤体积随时间变化趋势见图1。
表1 2组小鼠肿瘤质量和免疫器官指数比较(±s)
注:与生理盐水组比较,*P<0.05,**P<0.01
组别 只数 肿瘤质量/g 脾脏指数/% 胸腺指数/%生理盐水组 5 8.318 4±0.63 0.90±0.05 0.054±0.001茯苓多糖组 5 6.887 2±0.55* 1.11±0.09** 0.113±0.013**
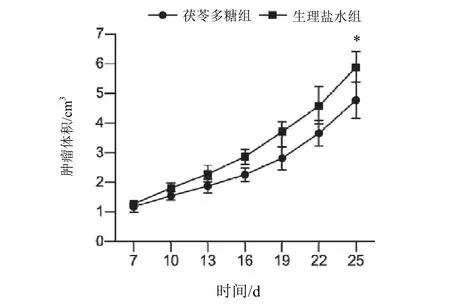
图1 2组小鼠肿瘤体积随时间变化趋势(±s,每组5只)
4.2 差异miRNA筛选及靶标预测结果
根据miRNA表达结果确定茯苓多糖组和生理盐水组miRNA差异表达水平,见图2。筛选|Fold change|>1.5的miRNA。与生理盐水组比较,茯苓多糖组有8个差异miRNA:mmu-miR-29b-3p、mmu-miR-139-5p、mmu-miR-21-5p、mmu-miR-18a-5p、mmu-miR-126-3p、mmu-miR-29a-3p、mmu-miR-451和mmu-miR-143-3p。此外,使用层次聚类法分析差异表达的miRNA,见图3。使用TargetScan、miRDB和miRWalk在线数据库预测8个差异miRNA的靶点mRNA。最终选择3个数据库的交集mRNA,见图4。
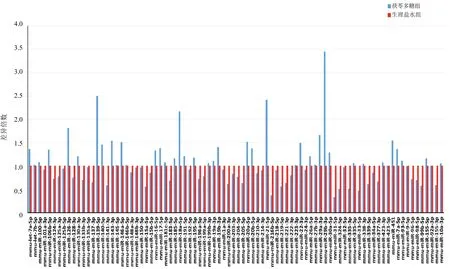
图2 2组小鼠miRNA倍数变化柱状图

图3 2组小鼠miRNA表达层次聚类分析

图4 TargetScan、miRDB和miRWalk数据库靶标基因韦恩图
4.3 GO和KEGG富集分析结果
GO分析发现,靶点基因参与多种生物过程(BP),如细胞生物过程、代谢过程、发育过程、生物调节和转录调控过程;一些基因与细胞成分(CC)的结构有关,如细胞质、细胞核、细胞骨架、细胞连接、蛋白质复合物和核质部分;涉及的分子功能(MF)有结合、催化活性、核酸结合和蛋白质结合功能。结果表明,茯苓多糖干预后可能引起细胞成分、生物过程和分子功能的改变。见图5。

图5 茯苓多糖调节Lewis肺癌小鼠脾脏免疫靶点基因GO分析
KEGG通路富集可用于评估有差异表达的信号转导和代谢途径。茯苓多糖组受影响的前33条主要通路(P<0.01)见图6。富集度较高的途径包括癌症通路、癌症蛋白聚糖、PI3K-Akt、MAPK和Ras信号传导途径,这些途径可能与茯苓多糖治疗Lewis肺癌小鼠的免疫调节有关。

图6 茯苓多糖调节Lewis肺癌小鼠脾脏免疫靶点基因KEGG通路富集分析(P<0.01)
4.4 蛋白相互作用网络构建及关键基因分析结果
关键基因是在生物过程中起重要作用的基因。在相关途径中,其他基因的调控通常受Hub基因影响。因此,Hub基因是重要的研究靶点。通过STRING数据库分析504个交集靶点基因,并使用Cytoscape 3.8.0绘制PPI网络,见图7。CytoHubba使用中介中心性(betweenness)排秩方法对前30个Hub基因进行分析,见图8。通过使用不同排秩方法分析前10个Hub基因,并取交集获得3个关键基因(Mapk8、Kras、Stat3),结果见表2。

表2 不同排秩方法的前10位Hub基因
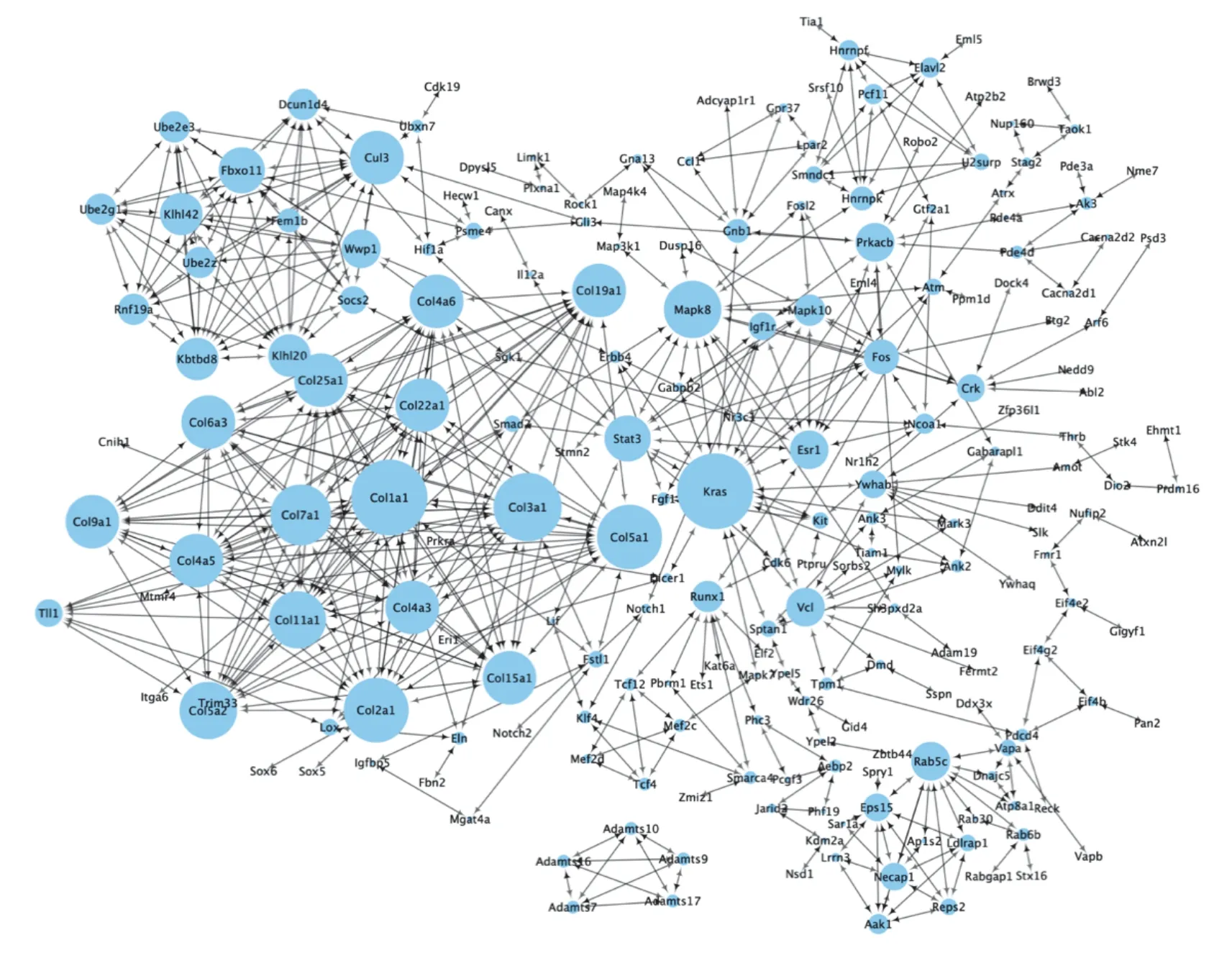
图7 茯苓多糖调节Lewis肺癌小鼠脾脏免疫靶点基因PPI网络

图8 前30个Hub基因PPI网络
5 讨论
茯苓含多糖、脂肪酸、三萜类化合物、酶及固醇等生物活性成分,其中茯苓多糖具有免疫调节和抗肿瘤作用。为进一步分析茯苓多糖的免疫调节潜力,本研究通过miRNA微阵列和生物信息学技术筛选并分析差异表达miRNA,并进一步分析其作用和参与的不同信号传导途径。与生理盐水组比较,茯苓多糖组小鼠筛选出8种异常表达miRNA。前期研究表明,miR-29b-3p通过抑制COL1A1基因表达,上调PTEN和Bax蛋白表达,逆转A549/DDP细胞顺铂耐药性[13]。miR-139-5p在多种肿瘤组织中表达下调,并可作为潜在的肿瘤抑制因子发挥作用,已发现其表达与非小细胞肺癌(NSCLC)患者的肿瘤体积、临床分期、病理类型和淋巴结转移有关[14]。Huang等[15]研究显示,miR-139-5p过表达可明显抑制NSCLC细胞增殖。miR-126-3p在生长调节中起重要作用,且其水平在NSCLC组织和细胞中均显著下调[16]。相反,miR-451a可通过调节激活转录因子2活性抑制NSCLC细胞的迁移和侵袭能力[17]。本实验结果表明,茯苓多糖在改变小鼠miRNA表达方面发挥显著作用。
PI3K/Akt通路在多种生物活性物质信号转导中起重要作用。有研究表明,肿瘤相关巨噬细胞可通过PI3K/Akt信号通路对肺癌A549细胞产生作用[18]。miR-145通过调节EGFR/PI3K/Akt信号通路抑制NSCLC细胞迁移并诱导细胞凋亡[19]。Zhang等[20]研究表明,叶黄素通过抑制PI3K/Akt信号通路抑制细胞生长并激活细胞凋亡。miR-16可针对性地抑制MAPK激酶1调节信号转导途径,从而调节肺癌细胞增殖和侵袭[21]。
Stat3和Kras对NF-κB转录因子活性具有正向调控作用[22-23],并参与细胞因子介导的信号通路[24]。此外,Kras参与Ras蛋白信号转导,并对MAPK活性有正调控。Stat3的其他生物过程包括对白细胞介素-6产生的正向调控,其受体通过JAK/STAT和Th17型免疫应答信号通路发挥作用。此外,Mapk8能应激激活MAPK级联反应,其生物过程涉及凋亡信号通路的正调控。
本研究利用差异基因预测出PI3K-Akt、MAPK和Ras 3个信号通路,成功构建了差异基因的PPI网络,并筛选出网络中可能参与免疫调节过程的3个关键基因(Stat3、Kras和Mapk8),表明其在茯苓多糖干预肺癌荷瘤小鼠中的关键作用。对该网络的进一步研究将有利于理解茯苓多糖的免疫调节作用机制。
