分子标记辅助选育兼抗赤霉病、白粉病和黄花叶病毒病的小麦新品系
2021-11-14蒋正宁赵仁慧陈甜甜王玲吕国锋臧淑江别同德
蒋正宁 赵仁慧 陈甜甜 王玲 吕国锋 臧淑江 别同德


摘要: 小麦赤霉病、白粉病和黄花叶病毒病是长江中下游麦区的主要病害,因此培育多抗品种是小麦绿色生产的基础。扬麦18是多抗高产小麦品种,具有抗赤霉病基因 Fhb1 、抗白粉病基因 Pm21 和抗黄花叶病毒病数量性状位点(QTL) QYm.njau-5A ,其不足是株高较高、抗倒性差。扬麦22是抗白粉病的高产品种,携带抗白粉病基因 PmV ,但中感赤霉病,高感黄花叶病毒病。为了培育矮秆抗倒、兼抗3种病害的小麦新品系,以扬麦18/扬麦22重组自交系群体(RIL)为材料,研究 Fhb1 、 QYm.njau-5A 在群体中的分布及其对株高、粒质量的遗传效应,并对多基因聚合效率进行评估。结果表明,在RIL群体中, Fhb1 、 QYm.njau-5A 的分布频率分别为49.0%、50.5%,符合Hardy-Weinberg定律,说明二者可在亲子代自由传递; Fhb1 阳性RIL组群的平均病小穗数显著低于 Fhb1 阴性RIL组群, Pm21 、 PmV 阳性RIL家系均表现为高抗白粉病;单个 QYm.njau-5A 能够满足抗小麦黄花叶病毒病的育种需求; Fhb1 对株高、粒质量没有显著影响; QYm.njau-5A 對株高有显著的增效作用,对粒质量没有显著影响;育成兼抗3种病害的矮秆高产新品系(组合)扬17J103、扬杂麦1号进入区域试验。研究结果为利用分子标记辅助选择技术培育矮秆多抗小麦新品种提供了优异的育种材料和理论依据。
关键词: 小麦; 抗病基因; 聚合育种; 赤霉病; 白粉病; 黄花叶病毒病
中图分类号: S512.1;Q343.2 + 45 文献标识码: A 文章编号: 1000-4440(2021)05-1100-08
Molecular marker-assisted breeding of new wheat lines with resistances to Fusarium head blight, powdery mildew and wheat yellow mosaic virus
JIANG Zheng-ning, ZHAO Ren-hui, CHEN Tian-tian, WANG Ling, LYU Guo-feng, ZANG Shu-jiang,BIE Tong-de
(Key Laboratory of Wheat Biology and Genetic Improvement in Low & Middle Yangtze River Valley Winter Wheat Region/Institute of Agricultural Sciences of the Lixiahe District in Jiangsu Province, Yangzhou 225007, China)
Abstract: Fusarium head blight, powdery mildew and wheat yellow mosaic virus are three major wheat diseases in the middle and lower reaches of Yangtze River. Breeding of multiple-resistant wheat varieties is the basis of green production. Yangmai 18 is a high-yield variety carrying Fhb1 , Pm21 and QYm.njau-5A , leading to the resistances to Fusarium head blight, powdery mildew and yellow mosaic virus, respectively, but it has poor lodging resistance. Yangmai 22 carrying PmV is also a high-yield and powdery mildew resistant variety, but moderately susceptible to Fusarium head blight and highly susceptible to yellow mosaic virus. To breed new wheat lines with resistance to lodging and three diseases, the distribution of Fhb1 and QYm.njau-5A in Yangmai 18/Yangmai 22 recombinant inbred line (RIL) population and their genetic effects on plant height and grain weight were studied, and the efficiency of polygene polymerization was evaluated. The results showed that distribution frequencies of Fhb1 and QYm.njau-5A in RIL population were 49.0% and 50.5%, respectively, which accorded with Hardy-Weinberg law, indicating that both the genes could be freely transmitted from parent to offspring. The average number of diseased spikelets in Fhb1 positive RIL group was significantly lower than that in Fhb1 negative RIL group. All the RIL families carrying Pm21 or PmV showed high resistance to powdery mildew. A single QYm.njau-5A could meet the breeding needs of wheat lines with resistance to yellow mosaic virus. Fhb1 had no significant effect on plant height and kernel weight. Qym.njau-5A had significant synergistic effect on plant height, but had no significant effect on kernel weight. The dwarf and high-yield lines Yang 17J103 and Yangzamai 1 with resistance to three diseases were bred. These results provide excellent breeding materials and theoretical basis for breeding dwarf and multi-resistance wheat varieties by molecular marker-assisted selection.
Key words: wheat; disease resistance gene; pyramiding breeding; Fusarium head blight; powdery mildew; wheat yellow mosaic virus
小麦赤霉病( Fusarium head blight, FHB)、白粉病(Powdery mildew,PM)和黄花叶病毒病(Wheat yellow mosaic bymovirus, WYMV)是长江中下游麦区的主要病害。近来年,受气候变暖、雨水增多、播期推迟、群体变大等因素的影响,小麦赤霉病、白粉病重发年份增加,而过多的化学药剂防治易带来农药残留、环境污染等问题,同时,由病毒引起的小麦黄花叶病也缺少有效的化学防治手段。因此,选育多抗小麦品种是解决小麦赤霉病、白粉病和黄花叶病毒病危害的最经济、有效的途径。
来自苏麦3号3BS染色体上的 Fhb1 是目前国际上公认的效应最大的抗赤霉病主效基因,也存在于望水白、黄方柱等地方品种中。2019年,马正强团队 [1] 和柏贵华团队 [2] 分别独立克隆了 Fhb1 ,其在功能上编码富集组氨酸的钙结合蛋白(Histidine-rich calcium-binding-protein), Fhb1 基因的成功克隆在分子标记辅助抗赤霉病育种中发挥了重要作用 [3] 。苏麦3号、望水白等抗赤霉病品种的农艺性状较差,难以直接作为亲本应用于育种中。近年来,宁麦9号成为长江中下游 Fhb1 基因的主要供体,该品种农艺丰产性高,兼具黄花叶病毒病抗性,其5A染色体上有1个抗黄花叶病毒病的主效数量性状位点(QTL) QYm.njau-5A [4] 。目前,宁麦9号已衍生出宁麦13、宁麦14、扬辐麦4号、扬麦18、扬麦28、扬麦30等约30个品种,是继扬麦158之后长江中下游麦区的又一骨干亲本,其缺点是高感白粉病,抗倒性较差。
江苏里下河地区农业科学研究所以携抗白粉病基因 Pm21 的小麥-簇毛麦T6V#2S·6AL易位系 [5] 南农P045为供体亲本、宁麦9号为最晚轮回亲本育成了抗白粉病品种扬麦18,同时聚合抗赤霉病基因 Fhb1 、抗白粉病基因 Pm21 、抗黄花叶病毒病QTL QYm.njau-5A ,有效解决了宁麦9号高感白粉病的缺陷,但仍存在株高偏高、抗倒性差的缺点,因此在利用上仍有一定难度,有必要进行升级改造 [6] 。由中国农业科学院育成的抗白粉病小麦-簇毛麦T6V#4S·6DL易位系Pm97033 [7] 的6V#4S染色体上的 PmV 基因已被证明与 Pm21 同源 [8] 。江苏里下河地区农业科学研究所以Pm97033为基因供体、矮秆品种扬麦9号为轮回亲本,育成了高产品种扬麦22,该品种高抗白粉病,但高感黄花叶病毒病,中感赤霉病,综合抗病性仍需加强;此外,该品种的株高虽较扬麦18略矮,但抗倒性仍有提升空间。由此可见,在抗病聚合育种中,选育矮秆抗倒品种是重要前提。
在前期的研究中,本课题组利用扬麦18/扬麦22重组自交系群体(Recombinant inbred lines, RIL)研究了2种易位的亲子代传递性及其对基础农艺性状的影响,并得到如下重要结论:T6V#2S·6AL(携 Pm21 )对株高、粒质量、穗长等有明显增效作用,对穗数有负向效应,对抗倒性有一定影响;T6V#4S·6DL(携 PmV )除对株高有弱于前者的增效作用以外,对其他农艺性状的影响不显著;T6V#4S·6DL的亲子传递性远低于T6V#2S·6AL,是 PmV 育种利用的主要瓶颈 [9] 。本研究拟以该RIL群体为材料,继续研究抗赤霉病基因 Fhb1 、抗黄花叶病毒病主效QTL QYm.njau-5A 在群体中的分布、抗病遗传效应及其对株高、粒质量的影响,并尝试从中筛选矮秆、高粒质量,并兼具3种抗病性的高产小麦新品系,以期为多抗聚合育种提供有益参考。
1 材料与方法
1.1 供试材料
以扬麦18、扬麦22为双亲构建的RIL群体 (F 2∶9 ~ F 2∶11 代)作为试验材料,在不同年份,群体的样本数为 366~ 421个不等。母本扬麦18(组合:宁9 4 /3/扬麦158 6 //88-128/南农P045)由江苏里下河地区农业科学研究所育成 [10] ,中抗赤霉病(含 Fhb1 ),高抗白粉病(含 Pm21 )和黄花叶病毒病(含 QYm.njau-5A ),具有大穗、大粒、结实性好的优点,缺点是植株偏高、易倒伏。父本扬麦22(组合:扬麦9号 3 /Pm97033)由江苏里下河地区农业科学研究所育成 [11] ,中感赤霉病,高抗白粉病(含 PmV ),高感黄花叶病毒病,株高较扬麦18略矮,缺点是粒质量偏低。
1.2 分子标记的鉴定
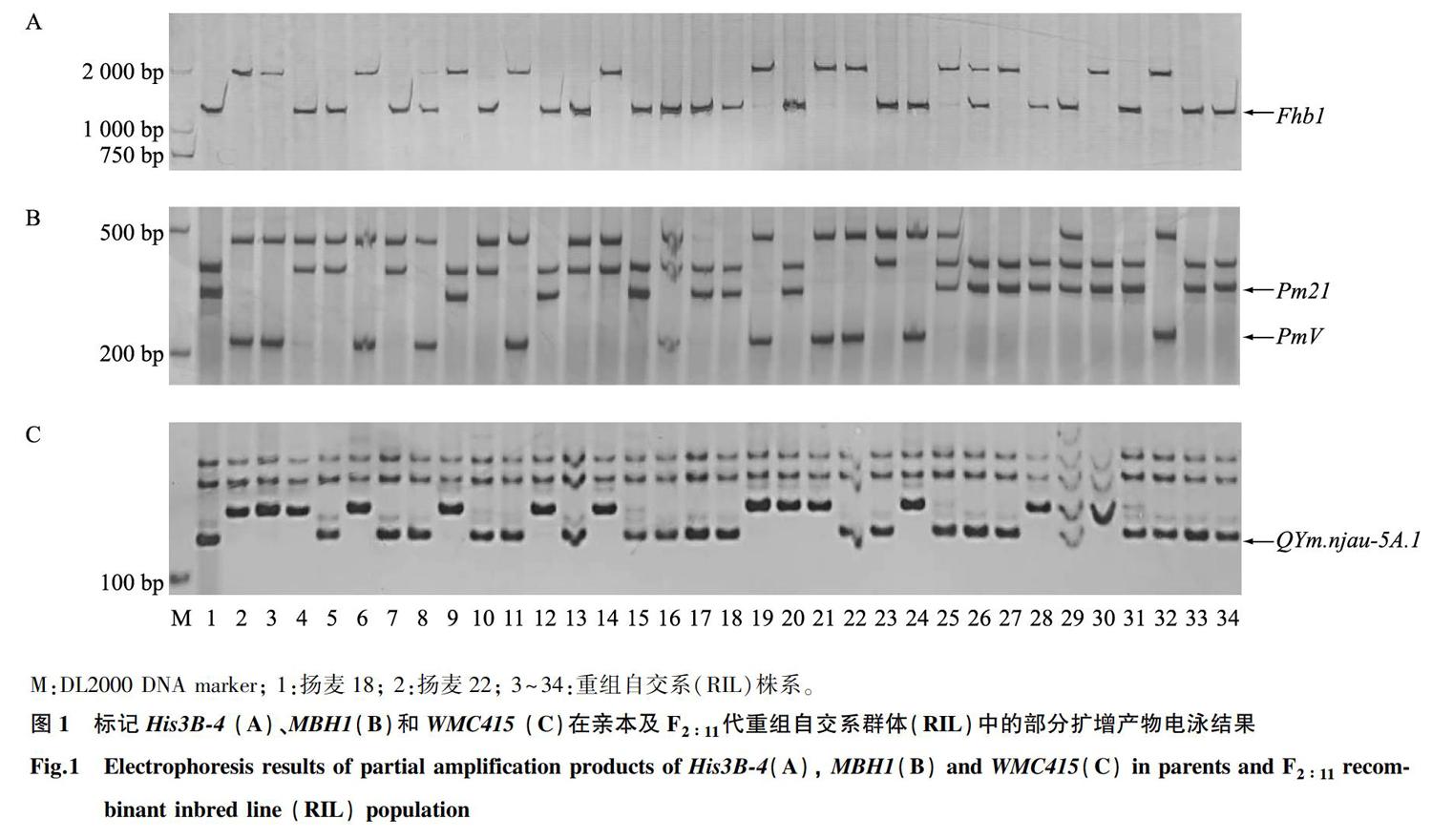
赤霉病抗性基因 Fhb1 诊断标记采用由His-InDel序列开发的PCR分子标记 His3B-4 [3] ,抗白粉病基因 Pm21 、 PmV 的检测均采用Bie等 [8] 开发的共显性功能分子标记 MBH1 ,抗黄花叶病毒病主效QTL QYm.njau-5A 采用紧密连锁的共显性简单重复序列(SSR)分子标记 WMC415 [4] 进行鉴定。表1为标记引物对序列,由上海捷瑞生物工程有限公司合成。
基因组DNA提取采用十六烷基三甲基溴化铵(CTAB)法 [12] ,PCR反应体系为10.0 μl,包括10 ng模板DNA、各0.2 μl上下游引物(10 μmol/L)、0.8 μl dNTPs、0.8 μl MgCl 2 (2.5 mmol/L )、1 U Taq 聚合酶(5 U/μl,TaKaRa公司产品),1.0 μl 10×聚合酶专用Buffer,用ddH 2 O补足至相应体积。PCR扩增程序:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min。采用8%聚丙烯酰胺凝胶分离,通过银染显色检测PCR产物。
1.3 田间设计
于2017年、2018年和2019年将参试材料种植于江苏里下河地区农业科学研究所湾头试验基地,2019年同时在扬州沙头种植各参试材料。每个RIL家系种1行,行长1.30 m,每行播40粒,行距0.25 m,每个试点设2次重复。为了减少病害发生对基因农艺效应分析的影响,选用无黄花叶病毒病的田块进行试验,同时对赤霉病、白粉病进行常规药剂防治。水肥、虫害和草害的防治均采用常规管理。成熟前考察双亲及RIL群体的株高,每行顺序考察10株单株,千粒质量在收获后考察。
在数据采集过程中,剔除基因型杂合或不全、渍害或防病不充分造成的株高异常及籽粒皱缩的RIL家系,以保证研究结果的准确性。
1.4 抗病性鉴定
1.4.1 赤霉病抗性的鉴定 采用单花滴注法 [13] ,病原菌采用具有强致病力的赤霉菌混合菌株(F0301、F0609、F0980、F1312),由江苏省农业科学院陈怀谷研究员提供。取当天开花的麦穗,在顶部第5小穗注入10 μl分生孢子悬浮液(孢子含量1 ml为 5× 10 5 个),每个RIL株行接种20个小穗。接种麦穗套袋保湿3 d 后取下袋子以防止霉变,继续弥雾保湿18 d,接种21 d后调查患病小穗数。分别将苏麦3、扬麦18、扬麦22和安农8455作为高抗(HR)、中抗(MR)、中感(MS)和高感(HS)赤霉病对照品种。
1.4.2 白粉病抗性的鉴定 将RIL群体种植于温室大棚内,采用当地白粉菌混合菌种接种,以感病对照扬麦9号作为诱发行,当扬麦9号充分发病时,調查群体的发病情况。将叶片出现孢子堆的材料作为感病(S)材料,无孢子堆的材料作为抗病(R)材料 [14] 。分别将扬麦18、扬麦9号作为白粉病的抗病、感病对照品种。
1.4.3 黄花叶病毒病抗性的鉴定 将RIL群体种植于黄花叶病毒病鉴定圃中,待2月中下旬至3月中上旬感病对照扬麦22充分发病时,调查发病情况。以叶片黄化、心叶细弱扭曲的植株作为感病植株,以无症状的植株作为抗病植株 [15] 。将扬麦18、扬麦22分别作为抗、感黄花叶病毒病的对照品种。
1.5 数据统计分析和矮秆、多抗聚合品系的筛选
用 t 测验法对 Fhb1 阳性、阴性RIL组群中感染赤霉病的小穗数进行比较,评价在扬麦本底赤霉病抗性基础上 Fhb1 的抗性效应;分别对 Fhb1 阳性、阴性RIL组群及 QYm.njau-5A 阳性、阴性RIL组群的株高、粒质量进行比较,评价二者对株高、粒质量的影响。数据统计采用SPSS软件。
以矮秆、抗倒性好为前提,筛选超矮(株高低于亲本扬麦22)的多抗品系,考察不同年份、不同地点中选品系的频率。
2 结果与分析
2.1 RIL群体的抗病基因型分析及抗病基因在群体中的分布
利用诊断性标记 His3B-4、MBH1和WMC415 鉴定RIL群体中 Fhb1 、 Pm21 、 PmV 和 QYm.njau-5A 等基因/QTL的组成(图1)。由表2可以看出, Fhb1 、 QYm.njau-5A 在RIL群体中纯合基因型传代频率分别达到49.0% ( χ 2 = 0.36, P < 0.05)、50.5% ( χ 2 = 0.25, P < 0.05),符合Hardy-Weinberg定律,说明二者在亲子代可自由传递。
本研究考察了F 2∶11 代RIL群体对赤霉病、白粉病和黄花叶病毒病不同病害的抗性聚合类型,由表3可以看出,RIL群体中具有单病害抗性、双病害抗性和三病害抗性的株系数分别为80个、119个和58个。在单病害抗性中,单抗赤霉病、白粉病和黄花叶病毒病株系数分别为12个、54个和14个。在双病害抗性中,赤-白兼抗型、赤-黄兼抗型和黄-白兼抗型株系数分别为48个、21个和50个。兼抗3种病害的株系数为58个,分为2种聚合基因型,分别为38个Fhb1Fhb1+Pm21Pm21+QYm.njau-5AQYm.njau-5A和20个Fhb1Fhb1+PmVPmV+QYm.njau-5AQYm.njau-5A,前者显著多于后者。
2.2 抗病性综合鉴定结果
2.2.1 赤霉病抗性鉴定结果 在扬麦18/扬麦22 RIL群体中随机选取 Fhb1 阳性、 Fhb1 阴性株系各62个进行赤霉病接种鉴定,由表4可以看出, Fhb1 阳性株系组群的平均病小穗数为2.10个,而 Fhb1 阴性株系组群的平均病小穗数为3.60个,二者间相差1.50个 ( P < 0.01),其差异约等于中抗与中感对照间的抗性差异,表明在扬麦品种本底抗性基础上, Fhb1 对赤霉病抗性的贡献仍然是显著的。研究结果还显示,在 Fhb1 阳性、 Fhb1 阴性株系组群中,赤霉病病小穗数均呈连续分布,均存在超亲现象,抗性达到或超过中抗(MR)对照扬麦18的株系所占比例在2个组群中分别为67.7%、45.2%,抗性弱于中感(MS)对照扬麦22的株系所占比例分别为16.1%、43.5%。由于双亲抗性差距相对较小,抗性介于双亲间的RIL在2个组群中的比例均较小。
2.2.2 白粉病抗性鉴定结果 在温室内对RIL群体接种白粉菌,结果表明,用分子标记 MBH1 鉴定的含有 Pm21 或 PmV 基因的所有RIL家系均表现为高抗白粉病,而二者均不含的RIL家系均表现为高感白粉病,标记结果与抗性表型完全一致。
2.2.3 黄花叶病毒病抗性鉴定结果 RIL群体在黄花叶病毒病病圃的鉴定结果显示,在 QYm.njau-5A 连锁标记 WMC415 鉴定为阳性的RIL家系中仅观察到6个家系表现为花叶及黄矮症状(图2),表明诊断标记 WMC415 的脱靶率不足5%,能够满足标记辅助育种的需求。
2.3 Fhb1和QYm.njau-5A 对株高、粒质量的效应
3年2点的试验结果显示, Fhb1 阳性、 Fhb1 阴性小麦株系组群间的平均株高和平均千粒质量均无显著差异(表5),表明抗赤霉病基因 Fhb1 对小麦株高、千粒质量没有显著影响。
1:抗病对照扬麦18;2:抗病RIL家系;3:感病RIL家系;4:感病對照扬麦22。
比较 QYm.njau-5A 阳性、阴性RIL组群的平均 株高和平均千粒质量看出, QYm.njau-5A 对小麦株高的增效作用达2.58~4.73 cm,3年2点的试验结果均呈显著或极显著作用。由表6还可以看出, QYm.njau-5A 对小麦千粒质量没有显著影响。
2.4 矮秆、三病害抗性聚合株系的筛选
在聚合抗赤霉病、抗白粉病、抗黄花叶病毒病3种抗病性的小麦株系中筛选超矮(低于扬麦22)株系,结果显示,不同年份、不同地点筛选出的Fhb1Fhb1+Pm21Pm21+QYm.njau-5AQYm.njau-5A基因型(Ⅰ型)的超矮株系为 6~ 12个,基因型为Fhb1Fhb1+PmVPmV+QYm.njau-5AQYm.njau-5A (Ⅱ型)的株系为 1~ 3个,累计不足全部RIL群体的5%(表7)。试验结果还表明,环境对株高有次要影响。
3 讨 论
3.1 抗赤霉病基因 Fhb1 育种价值评估
Fhb1 是国际公认的抗性最好的抗赤霉病基因。马正强团队 [1] 、柏贵华团队 [2] 分别已从望水白、苏麦3号中克隆了 Fhb1 基因,为在抗赤霉病育种中精准追踪 Fhb1 基因奠定了基础。由于苏麦3号、望水白存在植株过高、产量低等缺点,因此在育种中难以直接应用。当前, Fhb1 利用较为成功的亲本是宁麦9号,已育成生选4号、生选6号、宁麦13、宁麦14、扬辐麦4号、扬麦18等一系列抗赤霉病品种 [16] 。江苏淮南和长江中下游地区由于春季高温多雨,一直是小麦赤霉病重发区域,中抗(MR)、中感(MS)赤霉病是该麦区品种审定的限制性指标。由于长期的赤霉病选择压,该麦区审定品种大多具有较好的赤霉病本底抗性,尤以扬麦系列、宁麦系列最具代表性。以宁麦9号为代表的宁麦系列品种很多具有 Fhb1 基因,而以扬麦158为代表的扬麦系列品种大多不具有 Fhb1 基因, Fhb1 能否在扬麦本底抗性基础上进一步提高赤霉病抗性一直是本研究团队关注的重点。
本研究利用扬麦18/扬麦22 RIL群体进行试验,证明 Fhb1 可显著提高扬麦系列小麦的赤霉病抗性,这将为长江中下游麦区主体品种扬麦系列品种的赤霉病抗性从过去的中感-中抗(MS-MR)向中抗-抗(MR-R)的过渡提供重要支撑。研究还发现, Fhb1 可在亲子代自由传递,且对小麦株高、千粒质量2个关键性状没有显著影响,将有利于该基因的广泛利用。本研究结果还显示, Fhb1 阳性组群中也存在一定比例的感病家系,而 Fhb1 阴性组群中也有较大比例的抗病家系,说明单一的 Fhb1 遗传操作难以满足抗赤霉病育种的要求,在标记辅助选择 Fhb1 的同时结合抗性表型鉴定将有利于提高抗赤霉病育种的效能。近期,江苏里下河地区农业科学研究所育成携 Fhb1 的扬16-157(组合:镇麦9号/扬麦18)和无 Fhb1 的扬14-214(组合:扬麦16//扬麦16/92R137),分别通过了国家联合攻关和国家区域试验,二者对赤霉病的抗性均达R级,是近年来长江中下游地区抗赤霉病育种上的一个重要提升。2020年,孔令让团队 [17] 克隆了来自长穗偃麦草的抗赤霉病基因 Fhb7 ,为抗赤霉病育种提供了新的元件。因此,我们正尝试以上述赤霉病抗性达R级的扬麦品种(如扬麦14-214、扬16-157)为材料,通过分子标记辅助选择,将 Fhb7 导入这些品种中以进一步提高其赤霉病抗性,从而培育赤霉病抗性达高抗(HR)水平的小麦品种。
3.2 抗黄花叶病毒病QTL/ QYm.njau-5A 的育种价值评估
小麦黄花叶病毒病由土传真菌——禾谷多黏菌( Polymyxagraminis )为介体的小麦黄花叶病毒(Wheat yellow mosaic bymovirus)引起,对小麦生长有不利影响 [18] 。王秀娥团队 [4] 最早在日本小麦品种西风的3BS、5AL、7BS上定位了多个抗黄花叶病毒病数量性状位点(QTL),其中以位于5AL上的 QYm.njau-5A 效应最强,可以解释25.9%~53.7%的表型变异。在本研究中,通过扬麦18/扬麦22 RIL群体遗传分析,证实 QYm.njau-5A 可作为主基因位点独立应用,足以应对当前黄花叶病毒病危害。但需予以重视的是, QYm.njau-5A 对小麦株高有显著增效作用,可能引起小麦抗倒性变弱。
基于同一群体的早期研究发现,小麦-簇毛麦易位T6V#2S·6AL、T6V#4S·6DL均对株高有显著增效作用 [9] ,当利用上述易位和 QYm.njau-5A 进行抗性聚合时,二者对株高的累积增效效应可达 4.67~ 8.14 cm,这对小麦抗倒性有不利影响。鉴于株高的数量性状特征,在涉及 Pm21 、 PmV 和 QYm.njau-5A 等抗病基因(位点)聚合时,有必要加大育种群体数量并强化对中矮秆品系的选择。
3.3 多抗性聚合育种效果及策略探讨
由于本研究所用双亲扬麦18、扬麦22的抗倒性均不够理想,在一定程度上影响了这2个品种的推广应用。因此,能否规避上述 QYm.njau-5A 和T6V#2S·6AL/T6V#4S·6DL对株高的不良影响,并在RIL群体中筛选出株高超低亲的中矮秆多抗品系是关系到抗病性聚合育种能否成功的关键。本研究在3种病害抗性聚合株系中筛选出株高超低亲的RIL家系在不同年份、不同地点的数量为7~15个,不足全部RIL群体的5%,说明以聚合 QYm.njau-5A 、T6V#2S·6AL/T6V#4S·6DL為目标的育种群体中,筛选矮秆品系难度较大。为提高中矮秆多抗品系的选择效率,在下一步具体的育种实践中,可适当调整育种策略,如以中矮秆品种扬麦22为轮回亲本、高秆品种扬麦18为供体亲本适当加以回交,理论上可显著提高分离群体中矮秆材料的比例。其次,利用遗传差异大的双亲组合往往能带来更大范围的株高等农艺性状的变异。如在另一育种实例中,为改善扬麦18的株型并保持其综合抗性和丰产性,以扬麦18为轮回亲本,北方紧凑型高秆品种元友-2为供体亲本,构建了BC 1 回交群体,强化了对株高的选择,成功育成了矮秆品种扬麦30和扬麦34(扬纹复4666),与扬麦18相比,二者显著提高了穗数、产量和抗倒性,同时可以保持对赤霉病、白粉病和黄花叶病毒病的抗性,其双亲较大的遗传差异为矮秆品种的选择提供了机会,实现了抗倒性、产量、抗病性之间的协调统一。
从理论上看,在保证一定群体的基础上,获得兼抗3种病害的小麦品系并不难,难的是如何在保持抗病性前提下筛选出综合农艺性状和丰产性能可被生产接受的优异品系。在本研究中,既要选出株高超低亲的矮秆三抗品系,同时还需综合考量株型、穗型、灌浆特性及对渍、旱、冷、热、肥等的耐受性,中选比例还将降低。因此对于单交组合来说,后续将加大群体规模,加大选择量,才有可能选到综合农艺性状和丰产性好并与多抗性统一的聚合体材料。幸运的是,笔者从中筛选出的矮秆多抗高产新品系扬17J103已进入湖北省区试,同时作为恢复系与不育系MTS-1 [19] 配制的杂交组合扬杂麦1号已进入西南麦区杂交小麦联合体试验。
参考文献:
[1] LI G Q, ZHU J Y, JIA H Y, et al. Mutation of a histidine-rich calcium-binding-protein gene in wheat confers resistance to Fusarium head blight[J]. Nature Genetics, 2019,51(7):1106-1112.
[2] SU Z Q, BERNARDO A, TIAN B, et al. A deletion mutation in TaHRC confers Fhb1 resistance to Fusarium head blight in wheat[J]. Nature Genetics, 2019,51(7):1099-1105.
[3] 朱展望,徐登安,程顺和,等.中国小麦品种抗赤霉病基因 Fhb1 的鉴定与溯源[J].作物学报, 2018, 44(4): 473-482.
[4] ZHU X B, WANG H Y, GUO J, et al.Mapping and validation of quantitative trait loci associated with wheat yellow mosaic bymo-virus resistance in bread wheat[J]. Theroretical and Applied Genetics, 2012, 124(1): 177-188.
[5] CHEN P D, QI L L, ZHOU B, et al. Development and molecular cytogenetic analysis of wheat- Haynaldia villosa 6VS/6AL translocation lines specifying resistance to powdery mildew[J]. Theroretical and Applied Genetics,1995,91(6/7):1125-1128.
[6] 别同德,高德荣,张 晓,等. 基于高代姊妹系组群研究小麦-簇毛麦染色体T6VS.6AL易位的遗传效应[J].江苏农业学报,2015, 31(6):1206-1210.
[7] LI H B, CHEN X, XIN Z Y, et al. Development and identification of wheat- Haynaldia villosa T6DL.6VS chromosome translocation lines conferring resistance to powdery mildew[J]. Plant Breeding, 2008, 124(2):203-205.
[8] BIE T D,ZHAO R H,ZHU S Y,et al. Development and characterization of maker MBH1 simultaneously tagging genes Pm21 and PmV conferring resistance to powdery mildew in wheat[J]. Molecular Breeding, 2015, 35:189.
[9] ZHAO R H, LIU B L, JIANG Z N, et al. Comparative analysis of genetic effects of wheat- Dasypyrum villosum translocations T6V#2S·6AL and T6V#4S·6DL[J]. Plant Breeding, 2019, 138(5):503-512.
[10] 张伯桥. 应用滚动回交选育抗白粉病小麦新品种扬麦18[J].中国农学通报, 2009, 25(13): 74-77.
[11] 吴宏亚,张伯桥,高德荣,等. 优质弱筋抗白粉病小麦新品种扬22[J]. 麦类作物学报, 2014, 34(6):876.
[12] TAPLA-TUSSELL R,QUIJANO-RAMAYO A, ROJAS-HERREAR R, et al. A fast, simple, and reliable high-yielding method for DNA extraction from different plant species[J]. Molecular Biotechnology, 2005, 31(2):137-139.
[13] ZHANG X H, PAN H Y, BAI G H, et al. Quantitative trait loci responsible for Fusarium head blight resistance in Chinese landrace Baishanyuehuang[J]. Theoreical and Applied Genetics, 2012, 125(3): 495-502.
[14] HE H G, ZHU S Y, JIANG Z N, et al. Comparative mapping of powdery mildew resistance gene Pm21 and functional characterization of resistance related genes in wheat[J]. Theroretical and Applied Genetics, 2016, 129(4): 819-829.
[15] 劉伟华,何震天,耿 波,等. 小麦对黄花叶病的抗性鉴定及典型品种的遗传分析[J].植物病理学报,2004,34(6):542-547.
[16] 张 旭,姜 朋,叶人元,等. 宁麦9号及其衍生品种的赤霉病抗性分析及抗性溯源[J].分子植物育种, 2017,15(3):1053-1060.
[17] WANG H, SUN S, GE W, et al. Horizontal gene transfer of Fhb7 from fungus underlies Fusarium head blight resistance in wheat[J]. Science, 368(6493), eaba5435.
[18] 赵仁慧,刘炳亮,寿路路,等. 分子标记辅助聚合抗小麦黄花叶病和白粉病育种[J]. 麦类作物学报, 2017, 37(12):1541-1549
[19] 李生荣,陶 军,杜小英,等. 强优势小麦杂交种‘绵杂麦168选育研究[J].农学学报, 2011,1(11): 26-29.
(责任编辑:徐 艳)
