拟南芥 AtFAD6 基因突变体的构建
2021-11-14徐雪珍郑月萍张夏婷宋孜元
徐雪珍 郑月萍 张夏婷 宋孜元


摘要: 运用优化后的CRISPR/Cas9基因编辑载体,创建了2个不同的拟南芥脂肪酸去饱和酶6基因( AtFAD6 )突变体,其 AtFAD6 基因的保守位点氨基酸序列均发生变化,同时终止密码子被提前引入,基因功能丧失。脂肪酸组分分析结果显示,这2种突变体的叶片中单不饱和脂肪酸 16∶ 1和 18∶ 1大量积累,多不饱和脂肪酸 16∶ 3和 18∶ 3含量则大幅下降,同时伴随着叶片发黄、地上部生物量显著降低、抽薹提前 2~ 3 d的表型变化。多不饱和脂肪酸 18∶ 3作为茉莉酸合成的前体物质,其含量的下降致使突变体中茉莉酸信号标记基因 AtVSP1 在叶片中的表达量有所降低,而茎中的表达量提高了40%以上。所获得的2个 AtFAD6 功能丧失型突变体为进一步研究脂类代谢与植物生长发育之间的关系提供了重要的遗传材料。
关键词: 拟南芥; CRISPR/Cas9; 脂肪酸去饱和酶( FAD ); 基因突变体
中图分类号: Q754 文献标识码: A 文章编号: 1000-4440(2021)05-1125-06
Construction of Arabidopsis AtFAD6 gene mutant
XU Xue-zhen, ZHENG Yue-ping, ZHANG Xia-ting, SONG Zi-yuan
(School of Agricultural and Food Sciences, Zhejiang A&F University, Hangzhou 311300, China)
Abstract: The optimized CRISPR/Cas9 gene editing vector was used to create two distinct Arabidopsis AtFAD6 gene mutant. As the nucleotide sequence of the conserved amino acid residues was mutated, and the stop codon was introduced in advance, the fad6 gene function of these two mutants was completely lost. The results of fatty acid composition analysis showed that monounsaturated fatty acids 16∶ 1 and 18∶ 1 accumulated significantly while the content of polyunsaturated fatty acids 16∶ 3 and 18∶ 3 decreased significantly in the leaves of these two mutants. At the same time, phenotypes of the mutants were appeared, including yellowed leaves, significantly decreased above-ground biomass, and bolting 2- 3 days earlier than wild-type. The paly unsaturated fatty acid 18∶ 3 was used as the precursor substance of jasmonic acid synthesis. The decrease of its content reduced the expression of the jasmonic acid signal marker gene AtVSP1 in the leaves, while the expression in stems increased by more than 40%. The two AtFAD6 loss-of-function mutants obtained in our study provide important genetic material for further research on the relationship between lipid metabolism and plant growth and development.
Key words: Arabidopsis ; CRISPR/Cas9; fatty acid desaturase( FAD ); gene mutant
不飽和脂肪酸是植物细胞内一类重要的代谢物质,也是植物膜脂的主要结构成分,在植物生长发育、应答各种环境信号等过程中发挥重要作用 [1] 。脂肪酸去饱和酶( FAD )是催化脂肪酸链特定位置形成双键和产生不饱和脂肪酸的酶类,它的种类和数量在很大程度上可以调控植物组织的脂肪酸组成。而膜脂中不饱和脂肪酸种类及其含量的改变常常引起膜功能的变化。在模式植物拟南芥( Arabidopsis thaliana )中, AtFAD6 是质体内膜上的ω-6型脂肪酸去饱和酶,可将初步形成的甘油脂甘油骨架上的油酸( 18∶ 1)或棕榈油酸( 16∶ 1)还原成亚油酸( 18∶ 2)或棕榈亚油酸( 16∶ 2) [2] ,它不仅对维持膜的稳定性和流动性具有重要作用,还参与茉莉酸(Jasmonic acid, JA)生物合成的前体物质三烯脂肪酸(Trienoic fatty acid)的合成 [3] 。茉莉酸是植物体内一种重要的内源激素,具有促进植物根系生长与再生、抑制拟南芥叶片和花瓣伸展、抑制植物下胚轴生长、调节气孔开关、调控拟南芥雄蕊发育、促进叶片衰老等作用 [3] 。现有许多研究结果表明, FAD6 在植物抵御低温、高盐胁迫等非生物胁迫中具有重要作用 [4] 。
在早期的基因功能研究中,研究者常采用反向遗传学手段,构建基因突变体。受到技术水平的限制,前人构建突变体的方法多为化学诱变法。然而,这种方式构建的突变体常常只在目标基因发生点突变,使氨基酸残基发生变化,不一定造成基因功能的完全丧失。例如有研究结果显示使用EMS诱变创建的 ATS1 基因突变体存在严重的基因渗透现象 [5] 。因此,构建功能完全丧失型突变体成为明晰基因功能的重要前提。随着基因定点编辑技术的发展,CRISPR/Cas9系统的成功应用使构建功能丧失型突变体变得简便。CRISPR/Cas9系统主要由sgRNA和Cas9蛋白两部分构成,其基本工作原理是sgRNA在受体基因组中找到与其互补配对的片段,引导Cas9蛋白对该位点进行切割,而后在植物DNA自我修复过程中引入突变 [6] 。
目前在植物脂类代谢研究领域,使用的 AtFAD6 基因突变体均为非同义突变,其中只有单个氨基酸残基发生改变 [7] ,因而难以判定这类突变体是否含有部分 AtFAD6 酶活性。在这种情况下,人们不能完全了解 AtFAD6 基因的功能。因而,为了进一步阐明 AtFAD6 的基因功能,本研究利用优化后的CRISPR/Cas9基因编辑载体对 AtFAD6 基因进行定点编辑,构建功能完全丧失型突变体,并分析 AtFAD6 基因功能的丧失对拟南芥抽薹及茉莉酸信号强度的影响。
1 材料与方法
1.1 AtFAD6 基因功能丧失型突变体的构建
1.1.1 CRISPR/Cas9载体的构建 CRISPR/Cas9靶序列的设计和载体的构建参照Wang等 [8] 和朱丽颖等 [9] 的方法。以拟南芥脂肪酸去饱和酶基因 AtFAD6 为靶基因,从中选取G、C含量较高、基因特异性较强的2个关键片段 AtFAD6 target sequence 1 (5′-CAGAAGAAGCAGCAAGCTTAGG-3′)和 AtFAD6 target sequence 2 (5′-AAACCGCCATGGCTCATATGGG -3′)作为靶序列。其中,第一个靶序列含有 Hin d III酶切位点,可规避常用的PAGE法筛选遇到的难以筛选到碱基替换和小片段缺失的问题 [10] 。用高保真酶以稀释100倍的pCBC-DT1T2为模板进行四接头引物(5′-TGCAGAAGAAGCAGCAAGCTTGTTTTAGAGCTAGAAATAGC-3′,5′-AACATA ̄T ̄G ̄A ̄G ̄C ̄C ̄A ̄T ̄G ̄G ̄C ̄G ̄G ̄T ̄T ̄T ̄CAATCTCTTAGTCGACTCTCTAC-3′, ̄5′-A ̄T ̄A ̄T ̄A ̄T ̄G ̄G ̄T ̄C ̄T ̄C ̄G ̄A ̄T ̄T ̄G ̄C ̄A ̄G ̄A ̄A ̄G ̄A ̄A ̄G ̄C ̄A ̄G ̄C ̄A ̄A ̄G ̄C ̄T ̄T ̄G ̄T ̄T ̄-3′和5′-A ̄T ̄T ̄A ̄T ̄T ̄G ̄G ̄T ̄C ̄T ̄C ̄G ̄A ̄A ̄A ̄C ̄A ̄T ̄A ̄T ̄G ̄A ̄G ̄C ̄C ̄A ̄T ̄GGCGGTTTC -3′ )PCR擴增并纯化回收PCR产物。同时用 Bsa I酶切回收的PCR产物和CRISPR/Cas9载体,T4连接酶组装最终载体,获得双靶点CRISPR/Cas9基因编辑载体。
1.1.2 拟南芥的遗传转化 供试材料为哥伦比亚野生型拟南芥(Col-0),生长条件为14 h光照/10 h黑暗,昼夜温度为22 ℃/18 ℃,相对湿度为40%,水肥供应充足。使用农杆菌侵染法将构建好的编辑基因载体转化至拟南芥 [11] 。
1.1.3 拟南芥阳性转基因后代的筛选 我们在CRISPR/Cas9编辑载体中克隆了种子特异性表达的 At2S3 启动子驱动的荧光蛋白报告基因 mCherry 作为筛选标记 [9] ,因此,在将编辑载体转化拟南芥获得T 1 代转基因种子后,使用荧光显微镜筛选转基因阳性种子。转基因阳性种子具有荧光蛋白报告基因 mCherry 的转入,在蓝色激发光下可以显示红色荧光 [12] 。
1.1.4 突变体的分子筛选 在靶序列 AtFAD6 target sequence 1和 AtFAD6 target sequence 2两端分别设计引物,使PCR产物为包括靶序列在内约200 bp的片段。提取T 1 代阳性转基因植株叶片的DNA为模板进行PCR。取具有 AtFAD6 target sequence 1序列的PCR产物用 Hind Ⅲ充分酶切,经2%琼脂糖凝胶电泳检测。取具有 AtFAD6 target sequence 2序列的PCR产物用8%的非变性聚丙烯酰胺凝胶(丙烯酰 胺∶ 甲叉双丙烯酰 胺= 29∶ 1)检测 [9] 。
1.2 叶片脂肪酸组分分析
取生长33 d的植株叶片样品,经液氮研磨后称取500 mg进行试验。以100 μl 100 μg/ml 的十七烷酸甘油三酯正己烷溶液为内标,用6 ml氯 仿∶ 甲 醇∶ 甲酸 (10∶ 10∶ 1,体积比)和2 ml氯 仿∶ 甲 醇∶ 水 (5∶ 5∶ 1,体积比)经2次抽提,合并上清提取液,加入3 ml含0.2 mol/L 磷酸和1.0 mol/L 氯化钾的水溶液,抽提下层氯仿相。经氮气吹干后,加入 300 μl氯仿将沉淀重新溶解,再加入2 ml 1%硫酸-甲醇溶液,于80 ℃恒温干式金属浴2 h。冰上冷却,用2 ml 0.9% NaCl(质量体积比)溶液和2 ml正己烷萃取后,再用2 ml正己烷二次萃取,合并萃取液。通过氮吹法浓缩萃取液体积至100 μl [9] ,然后用气相色谱仪进行检测 [13] 。每个株系设置3个生物学重复。用单因素方差分析法分析株系间的差异显著性。
1.3 叶绿素含量测定
取播种后 3~ 4周的植株整个地上部,放入干净的12 ml带盖玻璃管中,加入3 ml 80%丙酮溶液。4 ℃下保存14 h,参照Arnon的方法对其叶绿素含量进行测定 [14] 。每个株系设置5个生物学重复,用单因素方差分析法分析株系间的差异显著性。
1.4 地上部生物量测定
取播种后 21~ 28 d的植株整个地上部,分别在烘干前、后称量其鲜质量与干质量,通过其鲜质量与干质量的差值占鲜质量的比例计算含水量。每个株系设置10个生物学重复,用单因素方差分析法分析株系间的差异显著性。
1.5 基因表达量分析
基因表达量分析采用qRT-PCR 法。根据已知的 AtVSP1 和 AtVSP2 基因(Gene ID: AT5G24780)序列(数据来源于拟南芥信息资源库www. Arabidopsis .org)设计实时定量PCR引物。 AtVSP1 的正向引物和反向引物分别为5′-TGGATCTTTGACCTAGACGACA-3′和5′-CGAGTTCCAAGAGGTTTTVGTA-3′。
取播种后40 d的相同叶位叶片和茎,依次进行总RNA的提取(Trizol法)及基因组DNA的去除、反转录,并以反转录形成的cDNA为模板进行qRT-PCR检测。以拟南芥 AtACTIN 为内参基因,其扩增引物序列为5′-GTCGTACAACCGGTATTGTGCT-3′和5′- TGTCTCTTACAATTTCCCGCTCT-3′。采取2 -△△ Ct 法计算待测基因的相对表达量 [15] 。
2 结果与分析
2.1 AtFAD6 基因突变体的获得
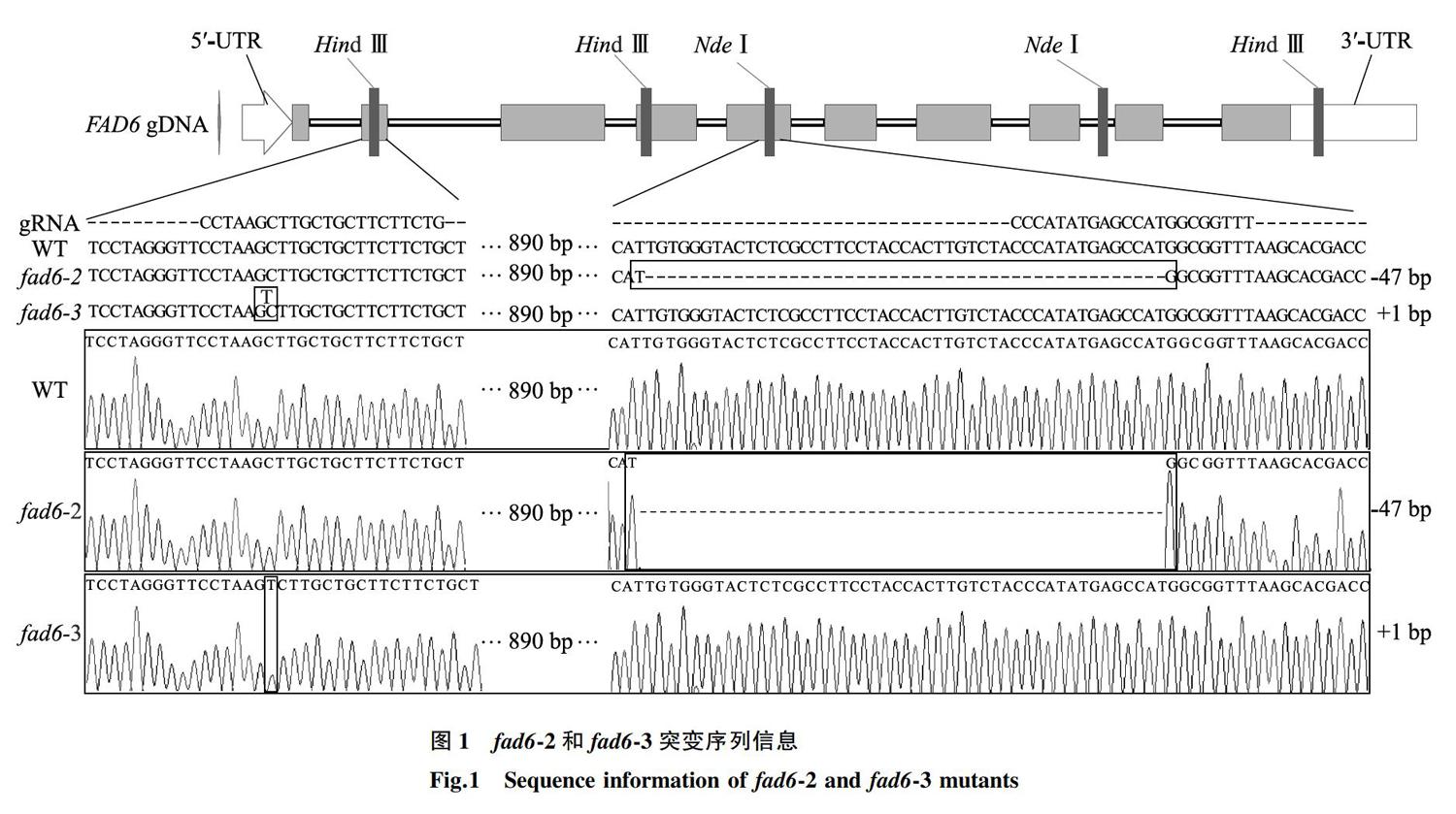
2.1.1 AtFAD6 基因突变体基因型的分子鉴定 使用酶切法和PAGE法对转基因阳性植株进行基因型鉴定。经过多代连续筛选鉴定后,获得了2个纯合的突变体,沿袭前人命名方式,并根据获得突變体的顺序,将其命名为 fad6 -2和 fad6 -3。
获得纯合可稳定遗传的突变体后,对其靶位点附近序列进行分析验证。结果表明 fad6 -2和 fad6 -3突变体分别在2个靶位点处,即第5个和第2个外显子处,发生了47 bp缺失和1 bp插入的突变(图1),其CDS序列发生相应变化,造成移码突变。在转录后翻译过程中,fad6-2的第187位氨基酸残基由苏氨酸(T)突变为甲硫氨酸(M),并在继续错误翻译2个氨基酸(VG-AV)后,引入终止密码子UAA,提前终止翻译;fad6-3的第25位氨基酸残基由亮氨酸(L)突变为丝氨酸(S),并在继续错误翻译17个氨基酸(AASSARVSPGVYAVKPI-CCFFCSCFSWCICCEAD)后,引入终止密码子UGA,提前终止翻译。二者均造成由原位于207、210、211、367、370、371位点处的6个组氨酸残基的氨基酸序列发生变化,而这些位点对铁离子的结合具有重要作用 [16] 。因此,我们构建的突变体可判断为功能丧失型突变体。
2.1.2 AtFAD6 基因突变体的脂肪酸组分分析 AtFAD6 负责编码质体脂肪酸去饱和酶,它可以催化在单不饱和脂肪酸 16∶ 1或 18∶ 1中再引入一个双键成为 16∶ 2或 18∶ 2的反应,因此,还可以通过测定叶片脂肪酸组分的变化验证 AtFAD6 的基因功能完整性。对生长33 d的植株叶片进行脂肪酸组分分析,结果(表1)显示,与野生型相比,2个突变体中 AtFAD6 的底物 16∶ 1和 18∶ 1大量累积,均上升5倍以上。而其最终产物不饱和脂肪酸 16∶ 3和 18∶ 3含量大幅下降,此结果同样表明获得的突变体为 AtFAD6 基因功能丧失型突变体。
2.2 AtFAD6 基因突变体的表型分析
播种后21 d, AtFAD6 基因功能丧失型突变体与野生型相比表现出了明显的表型差异。植株叶片变黄(图2A);叶绿素a与叶绿素b的比值约上升23.4%(图2E);地上部生长势变弱,地上部生物量减少至野生型的62%左右(图2D),而叶片含水量未发生显著变化(数据未显示)。另外, AtFAD6 基因功能的丧失可显著加速植物抽薹(图2C),突变体拥有 8~ 9片莲座叶时即可抽薹,而野生型莲座叶需 11~ 13片时开始抽薹(图 2B),与野生型相比,突变体抽薹日期比野生型提前了 2~ 3 d(图2F)。另外, AtFAD6 产物 18∶ 3参与植物体内茉莉酸的生物合成 [3] , AtFAD6 基因突变可能影响植物体内茉莉酸信号强度。本研究对茉莉酸信号标记基因 AtVSP1 进行了表达量分析。结果显示 AtVSP1 表达量在叶片中稍有下降,在茎秆中提高了40%以上(图2G),表明该生长阶段, AtFAD6 功能的丧失对植物体内茉莉酸信号的影响具有组织特异性。
3 讨 论
AtFAD6 是质体 ω -6型脂肪酸去饱和酶,对叶片中脂肪酸组分具有重要影响。在本研究中创制的2个 AtFAD6 基因功能丧失型突变体中,底物 16∶ 1和 18∶ 1大幅积累,产物 16∶ 3和 18∶ 3含量大幅下降,这与前人研究结果一致 [16-17] 。另外,脂肪酸组分的改变常常影响质体膜的完整性和流动性,进而影响植物对逆境胁迫的响应 [7,18] 。研究发现,在正常生长条件下, AtFAD6 基因突变导致植株叶片整体发黄。出现叶片整体发黄表型的原因通常为受到了光、温、水、土、肥、病虫等方面非生物和生物胁迫,或自然衰老代谢。本研究中,植株生长过程中未受到生物和非生物胁迫,叶片含水量也未发生显著变化,表明该表型不是由于叶片生理性缺水或衰老造成的。突变体叶片发黄可能是由于 AtFAD6 直接负责质体内膜脂合成,其功能丧失影响了叶绿体内膜的完整性和流动性,进而导致叶绿体含量下降。而由于在不同部位形成的不饱和脂肪酸之间存在交换 [19] ,因此 AtFAD6 基因丧失功能后,植株仅出现叶片发黄的表型,未直接死亡。而 AtFAD6 基因功能的丧失是否导致了植株内源性氮元素的缺乏,还需进一步探究。
(A)播种后第21 d植株表型;(B)、(C) 播种后第33 d植株表型;(D)播种后第21 d地上部鲜质量( n =10);(E)播种后第21 d叶绿素a与叶绿素b的比值( n =5);(F)野生型和突变体抽薹所需天数( n =20);(G)播种后第33 d AtVSP1 相对表达量。 * * 表示存在0.01水平上的显著差异; * * * 表示存在0.001水平上的显著差异; * * * * 表示存在 0.000 1 水平上的显著差异。Bar=2 cm。
早期研究结果表明,在正常生长条件下, AtFAD6 基因功能的丧失对植株的生长及生长发育进程无明显影响 [17] ,但本研究结果与其并不完全一致。我们发现, AtFAD6 基因的突变造成植株地上部生物量显著下降,抽薹显著提前。这可能是由于在早期研究中,植株基因突变体的创建主要通过EMS诱变的途径,创建的突变体 fad6 -1仅发生非同义突变,其翻译的多肽链中,仅第160位的甘氨酸(G)残基突变为精氨酸(R) [7] ,在这种突变体中, AtFAD6 基因功能可能未完全丧失,而我们构建的突变体为功能丧失型突变体。这些差异表明,我们获得的功能丧失型突变体将有助于彻底了解 AtFAD6 基因功能。同时也表明,利用CRISPR/Cas9基因编辑技术创制基因功能丧失的植物突变体具有重要的实践应用价值 [20-21] 。
在本研究中,我们还对茉莉酸信号标记基因 AtVSP1 在拟南芥野生型和突变体抽薹期叶片和茎秆中的表达量进行比较分析,结果显示, AtFAD6 的突变造成 AtVSP1 在植株叶片中表达量稍有降低,在茎秆中表达量大幅提升,表明 AtFAD6 对植物体内茉莉酸信号的影响具有组织特异性。大量研究结果表明,茉莉酸信号途径对植物开花时间和雄蕊发育等生育进程具有重要的调控作用 [22] 。 AtFAD6 基因是否通过影响茉莉酸合成前体多不饱和脂肪酸的形成,进而影响茉莉酸信号强度的变化对植物抽薹以及生育期造成影响,及其具体分子机制还需进一步研究。
利用CRISPR/Cas9基因编辑技术创建 AtFAD6 基因功能丧失型突变体,不仅有助于完善对 AtFAD6 基因功能的认识,同时为进一步研究脂类代谢与植物生长发育的关系提供了有用的遗传材料。
参考文献:
[1] 戴晓峰,肖 玲,武玉花,等.植物脂肪酸去饱和酶及其编码基因研究进展[J].植物学通报,2007,24(1):106-115.
[2] OHLROGGE J B, BROWSE J A. Lipid biosynthesis[J]. Plant Cell, 1995, 7: 957-970.
[3] HUANG H, LIU B, LIU L, et al. Jasmonate action in plant growth and development[J]. Journal of Experimental Botany, 2017, 68(6):1349-1359.
[4] 刘 华,张建涛,陈海燕,等.脂肪酸去饱和酶参与植物对胁迫的响应[J].东北农业大学学报,2013,44(1):154-160.
[5] XU C C, YU B, CORNISH A J, et al. Phosphatidylglycerol biosynthesis in chloroplasts of Arabidopsis mutants deficient in acyl-ACP glycerol-3-phosphate acyltransferase[J]. Plant Journal, 2006, 47(2): 296-309.
[6] JAVED M R, SADAF M, AHMED T, et al. CRISPR-Cas system: history and prospects as a genome editing tool in microorganisms[J]. Current Microbiology, 2018, 75: 1675-1683.
[7] ZHANG J T, ZHU J Q, ZHU Q, et al. Fatty acid desaturase-6 (Fad6) is required for salt tolerance in Arabidopsis thaliana [J]. Biochemical and Biophysical Research Communications, 2009, 390: 469-474.
[8] WANG Z P, XING H L, DONG L, et al. Egg cell-specific promoter-controlled CRISPR/Cas9 efficiently generates homozygous mutants for multiple target genes in Arabidopsis in a single generation[J]. Genome Biology, 2016, 16: 144-155.
[9] 朱麗颖,郑月萍,徐雪珍,等.一种准确、简便测定CRISPR/Cas9 基因编辑效率的方法[J].江苏农业学报,2020,36(2):299-305.
[10] ZHU X X, XU Y J, YU S S, et al. An efficient genotyping method for genome-modifid animals and human cells generated with CRISPR/Cas9 system[J]. Scientific Reports, 2014, 4:6420.
[11] 郭 勇,王玉成,王智博.一种基于农杆菌介导的拟南芥瞬时转化技术优化[J]. 东北林业大学学报,2016,44(6):41-44,83.
[12] 陈 娟,周 洁,严其成,等.HPT-mCherry 融合标签在水稻转基因筛选鉴定中的应用[J]. 生物技术通讯,2013,24(5):677-681.
[13] 徐明明,史卓维,郑璐侠,等.蓖麻油、氢化蓖麻油及其聚氧乙烯衍生物中的主要脂肪酸的鉴别[J]. 药物分析杂志,2015,35(10):1862-1865.
[14] ARNON D. Copper enzymes in isolated chloroplasts. Polyphenoloxidase in Beta vulgaris [J]. Plant Physiology, 1949, 24: 1-15.
[15] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative pcr and the 2 -△△ Ct method[J]. Methods, 2001, 25: 402-408.
[16] FALCONE L D, GIBSON S, LENIEUX B, et al. Identification of a gene that complements an Arabidopsis mutant deficient in chloroplast ω6 desaturase activity[J]. Plant Physiology, 1994, 106: 1453-1459.
[17] BROWSE J, KUNST L, ANDERSON S, et al. A mutant of Arabidopsis deficient in the Chloroplast 16∶ 1/ 18∶ 1 desaturase[J]. Plant Physiology, 1989, 90: 522-529.
[18] KACHROO P, SHANKLIN J, SHAH J, et al. A fatty acid desaturase modulates the activation of defense signaling pathways in plants[J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98: 9448-9453.
[19] JOHN O, JOHN B. Lipid biosynthesis[J]. Plant Cell, 1995, 7: 957-970.
[20] 李星坤,潘 慧,李 攀,等. 基于 CRISPR/Cas9 系統的拟南芥 ugt84a1/ugt84a2 双突变体制作及突变位点分析[J].江苏农业科学,2020,48(20):49-55.
[21] 易 勇,郑 瑞,杨 波,等.水稻锌指蛋白基因 CRISPR/Cas9 突变体的构建及突变分析[J].南方农业学报,2020,51(11):2607-2613.
[22] 陈金焕,田玉如,李艾佳,等.茉莉酸信号及其在木本植物中的研究进展[J]. 中国科学,2020,50(2):215-226.
(责任编辑:张震林)
