SiO2@TiO2-Ag复合结构光催化剂制备及其光催化性能研究
2021-11-14周亦岸
付 宁,周亦岸,张 良
(甘肃省环境监测中心站,甘肃 兰州 730020)
1 引言
1972年Fujishima和Honda发现利用半导体TiO2可以实现光电催化产氢[1],后来Frank等[2]利用TiO2进行光催化降解水中污染物,通过半导体光催化技术将太阳能转化为化学能和光能,从而实现能量转换成为了研究的热点,半导体光催化剂随之应用于水环境污染物降解、空气净化、太阳能电池等研究领域[3~6]。TiO2作为重要的半导体光催化剂具有化学性质稳定、成本低、耐光腐蚀、光催化效率高等优点,同时可以降解各种环境污染物(如无机重金属、有机染料等),但是TiO2在光催化应用过程中仍存在缺陷,主要是TiO2具有较宽的禁带宽度(3.2 eV),仅能利用太阳光中的紫外光,不能充分利用太阳能中的可见光;另外TiO2容易产生团聚现象,影响光催化效率[7~9]。因此,如何提高TiO2光催化量子效率和拓宽光响应范围成为解决光催化效率的关键因素,目前研究较多的有通过TiO2掺杂改性(金属掺杂、非金属元素掺杂)[10]、TiO2复合其它半导体光催化剂[11]及改变TiO2形貌结构特性[12]等方法提高TiO2光催化效率。
核壳结构光催化剂可以有效提高比表面积,减少团聚,有效提高光催化效率。利用SiO2作为内核负载TiO2,可以有效避免TiO2团聚及晶型转化,增加比表面积,提高光生电子-空穴对分离效率;同时SiO2化学稳定性强、耐热性能好、制备简单、成本低、形貌可控[13]。Ullah等[13]利用水热法制备出了核壳结构SiO2@TiO2,在紫外光照射下,核壳结构SiO2@TiO2光催化降解结晶紫染料的效率高于纯的TiO2。Kitsou等[14]用溶胶-凝胶法合成了核壳结构SiO2@TiO2光催化剂,并对空气中NOX及水中4-硝基苯酚进行了光催化实验,结果表明,核壳结构SiO2@TiO2光催化剂在光催化降解空气中NOX及水中4-硝基苯酚时的光催化效率均比单独TiO2高。
在TiO2金属掺杂改性研究中贵金属如Ag,Au和Pt等金属掺杂后会在TiO2表面形成肖特基势能,有效捕获光生电子,从而抑制电子空穴对复合,促进光催化降解效率,为了进一步提高光催化活性,研究表明可以在SiO2@TiO2核壳结构光催化剂表面负载或沉积金属如Ag[15]、Au[16]、Pt[17]、Ce[18]、Ni[19]、Zr[20]等,从而拓宽复合结构光催化剂光吸收范围,抑制电子-空穴对复合,提高光催化活性。
本文采用水热法制备了SiO2@TiO2核壳结构光催化剂,通过光沉积法合成了SiO2@TiO2-Ag复合结构光催化剂。通过降解苯酚和亚甲基蓝,研究了Ag的掺杂量对SiO2@TiO2核壳结构光催化剂光催化降解效率的影响。
2 实验
2.1 试剂与仪器
试剂:钛酸四异丙酯(C12H28O4Ti 95%,TTIP, 化学纯),正硅酸乙酯(Si(OC2H5)4,TEOS,化学纯),异丙醇(C3H8O,分析纯),无水乙醇(EtOH,优级纯),氨水(NH3·H2O 25%,分析纯),氢氧化钠(NaOH,优级纯),盐酸(HCl,优级纯),氯化钾(KCl,优级纯),硝酸银(AgNO3·6H2O 99%,分析纯),实验过程中用水均为去离子水。
仪器:扫描电镜(JSM-6701F, 日本)及透射电镜(TECNAI G2, 美国)用来观察样品的大小及形貌特征。X射线能谱分析(EDS)利用扫描电镜(JSM-6701F, 日本)分析样品元素组成。X射线粉末衍射仪(XRD)(RigakuX,Cu靶,波长为0.15418 nm,管电流为100 mA,管电压为40.0 kV,扫描范围为10°~80°,扫描速度为0.02°/min,日本理学公司)用于样品相结构及样品成分表征。样品红外表征用红外分光光度计(IR Prestige-21 FT-IR spectrometer,岛津,日本)以KBr为空白,扫描波数范围为400~4000 cm-1。光催化性能利用可见分光光度计(3100 UV)测定。X射线光电子能谱仪(XPS)(PHI-5702 XPS, 物理电子公司, 美国)以Mg Kα作为金属阳极靶,碳原子的结合能(C1s:285ev)为参考。
2.2 SiO2的制备
SiO2的制备是根据Stöber法合成的[13],首先在带有磨口塞的玻璃瓶中加入100 mL无水乙醇,后将4 mL氨水和15 mL水加入乙醇中,加塞在磁力搅拌器上搅拌30 min;然后将3 mL正硅酸乙酯快速加入上述混合液中并在室温条件下(25±2℃)加塞持续搅拌3 h,后用5 mol/L HCl 中和混合反应液,4000 r/min离心10 min;最后用无水乙醇及水离心清洗四次,70℃下至少干燥20 h得到SiO2球形颗粒。
2.3 SiO2@TiO2核壳结构光催化剂的制备
利用水热法制备SiO2@TiO2核壳结构光催化剂[13]。将制备好的0.5 g SiO2在110℃干燥1 h,加入80 mL异丙醇中超声1 h,后加入2 mL钛酸四异丙酯,在磁力搅拌器上搅拌24 h。然后将15 mL水醇混合液(5 mL水+10 mL异丙醇)以2 mL/min的速度缓慢加入上述混合液中,搅拌3 h后将混合液8000 r/min下离心并用异丙醇和水分别清洗两遍。离心后将沉淀物溶解在50 mL水中,转入高压反应釜中于105℃反应24 h,后在8000 r/min下离心并于70 ℃至少干燥20 h制备出SiO2@TiO2核壳结构光催化剂。最后将干燥后的SiO2@TiO2核壳结构光催化剂在450 ℃煅烧2 h。纯的TiO2用2 mL TTIP按照上述步骤制备(不加SiO2)。
2.4 SiO2@TiO2-Ag复合核壳结构光催化剂的制备
利用光沉积法合成SiO2@TiO2-Ag复合核壳结构光催化剂[21]。分别将4份0.2 g制备出的SiO2@TiO2核壳结构光催化剂分散在80 mL异丙醇中超声1 h;准确称量0.340 g 硝酸银溶解于50 mL 蒸馏水使其浓度为2 mmol/L。将不同体积的硝酸银溶液分别加入0.2 g SiO2@TiO2核壳结构光催化剂中,使其Ag的质量比含量占SiO2@TiO2核壳结构光催化剂分别为1 wt %、3 wt %、6 wt %和9 wt %,再将上述掺杂Ag的混合溶液在搅拌状态下移至高压汞灯下光沉积反应60 min,使Ag能够沉积到SiO2@TiO2核壳结构光催化剂表面;最后将反应物在8000 rpm下离心并于70 ℃至少干燥20 h制备出SiO2@TiO2-Ag核壳结构光催化剂。
2.5 光催化性能分析
配制50 mg/L的苯酚及亚甲基蓝溶液各200 mL,分别将纯的TiO2及不同质量比的PPy/TiO2样品分散于苯酚及亚甲基蓝溶液中(投加量为0.5 g/L),黑暗条件下搅拌30 min后用500 W汞灯进行光催化降解实验。每隔一定时间取样,离心分离后取上清液分析测定。苯酚溶液用4-氨基氨替比林光度法测定,反应后510 nm测定吸光度;亚甲基蓝溶液用直接比色法测定,在664 nm下测定其吸光度,光催化降解亚甲基蓝的计算公式为:
η=[(A0-A)/A0]×100%
(1)
式(1)中:η为降解率;A0为降解前的吸光度;A为降解后的吸光度。
3 结果与讨论
3.1 形貌分析
SiO2,SiO2@TiO2核壳结构光催化剂及不同Ag含量的SiO2@TiO2-Ag复合核壳结构光催化剂形貌结构见扫描电镜图1和透射电镜图2。如图1(a)所示,SiO2呈球形结构,表面光滑,直径约200~300 nm;和球形SiO2相比,SiO2@TiO2核壳结构光催化剂形貌也呈球形结构(图1(b)),但是SiO2表面负载TiO2后呈明显粗糙结构,粒径大小约为5-10 nm的TiO2负载在SiO2表面,SiO2@TiO2核壳结构光催化剂粒径直径大小约为210-330 nm。图1(c)和图1(d)为6 wt% SiO2@TiO2-Ag 扫描电镜照片,结果显示不管在低倍还是高倍扫描电镜下,光沉积在SiO2@TiO2表面的Ag颗粒很难在扫描电镜下同TiO2颗粒区分开,但SiO2@TiO2-Ag整体颗粒的粒径变大。图2(a)和图2(b)中SiO2和SiO2@TiO2的透射电镜照片和图1中扫描电镜照片呈现的形貌结构相似,SiO2呈光滑球形结构,粒径较小的TiO2负载在球形SiO2表面。图2(c)~图2(f)分别为1 wt%、3 wt%、6 wt% 和9 wt%的SiO2@TiO2-Ag透射电镜照片,如图所示,负载在SiO2表面颜色较深的颗粒为Ag,而且Ag颗粒明显随着合成过程中AgNO3含量增加而增加,同时Ag颗粒粒径也逐渐变大。
SiO2@TiO2核壳结构光催化剂及6 wt% SiO2@TiO2-Ag 光催化剂EDS谱图如图3所示,EDS分析结果表明,SiO2@TiO2核壳结构光催化剂中含有Si、Ti、O元素,而SiO2@TiO2-Ag 光催化剂中含有Si、Ti、O、Ag元素,这进一步说明光沉积合成的SiO2@TiO2-Ag光催化剂中Ag颗粒负载在SiO2@TiO2核壳结构光催化剂表面形成了复合光催化剂。

图1 扫描电镜图

图2 透射电镜图
3.2 X射线衍射(XRD)分析
TiO2,SiO2,SiO2@TiO2核壳结构光催化剂及不同Ag含量的SiO2@TiO2-Ag复合核壳结构光催化剂XRD见图4。如图4(a)所示,TiO2最大衍射峰在2θ=25.3°,37.8°,48.2°,54°和 62.9°处具有特征衍射峰,分别对应锐钛矿TiO2晶面(101),(004),(200),(211)和(204),说明TiO2属于锐钛矿晶型结构[22]。图4(b)中SiO2在2θ=23°处具有较大的衍射峰,这说明SiO2属于无定型结构。图4(c)为SiO2@TiO2核壳结构光催化剂XRD图,结果显示SiO2@TiO2在2θ=25.3°处存在锐钛矿TiO2晶型特征衍射峰,但是特征衍射峰强度很弱,峰形不明显,同时没有TiO2锐钛矿晶型结构其他特征衍射峰,这是由于TiO2在SiO2@TiO2复合催化剂中含量较少而SiO2含量较多所致。Ag颗粒光沉积在SiO2@TiO2表面后,新的衍射峰在2θ=38°,44.1°,64.6°和77°出现,分别对应立方体晶型Ag的晶面结构(111), (200), (220) 和 (311)(PDF#65-2871)[23],此外,图4(d)~图4(g)不同Ag含量的SiO2@TiO2-Ag复合核壳结构光催化剂XRD结果表明随着Ag含量增加,Ag的特征衍射峰强度也增强,这和前面TEM表征结果一致。

图3 EDS谱图

图4 XRD谱图
3.3 X射线光电子能谱(XPS)分析
SiO2@TiO2-Ag复合核壳结构光催化剂样品组成和合成材料中Si、Ag和Ti的化学价态通过XPS能谱来研究, 如图5(a)所示,全谱图中可知SiO2@TiO2-Ag中含有Si、Ag和Ti元素,这说明Ag 负载在SiO2@TiO2表面。Si、Ag和Ti的结合能峰分别见图5(b)~图5(d),图5(b)表明Si 2p光电子峰在103.7eV处的结合能表明有Si-O-Si键合成。Ti 2p 的XPS谱图在464.7 eV和459.0 eV处的结合能(图5(c))分别对应Ti 2p 1/2和Ti 2p 3/2峰,这一结果证实了锐钛矿型TiO2的形成[24]。图5(d)中Ag 3d的结合能出现在368.1 eV和374.1 eV处,分别对应于Ag 3d 5/2和Ag 3d 3/2峰,同时,Ag 3d双峰分裂为6.0eV,这说明Ag以单质金属Ag的形式存在于复合光催化剂中,在合成过程中,Ag吸附在TiO2@SiO2表面, 当TiO2激发后电子从低能价带跃迁到高能导带, 吸附在TiO2@SiO2表面的Ag可以捕获电子,被还原后形成单质Ag负载在TiO2表面,因此金属银(Ag0)能够很好地同SiO2@TiO2复合形成复合光催化剂,从而降低了电子-空穴对的复合机率,提高复合材料的催化性能[25, 26]。
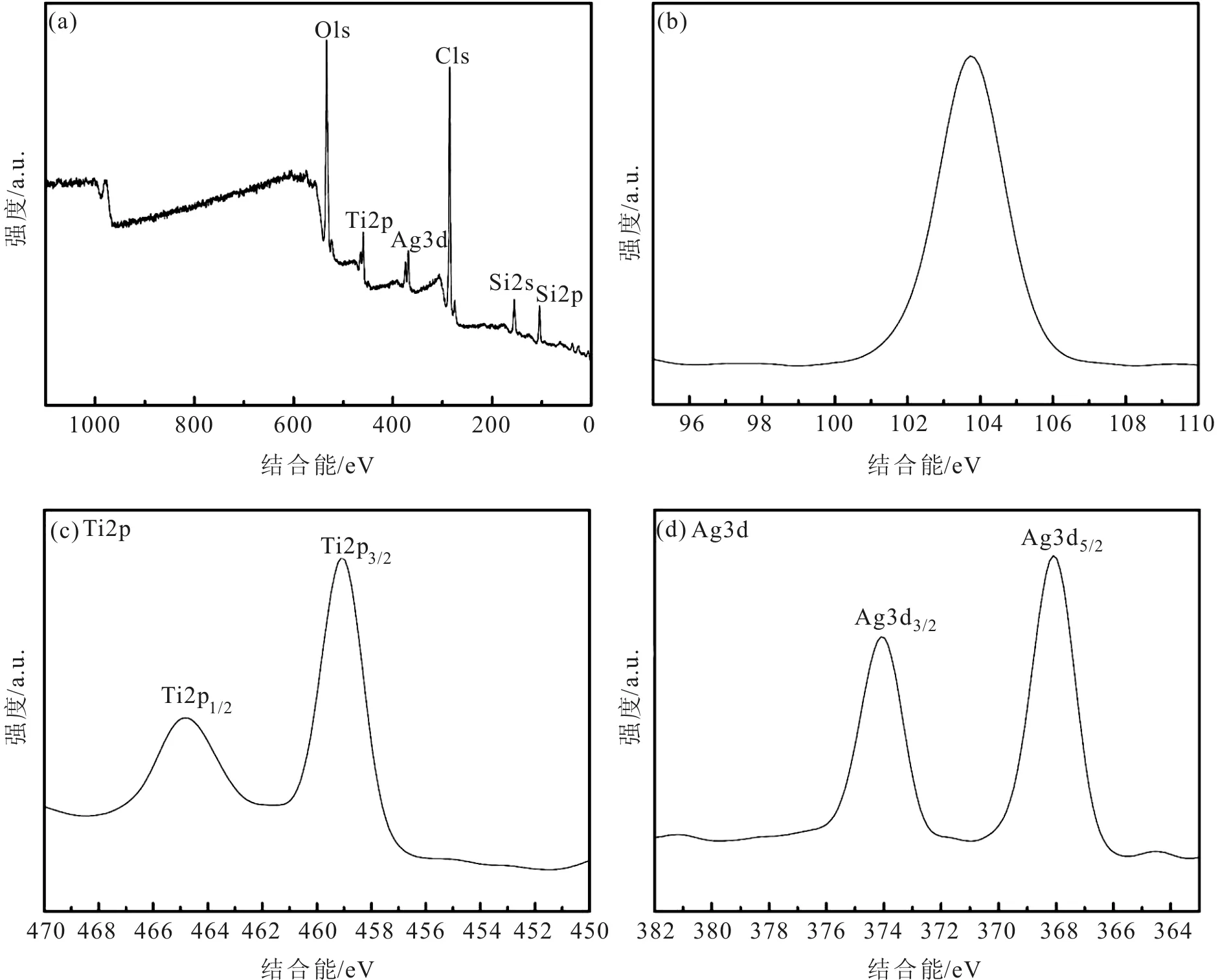
图5 6 wt% SiO2@TiO2-Ag XPS能谱图
3.4 傅立叶红外(FT-IR)分析
TiO2,SiO2,SiO2@TiO2核壳结构光催化剂及6 wt% SiO2@TiO2-Ag复合核壳结构光催化剂FT-IR见图6。如图6(a)所示,800 cm-1处的吸收峰属于Si-O-Si键对称拉伸振动引起[27];470 cm-1处的吸收峰为TiO2中Ti-O-Ti键振动引起的(图6(c));图6(c)~图6(d)中955 cm-1和1053 cm-1处峰为SiO2@TiO2和SiO2@TiO2-Ag中Ti-O-Si键不对称振动引起的[28]。
3.5 PPy/TiO2复合光催化剂光催化活性
图7为SiO2,SiO2@TiO2核壳结构光催化剂及SiO2@TiO2-Ag复合核壳结构光催化剂降解苯酚和亚甲基蓝的光催化活性。如图7(a)所示,暗反应阶段,所有光催化剂均对苯酚无吸附降解作用,光反应阶段催化降解苯酚时,120 min内SiO2降解效率仅为8.78%,这是由于SiO2本身无光催化活性,主要依靠SiO2吸附作用。结果显示不同Ag含量的SiO2@TiO2-Ag复合核壳结构光催化剂降解效率明显高于SiO2@TiO2核壳结构光催化剂,SiO2@TiO2核壳结构光催化剂光催化降解苯酚效率为69.2%,1 wt% SiO2@TiO2-Ag的光催化降解效率为75.6%,3 wt% SiO2@TiO2-Ag的光催化降解效率为87.6%,9 wt% SiO2@TiO2-Ag的光催化降解效率为86.2%,6 wt% SiO2@TiO2-Ag的光催化降解效率最高为92.9%。图7(b)为合成的光催化剂降解亚甲基蓝的光催化活性,暗反应阶段,不同光催化剂对亚甲基蓝均有一定的吸附作用,其中SiO2吸附效率为4.4%,SiO2@TiO2吸附效率为6.2%,1 wt% SiO2@TiO2-Ag、3 wt% SiO2@TiO2-Ag、6 wt% SiO2@TiO2-Ag及9 wt% SiO2@TiO2-Ag的吸附效率分别为7.3%、7.4%、8.5%及6.7%。光反应阶段光催化剂降解亚甲基蓝和降解苯酚的规律基本一致,120 min内SiO2吸附亚甲基蓝效率为26.5%,高于降解苯酚,这是因为SiO2具有一定的比表面积可以吸附有色染料。结果同时表明,不同Ag含量的SiO2@TiO2-Ag复合核壳结构光催化剂降解亚甲基蓝效率明显高于SiO2@TiO2核壳结构光催化剂,SiO2@TiO2核壳结构光催化剂光催化降解亚甲基蓝效率为65.0%,1 wt% SiO2@TiO2-Ag、3 wt% SiO2@TiO2-Ag、6 wt% SiO2@TiO2-Ag及9 wt% SiO2@TiO2-Ag的降解效率分别为73.2%、77.2%和69.7%,6 wt% SiO2@TiO2-Ag的光催化降解亚甲基蓝效率最高为83.5%。
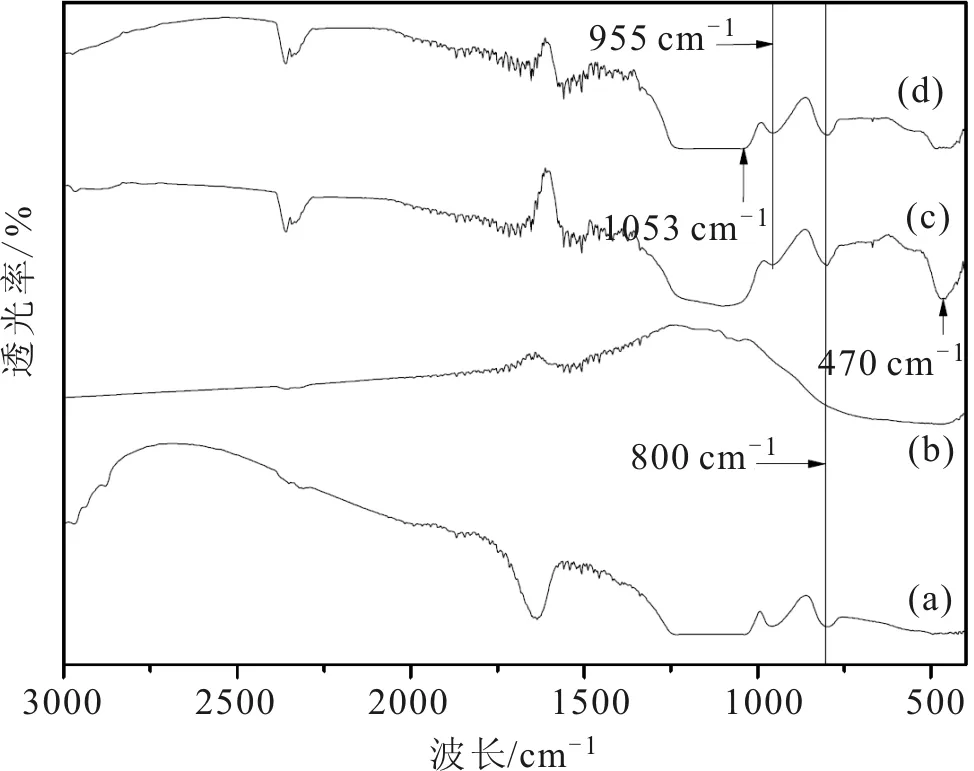
图6 FT-IR谱图

图7 光催化降解
3.6 光催化机理
在SiO2@TiO2-Ag光催化系统中,SiO2作为吸附剂,TiO2作为光活性中心,Ag作为电子俘获剂参与光催化反应,TiO2在紫外光激发下,其价带上的电子激发到导带上,产生了光生电子,因为金属Ag具有较低的费米能级,TiO2导带上的电子会转移至在金属Ag表面并积累,同复合光催化剂表面的O2反应形成超氧自由基,同时价带上的空穴与吸附的水反应生成羟基自由基,超氧自由基和羟基自由基同吸附在光催化剂表面的底物进行反应,从而达到光催化降解的目的。最佳负载量的Ag离子可以作为电子空穴分离中心促进光催化剂表面载流子输运, 降低光生电子和与空穴复合机率, 增强复合光催化剂的量子效率, 从而提高光催化活性[29]。但是当负载量超过最佳值时Ag离子会包覆在TiO2表面从而使TiO2同底物光催化反应能力降低,同时过多的Ag离子会作为电子-空穴复合中心,会增大光生电子和与空穴复合机率,降低羟基自由基的浓度,反而对光催化活性不利[30~32]。
4 结论
利用光沉积法合成了SiO2@TiO2-Ag复合核壳结构光催化剂,化学沉淀法合成了SiO2@Ag-TiO2复合结构光催化剂,通过SEM、TEM、EDS、XRD等手段对复合光催化剂进行了研究,在紫外光照射下以苯酚及亚甲基蓝为底物对复合光催化剂的光催化活性进行了降解实验。结果表明贵金属Ag负载在SiO2@TiO2核壳结构光催化剂后,SiO2@TiO2核壳结构光催化剂在形貌上仍为核壳球形结构,光催化活性同SiO2@TiO2核壳结构光催化剂比较有了明显提高,6 wt% SiO2@TiO2-Ag的光催化降解苯酚效率最高为92.9%,光催化降解亚甲基蓝效率最高为83.5%。
