生物多样性与人居健康交互关系综述
2021-11-13廖菊阳裴男才刘艳祁承经张娟李巧云王玲
廖菊阳裴男才刘艳祁承经张娟李巧云王玲
生物多样性与人居健康交互关系综述
廖菊阳1, 3, 5, 裴男才2, 刘艳3, 5, 祁承经4,*, 张娟3, 5, 李巧云3, 5, 王玲3, 5
1. 北京林业大学, 北京 100083 2. 中国林业科学研究院热带林业研究所, 广州 510520 3. 湖南省植物园, 长沙 410116 4. 中南林业科技大学, 长沙 410004 5. 湖南长株潭城市群森林生态系统国家定位观测研究站, 长沙 410116
生物多样性对维持生态系统服务功能及维护人类健康产生积极的作用, 保持生物多样性对减少社会经济损失、维护人类健康具有重要的意义。本章论述了生物多样性增加或丧失对传染病发生和传播的影响、传染病特点及其危害。重点对驱动生物多样性变化及传染病加剧的原因进行分析, 探究了土地利用变化、饲养业发展、野生动物贸易、外来入侵种、社会生态背景对传染病传播的影响。针对上述问题提出对策和措施, 为进一步加强和应对传染病, 营造人居健康环境提供了科学的基础依据。
生物多样性; 疾病; 土地利用变化; 野生动物贸易; 外来物种
0 前言
2010年6月, 政府间生物多样性和生态系统服务科学政策平台(IPBES)参照政府间气候变化专门委员会(IPCC)成立, 旨在评估地球生物多样性的变化如何蒂造人类福祉, 而人类福祉首先是维护自身健康无病。地球上三分之二的遗传多样性都存在于单细胞生物中, 微生物多样性是广阔而神秘的世界, 虽肉眼不可见, 但内在的潜力无穷。人体中约90%的细胞是微生物。传染病的病原体大多归于细菌和病毒, 如2019年底至今在全球范围内传播的新型冠状病毒肺炎(COVID-19), 以及历史上人类社会曾出现过多次重大疫情, 如霍乱、天花、鼠疫。人类与细菌之间相互作用相互联系一直被人类高度关注, 自然界生物多样性与人居健康交互关系也日趋成为公众关注和研究的热点。
生物多样性在人类健康方面具有重要意义, 包括为人类提供一定的医药资源、通过生态系统服务维持生物圈生态平衡来维护人类健康等。目前对于生物多样性对传染疾病的影响研究较少, 因此本综述主要对生物多样性变化对传染病出现和传播影响进行评述, 着重论述新发传染病、人畜共患病等疾病对自然生境和生物多样性的急剧丧失的响应。此外还分析了土地利用变化、饲养业发展、野生动物贸易、外来入侵种、社会生态背景下对新传染病传播的影响。最后, 进一步针对传染病传播存在的问题, 提出未来研究展望, 为今后预警、预告传染病的发生提供重要的科学理论依据和参考。
1 疾病发生和传播概述
传染病对人类健康和生物多样性都具有重要影响, 其病原体携带的细菌或病毒对人类造成重大伤害, 但也对某些物种及其生态系统功能的生物多样性有所增益。微生物的多样性和其它生物的相互作用可能是相克相成的, 同一种微生物对某些寄主可能是具有致病性, 但对其他寄主可能是有益的。例如植物物种和微生物之间有着良好的相互依赖关系; 共生生物在对抗病原体方面发挥着重要作用, 共生生物和生物多样性的目标不一致时可进行调协。至于人为造成的全球变化, 如森林砍伐、采矿的采掘业、偷猎、入侵物种的引进和城市发展应都属于生物多样性丧失和传染病发生的驱动因素, 这也是导致传染病发生的重要因素, 应引起警惕和重视。
随着疾病在全球范围迅速传播, 人为活动使得患病的风险增加, 导致经济负担空前增长, 如2003年的非典肺炎(SARS)造成人身直接医疗缺失达300—500亿美元, 1998年的尼帕病毒超过5亿美元。此外, 埃博拉疫情始于2013年12月, 但直到2014年3月才被卫生当局发现。据估计, 在哺乳动物中检测85%的病毒多样性的花费为14亿美元, 或10年以上每年1.4亿美元。在过去的20年里, 仅仅是在人类身上新出现的疾病的花费就已经达到了数千亿美元, 中等发达地区财政开支已捉襟见肘。
1.1 生物多样性变化影响传染病的消长
1.1.1 生物多样性增加导致传染病减少
生物多样性增加, 包括功能多样性、遗传多样性和群落丰富性的增加, 能有效改善病原体的传播, 并为传染病调控提供一种新颖的低成本途径。Raymundo等证明了珊瑚的营养功能多样性和疾病之间的联系。一项对菲律宾中部14个岛礁调查显示, 礁鱼的分类学多样性越丰富则珊瑚疾病的流行度越低。同样, Johnson等证明, 随着两栖类物种丰富度的增加, 有毒两栖类病原体寄生虫()的传播减少了约50%。
生物体中充满了微生物, 微生物群落组成的变化常与感染疾病有关。Chang等的研究发现反复感染难辨梭菌()的患者, 研究表明, 增加微生物多样性可以预防感染。此外有研究表明小麦根系周围的微生物群越多样化, 对抗病原菌铜绿杆菌()的侵袭能力越强。Laporta等基于一项模型研究提出, 温血哺乳动物数量增多, 热带森林中疟疾的发生率可能减少。生态系统中大型食草动物多样性的丧失可能会导致巴尔通氏杆菌() 传播风险增高, 这种效应是由于啮齿类动物数量的增加导致跳蚤载体携带的巴尔通氏杆菌感染增加。Derne等研究了以鼠作为潜在寄主的19个岛屿国家后指出, 随着陆地哺乳动物物种丰富度的增加, 钩端螺旋体病发病率下降。
生物多样性变化影响传染病的消长, 主要是通过改变寄主和载体的组成和丰度, 从而影响寄生虫或病原体的行为, 并影响疾病的传播。主要可能由于: (1) 寄主多样性增加, 某些病原体传播率会下降。(2) 捕食者消失, 导致草食寄主或载菌体的数量增加, 即病原体增加和传播的风险增加。
1.1.2 生物多样性丧失致使病原体传播增加
生物多样性的丧失会增加病原体的传播和疾病的发病率, 这种模式在不同类型的病原体、寄主的生态系统和传播模式中均被发现(表1)。3项研究发现, 在美国鸟类多样性减低与人类患西尼罗脑炎的风险或发病率的增加有很强的相关性。鸟类多样性低的群落往往被强能力病毒寄主物种所主导, 从而导致蚊子和人的感染率升高, 而鸟类多样性高的群落则包含许多弱能力寄主物种(稀释效应), 其感染率减少。生物多样性对植物病害也有类似的影响, 物种减少会增加多年生黑麦草感染和其他植物物种的两种真菌锈病病原体的传播。
多样性丧失导致病原体传播增加, 理论上寄主数量的减少会降低载体的感染率, 如果在变化过程中消失的物种是强传播能力寄主, 而其他条件保持不变, 那么疾病传播就会减少。反之, 如果消失的物种是弱传播能力寄主, 那么疾病传播就会增加。
尽管有上述例子, 但Keesing等仍认为, 关于生物多样性是否能增加或减少人类感染疾病的风险问题, 难以给予简单明确的答案, 因为多样性与疾病风险成反比关系的稀释效应确实存在, 但个别情况之间存在很大的差异。与上述例证相反, Salkeld等在对16种生物多样性与疾病关系分析中, 结果表明几乎没有证据支持生物多样性可降低人畜共患病风险的普遍结论, 结论认为特定的疾病动态与特定的地理环境和特定的生态因素相关联, 因生态系统关系、因时因地而异。
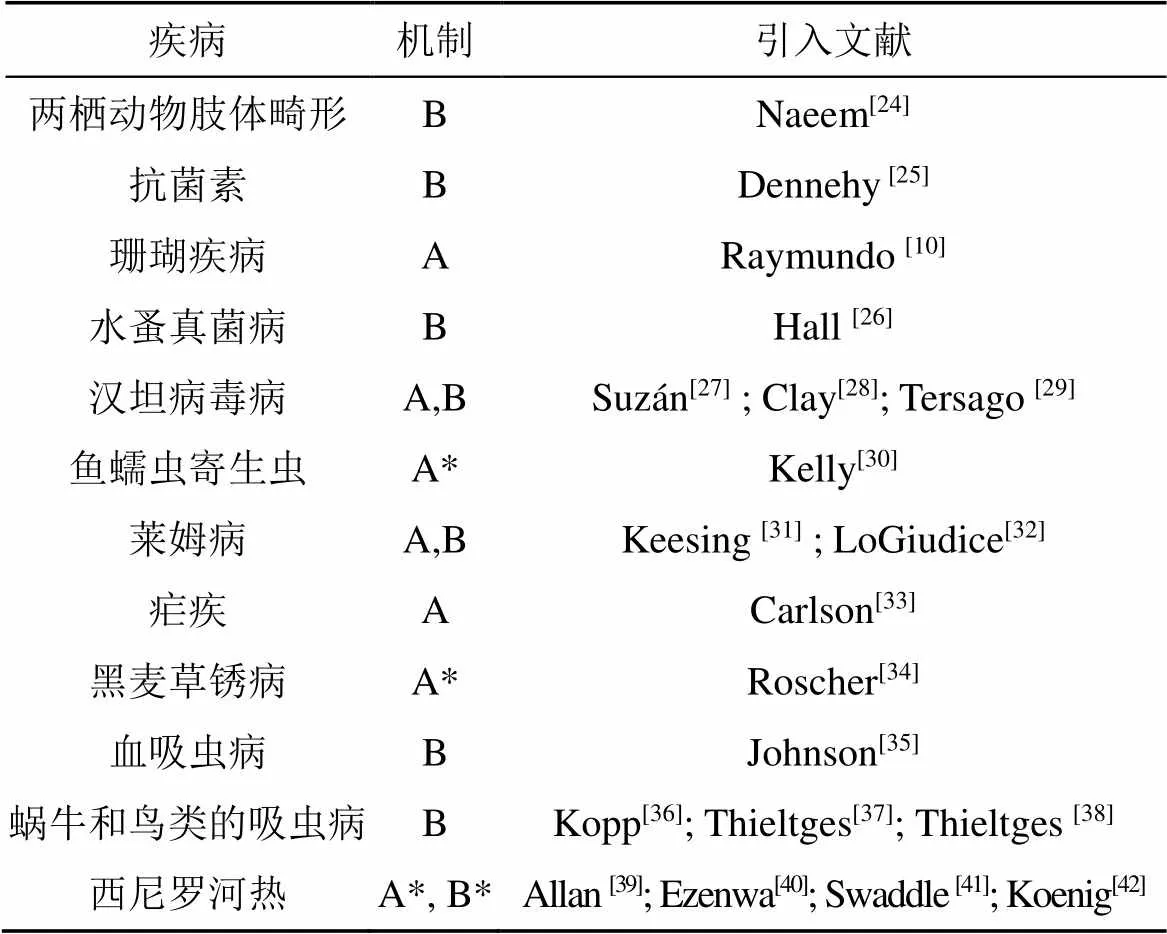
表1 生物多样性丧失增加的疾病传播
注: A=寄主/载体的丰度; B=寄主/载体/寄生虫习性。星号表示作者所设的一种机制)。
1.2 新发传染病、人畜共患病及抗生素
1.2.1 新发传染病、人畜共患病
新发传染病()事件正在增多, 不仅影响到人类, 而且涉及其它生命体及其生态系统功能。据统计, 1940—2004年共发生335起新兴传染病事件, 且随着时间的推移显著增加。在1980年为发病高峰率期且与艾滋病毒大流行同时出现。主要特征为人畜共患病(占EID的60.3 %), 其中大多数(71.8 %)起源于野生动物, 如严重急性呼吸道病毒、埃博拉病毒等。Jones等人指出, 54.3 %的EID事件是由细菌或立克次体()引起, 这反映了大量耐药微生物的出现。新发传染病可分别出现在野生动物、家养动物、农作物和野生植物中, 新出现病原体可在同一寄主种内进化成传染病的新毒株。对于已经在生态群落中建立的病原体, 生物多样性的丧失常常会增加它们的传播速度。在新物种中建立的病原体, 其出现过程包括多个步骤, 首先是入侵新寄主, 进而在新寄主内进行传播阶段即在新寄主种群中建立整体病原体。新发生病大多数是人畜共患病, 从其他脊椎动物传染给人类。Jone等人还指出, 从野生动物溢出到人类的可能性与野生哺乳动物物种多样性呈正相关。一旦病原体扩散到新的寄主, 该寄主物种的个体丰度可能会加速病原体在新寄主内的建立和传播。
人畜共患病的寄主可能以其他方式加速传播, 如2009年新甲型H1N1流感病毒中加入了3种不熟悉的流感病毒株, 导致全球范围内约28万人死亡, 1/5的人患病。这种病毒突变体来自两大洲的猪流感基因, 以及来自人类和禽流感病毒株的基因。流感病毒株之间的基因片段交换重组可能产生大流行性流感病毒株。部分证据表明, 人类活动促使流感生态系统的物种种群间发生基因交流, 从而加剧了流感病毒的猖獗传播。一个世纪以来, 产业化家畜群居饲养(圈养)加剧了传染病的传播。以猪为例, 自1950年以来, 猪场集体饲养变得越来越普遍, 进而促进了流感病毒之间的基因重组。近几十年来, 世界各地的养猪业发展迅速, 1992年, 美国24万个养猪场平均每个养猪场饲养945头猪。到2004年, 养猪场的数量下降到约7万个, 平均每个农场饲养的生猪数量达到原来的5倍, 每个农场饲养4646头猪。随着猪数量的增多且基因相同时, 可能会增加被流感病毒感染的可能性。
有证据表明, 生物多样性下降或灭绝正一直推动病原体外溢和新发传染病的增加, 因此, 已有专家开始着眼研究此类事件可能发生的发源地。人畜共患病病原体最常见于热带地区, 其分布主要局限于其动物寄主范围, 其发病原因可能与贸易路线和旅游枢纽有关。由美国国际开发署(US Agency for International Development)资助的“新兴传染病威胁计划”(Emerging epidemic threat program)是一项有希望的新举措, 目标是预防人畜共患疾病的出现。到目前为止, 已经从20个发展中国家的2万只动物身上获得了20多万份样本, 并从已知致病的病毒家族中鉴定出150种新病毒。目前正在分析从这项研究中获得的数据, 以进一步阐明疾病最可能发生的情况, 以便采取预防措施。
1.2.2 抗生素助长疾病流行
使用抗生素是通过牺牲大量弱耐药力菌株, 来选择出耐药菌株。在大量使用抗生素的压力下, 某些病原体细菌进化出耐药性菌株。1940-2004年间20 %的突发事件是通过耐药性的演变而出现的。例如, 通过耐药性的进化, 耐甲氧西林金黄色葡萄球菌()可转移到新的寄主物种; 抗生素对人类免疫缺陷病毒或艾滋病毒、严重急性呼吸综合征(severe acute respiratory syndrome)或非典肺炎及新型冠状病毒肺炎均束手无策。在某些情况下, 中东和南欧的西尼罗病毒伴随着地理范围的扩张, 向新寄主物种的转移, 发展为美洲的西尼罗病毒。
Keesing提出, 生物多样性的丧失有利于疾病的传播, 外溢效应也有助于耐抗生素病原体的传播。病原体从动物转移到人类, 通常被称为病原体溢出, 在近几十年变得越来越普遍。它们作为饲养的成员接受抗生素, 又分别通过鸡和猪传染给人类。在美国, 估计每年有80 %的抗生素用于牲畜, 其余的大部分用于人类。大多数抗生素耐药性来自于人类对抗生素的使用, 而且细菌和其他病原体中的抗生素耐药性在全球每年的伤残校正生命年(Disability Adjusted of Life Years, DALYs)总量中占有很大比重。例如, 在抗生素压力下肺炎链球菌()和流感嗜血杆菌()中的抗生素耐药力, 还有结核杆菌()的耐药力都有所增加,这是导致下呼吸道感染最常见的原因。在1200万新病例的肺结核中, 每年大约4 %属多耐药性(multidrug resistant, MDR)。对于那些感染了肺结核并且曾经接受过治疗的人, MDR上升到20 %。因此, 抗生素滥用会导致病毒的广范围的扩散与传播。
2 生物多样性变化及传染病影响因素分析
2.1 土地利用变化对传染病影响
土地利用变化对传染病影响显著。在过去半个世纪, 地球上多种自然生态系统的人为转化大大增加。目前, 土地利用正在发生重大变化, 主要发生热带发展中国家的毁林垦殖中。据估计, 2000—2012年, 热带地区每年的森林损失平均为2101 km2·a-1, 且在全球范围继续增加。土地利用变化包括农业发展、城市化、森林砍伐、森林和生境破碎化, 已被确定为人类新发传染病的主要驱动因素。
如此同时, 大面积热带森林或种植园被开发为采矿、石油和天然气等工业用地, 加剧了传染病的影响, 且与马尔堡病毒()、恰加斯病()、黄热病、利什曼病()和其他疾病的暴发有关。这些新建居民区不断向偏远地区延伸, 由于缺乏家畜食品供应, 导致了狩猎、野生动物消费和野生动物贸易的增加。此外, 新居民区的低质量基础设施造成了居住过度拥挤、卫生条件差、废物处理不当和缺乏饮用水等后果。所有这些变化都会增加病原体跨物种传播的风险, 从而导致人畜共患病。此外, 新居民可能对该地区特有的人畜共患病缺乏免疫力, 更易受到感染。
2.2 饲养业发展与疾病蔓延
饲养业发展与疾病蔓延存在一定的关联。为满足全球人口日益增长的对蛋白质的需求, 肉禽饲养业发展越来越迅速, 牲畜放牧和饲料作物种植约占土地面积的30 %, 这也就增加了家畜、野生动物和人类之间和病原体接触传播的机会, 由此产生的传染病具有与生物多样性动态相关的风险, 特别是靠近森林或湿地的新建放牧地风险更大。此外, 畜牧业生产的集约化, 通常涉及高动物密度、狭窄饲养区和抗菌药物的使用, 可能使病原体快速传播和进化。野生动物可能是家畜饲养业中重要疾病的库存或寄主, 包括世界动物卫生组织(OIE)列出的大多数疾病, 如口蹄疫和牛结核病的病原体。除了牲畜死亡对生计和粮食安全造成的威胁外, 人类健康也受到了影响。并且, 家畜可作为人畜共患病从野生动物传播给人类的中间寄主, 在某些情况下可起到放大作用。例如, 果蝠是尼帕病毒的天然寄主, 马来西亚将森林改造成集约养猪设施, 在果蝠与猪接触后, 从猪传播给人类, 在人类中出现了尼帕病毒。
2.3 野生动物贸易和疾病传播
野生动物贸易涉及全球数亿动植物种群的地理迁移, 包括合法和非法贸易产品, 估计每年经济价值超过3000亿美元。这些产品包括传统药物、野味、战利品、异国宠物和食品。在每一大类中都存在着各种各样的专业市场价值链。野生动物贸易违反《濒危动植物种国际贸易公约》(CITES)即属非法, 尽管有这些保护措施, 但因非法野生动物贸易而导致的目标物种的平均种群数量仍然下降了60 %至70 %。另一个令人担忧的事实是, 只有被列入濒危野生动植物种名录的物种才会被监管, 而未被列入濒危野生动植物种名录的动物的交易产生的生态后果基本上没有被评估。同样, 一些重大的人畜共患病的出现, 如艾滋病病毒HIV(通过丛林狩猎灵长类动物)、猴天花病毒(外来宠物贸易)以及禽流感病毒(H5N1,H7N9)等, 均出在野生动物贸易链上, 非典肺炎、新型冠状病毒肺炎也被高度怀疑在人类与动物的接触过程中, 从捕获到市场(餐桌)或养育, 人类与动物之间发生了大量接触。全球野生动物贸易提供的疾病传播机制不仅对人类和动物健康造成威胁, 而且对国际贸易、居民生计和全球粮食安全造成巨大损害。
2.4 外来入侵种带来严重的疾病传染
外来入侵种是通过人类活动引入的某种生物类群进入它未曾分布的新领域, 并对当地的生物多样性或生态系统的完整性构成威胁。140个连接全球优先项目(Connecting Global Priorities) 有关的案例表明, 随着全球化的贸易和旅行活动, 生物多样性和人类健康问题日益显现, 威胁到健康、基础设施、经济活动、粮食供应和生态系统服务。
入侵物种是已知传染病加剧和生态系统变化的驱动因素。貉和红狐正成为狂犬病的新库存, 因为它们从皮毛贸易中的意外释放的动物中扩散到东欧新的栖息地。马樱丹()入侵东非为采采蝇()提供了庇护所, 提高了昏睡病的发生率。斑马贻贝()入侵北美五大湖, 促使有毒的蓝藻细菌的大量繁殖, 如铜绿微囊藻()导致微囊藻素()的积累。从而导致了微囊藻毒素、肝毒素和可能的肿瘤促进剂在鱼类可食用组织中积累, 并沿着食物链向最终消费者转移和放大。并且, 一些报告将伊利湖E型肉毒杆菌病的兴起归因于斑马贻贝的生态影响, 斑马贻贝和霍乱都是通过船舶排放的压载水传播的。1991年, 秘鲁有1万多人死于霍乱, 在北美港口的南美压载舱中也发现了霍乱。
人类食用植物与观赏植物均可能与疾病的传播有关。水葫芦是一种南美淡水观赏植物, 如双脐螺属(和), 目前已被引进世界各地, 尤其在撒哈拉以南的非洲地区, 它是蚊子和蜗牛的寄主, 而蚊子和蜗牛反过来又是疟疾和血吸虫病的传播载体。对植物中的新传染病(EIDs)的分析表明, 马铃薯枯萎病和澳大利亚香蕉病的引入导致人类疾病的传染。在过去的几十年里, 全球大部分的植物类植物病原都来自于以前未知的病原体。
外来物种入侵带来的生态、经济和对生命健康的损失较大。例如, 美国因引入5万多种入侵物种每年损失约1200亿美元。外来入侵物种除了对环境造成直接影响之外, 同时, 这些寄主传播的病原体对环境也造成污染, 如授粉蜜蜂的瓦螨()、小龙虾瘟疫()等。随着气候变化的推进, 大多数案例表明, 与IAS相关的传染病将进一步激增。Perkins认为带有寄生虫的入侵寄主的引入是全球疾病出现的最重要驱动因素。
2.5 社会生态背景驱使传染病加剧
随着全球变化加剧, 生态因素越来越多地与社会经济动态相互作用, 并且影响着疾病的传播。随着全球人口的增长, 到2030年预计将有超过50亿人生活在城市地区, 城市用地将在2000年的基础上增加两倍, 这将带来日益增长的资源需求。全球有大量人口(大于等于8亿人)居住在城市贫民窟, 获得可持续资源和卫生设施的机遇将日益窘迫。地方性传染病每年造成10亿多人患病, 每年导致数百万人死亡。已知的人类传染性病原体中有三分之二来自动物, 其中大多数出自新近出现的病原体。这种从其他物种向人类的传播的病原体, 其生态学和进化潜势, 即微生物进化生态位的开发, 将随着人类与环境的互动将呈现新局面, 人类应对新局面的压力将与日俱增。
在人口密集的城市环境中传染病表现出较大的传播潜力, 造成巨大的经济损失。例如, 2003年非典肺炎的爆发估计给全球经济造成的损失超过300亿美元。每年为治疗有蹄动物作为中间寄主传播的疾病如治疗犬绦虫()传播的棘球蚴()花费的费用超过40亿美元, 而预测病媒传播和寄生虫病治疗的费用将随着生物多样性下降而增加, 沉重的财政开支使某些地区已陷入贫病交加的恶性循环之中。
3 挑战与对策
综上所述, 传染病不仅危害人类健康, 而且造成巨大的经济损失。在过去的20年里, 仅仅是新出现的疾病在人类身上的花费就已达数千亿美元。而精神上的上的压力更加巨大, 传染病危机来自四面八方, 一条线来自自然: 动物, 植物, 细菌, 气候变化, 土地利用变化, 外来物种入侵, 生物多样性丧失等; 另一条线来自社会: 人口增长, 人口流动, 城市扩张, 居住拥挤, 人与家畜、野生动物接触频繁等。一旦传染病爆发如祸从天降, 不知所措。如2003年非典肺炎和2019新型冠状病毒肺炎袭击时, 中国城市空空, 人心惶恐, 如大敌当前。今后对待传染病主要是对疫情能预警预报, 使之防范有序, 应对有策, 列举如下:
(1)避免高密度单一栽培或饲养业和人类活动定居毗邻高生物多样性系统, 特别是城市中心、工矿区和密集饲养系统。超大城市规划对于公共卫生预防应加大投资, 加强生物多样性与人居健康交互关系的探索与研究。
(2)对现代的传染病防疫系统需要进行系统调整, 在上述自然和社会两条线交织网中找到关键点, 提出具体解决措施及执行方案。同时要重视生物安全, 更谨慎使用抗生药, 以减轻抗性品系演化的压力。
(3)重视艾滋病病毒(HIV病毒)传播的教训, 严密监视与非人类灵长类动物的接触或杀食。对病原体之间的关系、它们所接触的许多生命体以及它们发生的地方进行细致的探索, 加强监测, 以便早期发现并杜绝疾病溢出事件。
(4)人畜共患疾病是在动物和人类之间传播的传染病, 保持生物多样性, 能有助于人类免受或者减少大流行病的侵袭。在某种程度上, 宿主物种的多样性越丰富, 越可以降低大传染病的风险, 反之, 则疾病传播的风险则增加。发展和支持将监测野生动物病原体纳入卫生、林业和物种保育方面的国家监测方案。重视防止野生动物贸易交易和严格遵守疾病控制条例, 保护自然及其生物多样性日趋重要。
(5)更积极主动进行综合的风险评估和分析, 既要考虑到自然生态可能发生的变化, 也要考虑到城市社会生态的变化, 密切关注以下两方面的分析: (i)参与国际间评估风险系统协同合作, 如《世界动物卫生组织评估外来动物入侵风险指南》和《世界动物卫生组织-世界自然保护联盟疾病风险分析指南》中提出的方法, 可以提供风险的定性和定量措施。(ii)利用国家已建立的监测和风险预测系统参与风险分析。例如, 在巴西, Oswaldo Cruz基金会的野生动物信息系统旨在利用数学模型, 在社会和移动技术专家的参与下, 对可能涉及人类的野生动物中发生的病原体发出警报。此外, 美国国际开发署(USAID)的新兴大流行威胁预测PREDICT计划, 已对20个易发生疾病的热点国家开展了野生动物病原体监测。优化现有监测预测网络, 从而全面提升人类监测与预测重大传染病风险的能力和效率。
[1] 兰存子, 田瑜, 徐靖, 等.生物多样性和生态系统服务政府间科学–政策平台的概念框架和运作模式[J].生物多样性, 2015, 23(05): 681–688.
[2] IUCN, Numbers of threatened species by major groups of organisms (1996–2012)[z]. IUCN Red List v, 2012: 2.
[3] 陈莹, 郭怡博, 郭然, 等. 基于文献计量学的新型冠状病毒肺炎(COVID-19)研究可视化分析[J]. 中国中药杂志, 2020, 45(10) : 2239–2248.
[4] KARESH W B, FORMENTY P. Infectious diseases[C]. Conneting Global Priorities: Biodiversity and Human Health A State of Knowledge Review, World Health Organization and Secretariat of the Convention on Biological Diversity. 2015: 130–140.
[5] BANK W. People, Pathogens, and Our Planet : Volume One - Towards a One Health Approach for Controlling Zoonotic Diseases[J]. World Bank Other Operational Studies, 2010.
[6] BAIZE S, PANNETIER D, OESTEREITH L, RIEGER T, KOIVOGUI L, MAGASSOUBA N F, GUNTHER S. Emergence of Zaire Ebola virus disease in Guinea– preliminary report[J]. New England Journal of Medicine, 2014.
[7] ANTHONY S J, EPSTEIN T H, MURRAY K A, et al. A Strategy to Estimate Unknown Viral Diversity in Mammals[J]. mBio, 2013, 4(5).
[8] KARESH W B, DOBSON A, LLOYD-SMITH J O, et al. Ecology of zoonoses: natural and unnatural histories[J]. The Lancet, 2012, 380(9857): 1936–1945.
[9] RAYMUNDO L J, HALFORD A R, MAYPA A P, et al. Functionally diverse reef-fish communities ameliorate coral disease[J]. Proceedings of the National Academy of Sciences, 2009, 106(40): 17067–17070.
[10] JOHNNSON P T J, PRESTON D L, HOVERMAN J T, et al. Host and parasite diversity jointly control disease risk in complex communities[J]. Proceedings of the National Academy of Sciences, 2013, 110(42): 16916–16921.
[11] CHANG J Y, ANTONOPOULOS D A, KALRA A, et al. Decreased diversit of the fecal microbiome in recurrent Clostridium difficile-associated diarrhea[J]. Journal Infectious Disease, 2008, 197: 435–438.
[12] MATOS A, KERKHOF L, GARLAND J. Effects of microbial community diversity on the survival of Pseudomonas aeruginosa in the wheat rhizosphere[J]. Microb Ecol, 2005, 49: 257–264.
[13] LAPORTA G Z. Biodiversity can help prevent malaria outbreaks in tropical forests[J]. Plos Neglected Tropical Diseases, 2013, 7 (3): e2139.
[14] YOUNG H S, DIRZO R, HELGEN K M, et al. Declines in large wildlife increase landscape-level prevalence of rodent-borne disease in Africa[J]. Proceedings of the National Academy of Sciences, 2014, 111(19): 7036–7041.
[15] Derne B T, Fearnley E J, Lau C L, et al. Biodiversity and leptospirosis risk: A case of pathogen regulation?[J]. Medical Hypotheses, 2011, 77(3):339-344.
[16] KESSING F, BELDEN L K, DASZAK P, et al. Impacts of biodiversity on the emergence and transmission of infectious diseases[J]. NATURE, 2010, 468(7324): 647– 652.
[17] PONGSIRI M J, ROMAN J, EZENWA V O, et al. Biodiversity Loss Affects Global Disease Ecology [J]. Bioscience, 2009, 59 (11): 945–954.
[18] PONGSIRI M J, ROMAN J. Examining the links between biodiversity and human health: an interdisciplinary research initiative at the US Environmental Protection Agency [J]. Ecohealth, 2007, 4 (1): 82–85.
[19] ALLAN B F, LANGERHANS R B, RYBERG W A, et al. Ecological correlates of risk and incidence of West Nile virus in the United States[J]. Oecologia, 2009, 158(4): 699–708.
[20] EZENWA V O, GODSEY M S, KING R J, et al. Avian diversity and West Nile virus: testing associations between biodiversity and infectious disease risk[J]. Proceedings Royal Society, London: 2006, 273: 109–117.
[21] SWADDLE J P, CALOS S E, ANGUS B. Increased Avian Diversity Is Associated with Lower Incidence of Human West Nile Infection: Observation of the Dilution Effect[J]. PLoS ONE, 2008, 3(6): e2488.
[22] ROSCHER C, SCHUMACHER J, FOITZIK O, et al. Resistance to rust fungi inLolium perennedepends on within-species variation and performance of the host species in grasslands of different plant diversity[J]. Oecologia, Berlin: 2007, 153(1): 173–183.
[23] NAEEM S, BUNKER D, HECTOR A, et al, PERRINGS C. Biodiversity, Ecosystem Functioning, and Human Wellbeing: an Ecological and Economic Perspective[M]. England: Oxford University Press, 2009.
[24] DENNEHY J J, FRIEDENBERG N A, YANG Y W, et al. Virus population extinction via ecological traps[J]. Ecology Letters, 2007, 10(3): 230–240.
[25] HALL S R, BECKER C R, SIMONIS J L et al. Friendly Competition: Evidence for a Dilution Effect among Competitors in a Planktonic Host-Parasite System[J]. Ecology, 2009, 90(3): 791–801.
[26] SUZAN G, MARCE E, GIERMAKO WSKI J T, et al. Experimental evidence for reduced mammalian diversity causinincreased hantavirus prevalence[J]. PLoS ONE, 2009, 4(5): e5461.
[27] Clay C A, Lehmer E M, Jeor S S, et al. Sin nombre virus and rodent species diversity: a test of the dilution and amplification hypotheses[J]. PLoS ONE, 2009, 4(7):e6467.
[28] TERSAGO K, SCHREURS A, LINARD C, et al. Population, environmental, and community effects on local bank vole (Myodes glareolus) Puumala virus infection in an area with low human incidence[J]. Vector-Borne Zoonotic Diseases, 2008, 8: 235–244.
[29] KELLY D W, PATERSON R A, TOWNSEND C R, et al. Has the introduction of brown trout altered disease patterns in native New Zealand fish?[J]. Freshwater Biology, 2009, 54(9): 1805–1818.
[30] KEESING F, BRUNNER J, DUERR S, et al. Hosts as ecological traps for the vector of Lyme disease[J]. Proceedings of the Royal Society B: Biological Sciences, 2009, 276(1675): 3911–3919.
[31] LOGIUDICE K, DUERR S T K, NEWHOUSE M J, et al. Impact of host community composition on Lyme disease risk[J]. Ecology, 2008, 89(10): 2841–2849.
[32] CARLSON J C, DYER L A, OMLIN F X, et al. Diversity Cascades and Malaria Vectors[J]. Journal of Medical Entomology, 2009, 46(3): 460–464.
[33] ROSCHER C, SCHUMACHER J, FOITZIK O, et al. Resistance to rust fungi inLolium perennedepends on within- species variation and performance of the host species in grasslands of different plant diversity[J]. Oecologia, Berlin: 2007, 153(1): 173–183.
[34] JOHNSON P T J, LUND P J, HARTSON R B, et al. Community diversity reduces Schistosoma mansoni transmission, host pathology and human infection risk[J]. Proceedings of the Royal Society B: Biological Sciences, 2009, 276(1662): 1657–1663.
[35] KOPP K, JOKELA J. Resistant invaders can convey benefits to native species[J]. NATURE, 2010, 468(7324): 647–652.
[36] THIELTGES D W, REISE K, PRINZ K, et al. Invaders interfere with native parasite-host interactions[J]. Biological Invasions, 2009, 11(6): 1421–1429.
[37] THIELTGES D W, BORDALO M D, CABALLERO- HERNANDEZ A, et al. Ambient fauna impairs parasite transmission in a marine parasite-host system[J]. Parasitology, 2008, 135(9): 1111–1116.
[38] ALLAN B F, LANGERHANS R B, RYBERG W A, et al. Ecological correlates of risk and incidence of West Nile virus in the United States[J]. Oecologia, 2009, 158(4): 699–708.
[39] EZENWA V O, GODSEY M S, KING R J, et al. Avian diversity and West Nile virus: testing associations between biodiversity and infectious disease risk[J]. Proceedings. Royal Society, London, 2006, 273(1582): 109–117.
[40] SWADDL J P, CALOS S E, ANGUS B. Increased Avian Diversity Is Associated with Lower Incidence of Human West Nile Infection: Observation of the Dilution Effect[J]. PLoS ONE, 2008, 3(6): e2488.
[41] KOENIG W D, HOCHACHKA W M, ZUCKERBERG B, et al. Ecological determinants of American crow mortality due to West Nile virus during its North American sweep[J]. Oecologia, 2010, 163(4): 903–909.
[42] KEESING F, HOLT RD, OSTFELD RS. Effects of species diversity on disease risk[J]. Ecology Letter, 2006, 9: 485–498.
[43] SALKELD D J, PADGETT K A, JONES JH. Ameta- analysis suggesting that the relationship between biodiversity and risk of zoonotic pathogen transmissionis idiosyncratic[J]. Ecology Letter, 2013, 16(5): 679–686.
[44] JONES K E, PATEL N G, LEVY M A, et al. Global trends in emerging infectious diseases[J]. NATURE, 2008, 451 (7181): 990–993.
[45] VAN KERKHOVE M D, HIRVE S, KOUKOUNARI A, MOUNTS AW. Estimating age-specific cumulative incidence for the 2009 influenza pandemic: a meta-analysis of A(H1N1)pdm09 serological studies from 19 countries, Influenza Other Respir[J]. Influenza & Other Respiratory Viruses, 2013, 7(5): 872–95.
[46] GILCHRIST M J, GREKO C, WALLINGA D B. The potential role of concentrated animal feeding operations in infectious disease epidemics and antibiotic resistance[J]. Environ. Health Perspect, 2007, 115(2): 313–16.
[47] SCHMIDT C W. Swine CAFOs and novel H1N1 flu: separating facts from fears[J].Environ, Health Perspect, 2009.117(9): 1329–1476.
[48] GRAY G C, BAKER W S. Editorial commentary: the problem with pigs: it’s not about bacon[J]. Clinical Infectious Diseases An Official Publication of the Infectious Diseases Society of America, 2011, 52(1): 19–22.
[49] SMITH K F, GUEGAN J F J. Changing Geographic Distributions of Human Pathogens[J]. Annual Review of Ecology Evolution & Systematics, 2010, 41(1): 231–250.
[50] MORSE S S, MAZETT J A K, WOOLHOUSE M, PARRISH CR, CARROLL D, et al. Prediction and prevention of the next pandemic zoonosis[J]. Lancet, 2012, 380(9857): 1956– 1965.
[51] FLANAGAN J L, BRODIE E L, WENG L, et al. Loss of Bacterial Diversity during Antibiotic Treatment of Intubated Patients Colonized with Pseudomonas aeruginosa[J]. Journal of Clinical Microbiology, 2007, 45(6): 1954–1962.
[52] DETHLEFSEN L, HUSE S, SOGIN M L, RELMAN D A. The Pervasive effects of an antibiotic on the human gut microbiota, as revealed by deep 16S rRNA sequencing[J]. PLoS Biology, 2008, 6(11): e280.
[53] PARRISH C R, HOLMES E C, MORENS D M, et al. Cross-Species Virus Transmission and the Emergence of New Epidemic Diseases[J]. Microbiology and Molecular Biology Reviews, 2008, 72(3): 457–470.
[54] US FDA.FDA Releases Annual Summary Report on Antimicrobials Sold or Distributed in 2017 for Use in Food-Producing Animals [R]. USA: Silver Spring, MD, US FDA, 2013.
[55] MURRAY C J L, VOS T, LOZANO R, et al. Disability- adjusted life years (DALYs) for 291 diseases and injuries in 21 regions, 1990-2010: a systematic analysis for the Global Burden of Disease Study 2010[J]. Lancet, 2012, 380(9859): 2197–223.
[56] RAV A, SINGH S D. Global Tuberculosis Report 2012[J]. Australasian Medical Journal, 2013, 6(2).
[57] LAMBIN E F, MEYFROIDT P. Global land use change, economic globalization, and the looming land scarcity[J]. Proceedings of the National Academy of Sciences, 2011, 108(9): 3465–3472.
[58] HANSEN M C, POTAPOV P V, MOORE R, et al. High-Resolution Global Maps of 21st-Century Forest Cover Change[J]. Science, 2013, 342(6160): 850–853.
[59] 马兴树. 动物疫病频发原因及防控策略[J]. 北方牧业, 2015, (01): 17–18.
[60] MILLER R S, FARNSWORTH M L, MALMBERG J L. Diseases at the livestock-wildlife interface: Status, challenges, and opportunities in the United States[J]. Preventive Veterinary Medicine, 2013, 110(2): 119–132.
[61] ROSE D A. Free Trade and Wildlife Trade[J]. Conservation Biology, 2010, 6(1): 148–150.
[62] KARESH W B, COOK R A, BENNETT E L, et al. Wildlife trade and global disease emergence[J]. Emerging Infectious Diseases, 2005, 11(7): 1000–1002.
[63] BUTCHART S H M, WALPOLE M, COLLEN B, et al. Global Biodiversity: Indicators of Recent Declines[J]. Science, 2010, 328(5982): 1164–1168.
[64] PEJCHAR L, MOONEY H. “Invasive Species, Ecosystem Services, and Human Well-being.”[J]. Trends in Ecology and Evolution, 2009, 24(9): 497–504.
[65] VILA M, BASNOU C, PYSEK P, et al. How well do we understand the impacts of alien species on ecosystem services? A pan-European, cross-taxa assessment[J]. Frontiers in Ecology and the Environment, 2010, 8(3): 135–144.
[66] STOETT P. Framing bioinvasion: biodiversity, climate change, security, trade, and global governance[J]. Global Governance: A Review of Multilateralism and International Organizations, 2010, 16(1): 103–120.
[67] CROWL T A, CRIST T O, PARMENTER R R, et al. The spread of invasive species and infectious disease as drivers of ecosystem change[J]. Frontiers in Ecology and the Environment, 2008, 6(5): 238–246.
[68] MAZZA G, Tricarico E, Genovesi P, et al. Biological invaders are threats to human health: an overview[J]. Ethology Ecology & Evolution, 2014, 26(2-3): 112–129.
[69] MACK R, SIMBERLOFF, LONSDALE W, et al. “Biotic invasions: causes, epidemiology, global consequences, and control.”[J]. Ecological Applications, 2000, 10(3): 689– 710.
[70] MAZZA G, TRICARICO E, GENOVESI P, et al. Biological invaders are threats to human health: an overview[J]. Ethology Ecology & Evolution, 2014, 26(2-3): 112–129.
[71] PERKIES S E, ALTIZER S, BJORJORNSTAD, et al. “Invasion Biology and Parasitic Infections.”[C]// IN OSTFELD O, KEESINF F, EVINER V. eds. Infectious Disease Ecology: Effects of Ecosystems on Disease and of Disease on Ecosystems. USA: Princeton University Press, 2010: 179–207.
[72] TAKAHASH C K, LOURENCO, NG G S, LOPES T F, et al. “Ballast water: a review of the impact on the world public health.”[J]. Journal of Venomous Animals and Toxins Including Tropical Diseases, 2008, 14 (3): 393–408.
[73] ANDERSON P K, CUNNINGHAM AA, PATEL NG, et al. “Emerging infectious diseases of plants: pathogen pollution, climate change and agrotechnology drivers.” [J]. Trends in Ecology and Evolution, 2004, 19(10): 535–544.
[74] SANTINI A, GHELARDINI L, DE PACE C. Biogeographical patterns and determinants of invasion by forest pathogens in Europe[J]. New Phytologist, 2013, 197(1): 238–250.
[75] BANDYOPADHYAY R, FREDERIKSEN R A. “Contemporary global movement of emerging plant diseases.”[J]. Annals of the New York Academy of Sciences, 1999, 894: 28–36.
[76] PIMENTEL D, ZUNIGA R, MORRISON D. Update on the environmental and economic costs associated with alieninvasive species in the United States[J]. Ecological Economics, 2005, 52(3): 273–288.
[77] ALDERMAN D J. Geographical spread of bacterial and fungal diseases of crustaceans[C]// B J, HILL T, HASTEIN, eds. In Preventing the spread of aquatic animal diseases. Rev. sci. tech. Off. int. Epiz, 1996, 15 (2) : 603–632.
[78] SMITH K M, LOH E H, ROSTAL M, et al. Pathogens, Pests, and Economics: Drivers of Honey Bee Colony Declines and Losses[J]. EcoHealth, 2013, 10(4): 434–445.
[79] CAPINHA C, LARSON E R, TRICARIO E, et al. Effects of climate change, invasive species, and disease on the distribution of native European crayfishes[J]. Conservation Biology, 2013, 27(4): 731–740.
[80] HATCHER M J, DICK J T A, DUNN A M. Disease emergence and invasions[J]. Functional Ecology, 2012, 26: 1275–1287.
[81] SETO K C, GUNERALP B, HUTYRA L R. Global forecasts of urban expansion to 2030 and direct impacts on biodiversity and carbon pools[J]. Proceedings of the National Academy of Sciences, 2012, 109(40): 16083– 16088.
[82] HACKER K P, SETO K C, COSTA F, et al. Urban slum structure: integrating socioeconomic and land cover data to model slum evolution in Salvador, Brazil[J]. International Journal of Health Geographics, 2013, 12(1): 45–45.
[83] TAYLOR L H, LATHAM S M, MARK E. Risk factors for human disease emergence[J]. Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences, 2001, 356(1411): 983–989.
[84] BONDS M H, DOBSON A P, KEENAN D C. Disease Ecology, Biodiversity, and the Latitudinal Gradient in Income [J]. PLoS Biology, 2012, 10(12): e1001456.
A review of interactions between biodiversity and human health
LIAO Juyang1, 3, 5, PEI Nancai2, LIU Yan3, 5, Qi Chengjing4,*, Zhang Juan3, 5, LI Qiaoyun3, 5,Wang Lin3, 5
1. Beijing Forestry University, Beijing 100083, China 2. Research Institute of Tropical Forestry, Chinese Academy of Forestry, Guangzhou 510520, China 3. Hunan Botanical Garden, Hunan, Changsha 410116, China 4. Central South University of Science and Technology, Changsha 410004, China 5. Hunan Changsha-Zhuzhou-Xiangtan Urban Forest Ecosystem Station, National Forestry and Grassland Administration, Changsha 410116, China
Biodiversity has provided positive effect on ecosystem services and the maintenance of human health. Therefore, it is of great significance to maintain biodiversity to reduce social and economic losses and to protect human health. This paper discussed the impact of increased or lost biodiversity on the occurrence and spread of infectious diseases, characteristics of infectious diseases and their harm, and focused on analyzing the reason of infectious diseases be intensified under changes in biodiversity, impact of land use change, breeding industry development, wildlife trade, invasive species, and social ecological background on the spread of infectious diseases. Finally, it tried to put forward countermeasures and measures for the above problems, providing scientific basis for further research, coping with infectious diseases, and building healthy and livable environment.
Bi-+odiversity; Disease; Land use changes; Wildlife trade; Alien species
10.14108/j.cnki.1008-8873.2021.05.027
Q16 S
A
2020-03-09;
1008-8873(2021)05-231-10
2020-05-31
湖南省重点研发计划(2021NK2009); 湖南省林业科技创新(XLK201942);
廖菊阳(1980—), 男, 湖南省汨罗人, 硕士, 研究员, 主要从事生态景观学研究, E-mail:542796447@qq.com
通讯作者:祁承经, 男, 博士, 教授, 主要从事森林生态系统定位观测研究, E-mail:jing589w@163.com陈文(1963—), 男, 副研究员, 主要从事地理环境与生态学研究, E-mail: cyw1018@sina.com
廖菊阳, 裴男才, 刘艳, 等. 生物多样性与人居健康交互关系综述[J]. 生态科学, 2021, 40(5): 231–240.
LIAO Juyang, PEI Nancai, LIU Yan, et al. A review of interactions between biodiversity and human health[J]. Ecological Science, 2021, 40(5): 231–240.
