预后营养指数与微型营养评估表对老年急性脑梗死患者营养状况的评估效果比较
2021-11-13崔玉环张婧文徐雅丽冯英慧连晶晶刘占矿董利平
崔玉环,张婧文,徐雅丽,冯英慧,杜 丹, 颜 娟,连晶晶,刘占矿,董利平
(河北北方学院附属第一医院,1.老年病科,2.药学部,3.检验科,河北 张家口,075000)
老年急性脑梗死患者常伴有营养不良,其患病率为6.1%~62.0%[1],是导致梗死复发、引发各类感染以及加重患者病情的独立危险因素[2],并与脑梗死患者不良临床预后密切相关[3]。但目前临床尚无公认的营养不良定义和营养状况评估金标准[4]。微型营养评估表(MNA)是目前临床推荐的且使用最广泛的肠内营养评估方法,可用于识别营养不良,具有良好的预测有效性和可靠性[5],但其为主观评估方法,并不适用于某些脑梗死患者。预后营养指数(PNI)是一种根据血清白蛋白(ALB)水平和外周血总淋巴细胞计数(TLC)计算得出的营养和免疫指标,已被成功应用于恶性肿瘤或心力衰竭等患者中[6-8],但关于PNI对脑梗死患者营养状况评估效果的研究尚较少见。本研究应用PNI和MNA评估老年急性脑梗死患者营养状况,并分析PNI与MNA在人体测量学指标、生化指标、功能状态指标评估方面的相关性,现报告如下。
1 资料与方法
1.1 一般资料
本研究经本院伦理委员会审核批准,选取2018年1月—2020年12月河北北方学院附属第一医院老年科收治的120例老年急性脑梗死患者作为研究对象。纳入标准:① 符合《中国急性缺血性脑卒中诊治指南2018》[9]中的脑梗死诊断标准,并经CT和(或)MRI检查证实为前循环区域梗死者,依据英国医学研究理事会(MRC)制定的肌力分级标准,发病时偏瘫肢体肌力为3/5或更低者;② 发病至入院时间≤3 d者;③ 年龄≥60岁者;④ 签署知情同意书,能配合评估及检查者。排除标准:① 严重肝肾功能不全、严重心血管疾病、内分泌及代谢性疾病、出血性卒中和涉及椎基底循环的卒中患者;② 入院前4周内有感染症状者;③ 主动要求退出而未按规定完成治疗计划者;④ 3个月内死亡者。
1.2 方法
1.2.1 人口统计学资料收集:通过面对面采访和整理医学记录获得研究对象的人口统计学资料。
1.2.2 人体测量学指标检测:患者均于入院24 h内晨起小便之后,穿着轻便衣物,不穿鞋,采用 TCS-200-RT型电子身高体质量称(上海力衡仪器仪表有限公司)测量身高、体质量,记录时精确到0.1 cm、0.5 kg。体质量指数(BMI)=体质量/身高2,单位为kg/m2。中上臂围(MUAC)使用软卷尺(得力集团有限公司)经肩峰与尺骨鹰嘴连线中点绕臂1周测量。患者取坐位,腿放松下垂,于小腿最粗壮处绕1周测量小腿围(CC),精确到0.1 cm。
1.2.3 美国国立卫生研究院卒中量表(NIHSS)评估:由2名专业的神经内科医师于患者入院时进行详细的神经系统检查,采用NIHSS评分评估患者卒中严重程度,该量表包括视野、凝视、意识水平、上肢运动、下肢运动、感觉、共济失调、面瘫、构音障碍、语言及忽视症共11个条目,分值0~42分,评分越高表示神经功能受损越严重,分为轻度(0~4分)、中度(5~15分)、中重度(16~20分)、重度(21~42分)。
1.2.4 血液及生化指标检测:患者空腹8 h以上,于入院次日清晨采集肘正中静脉血,采用日本西斯美康公司的全自动血细胞分析仪(XN-3000)、日本日立公司的全自动生化分析仪(7600-110)、上海奥普生物医药有限公司的全血C反应蛋白(CRP)分析仪(Otoman-1000)及其配套试剂检测TLC、血红蛋白(Hb)、血清ALB、血清总蛋白(TP)、CRP水平。
1.2.5 预后评估:通过门诊就诊方式或电话访谈方式进行随访,应用改良Rankin量表(mRS)评分评估患者急性脑梗死3个月时的近期预后。根据mRS评分的不同,将患者分为预后良好者(mRS评分≤2分)和预后不良者(mRS评分>2分)。
1.2.6 营养评估及分组:所有患者于入院24 h内采用 MNA及PNI进行营养筛查与评估。MNA评分≥24分,营养正常;MNA评分17~<24分,有营养不良风险;MNA评分<17分,营养不良[10]。根据MNA评分的不同,将患者分为MNA营养不良组(MNA评分<24分)和MNA营养正常组(MNA评分≥24分)。计算PNI,PNI=血清ALB(g/L)+5×外周血TLC(×109/L)[11-12]。以患者急性脑梗死3个月时的预后作为终点绘制PNI指数的受试者工作特征(ROC)曲线,确定PNI最佳截断值。根据最佳截断值,将患者分为PNI营养不良组和PNI营养正常组。
1.3 统计学分析
2 结 果
2.1 基线资料
120例患者中,男67例,女53例;年龄60~91岁,平均(72.8±8.3)岁;身高(1.7±0.1)m,体质量(68.1±13.4)kg,BMI为(24.7±4.4)kg/m2;MUAC为(28.9±3.0)cm,CC为(32.0±3.8)cm;体质量减轻(4.5±3.4)kg;NIHSS评估结果为轻度2例、中度82例、中重度28例、重度8例;TLC为(2.5±0.5)×109/L,Hb为(129.6±18.7)g/L,ALB为(39.6±7.4)g/L,TP为(65.0±7.8)g/L,CRP为(3.0±1.4)mg/L。
2.2 PNI的最佳截断值
以患者急性脑梗死3个月时的预后作为终点绘制PNI的ROC曲线,曲线下面积为0.779(95%CI为0.691~0.866,P<0.001)。当PNI值为50.375时,Youden指数最大(0.445),敏感度为70.9%,特异度为73.5%。见图1。根据最佳截断值,将PNI<50.375者纳入PNI营养不良组,PNI≥50.375者纳入PNI营养正常组。

2.3 PNI与MNA的营养评估结果比较
120例老年急性脑梗死患者的MNA评估结果显示,营养不良者57例(47.5%),营养正常者63例(52.5%);PNI评估结果显示,营养不良者50例(41.7%),营养正常者70例(58.3%)。
2.4 营养不良组与营养正常组的人体测量学指标、生化指标、功能状态指标比较
与MNA营养正常组患者相比,MNA营养不良组患者年龄较大,体质量较轻,MUAC、CC、BMI及TLC、ALB、TP水平较低,体质量减轻较多,入院时NIHSS评分较高,差异有统计学意义(P<0.05);2组性别、Hb和CRP情况比较,差异无统计学意义(P>0.05)。见表1。
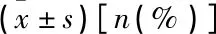
表1 MNA分组患者基线特征比较
与PNI营养正常组患者相比,PNI营养不良组患者年龄较大,体质量较轻,MUAC、CC、BMI及TLC、ALB、TP、Hb水平较低,体质量减轻较多,入院时NIHSS评分较高,差异有统计学意义(P<0.05);2组性别、CRP情况比较,差异无统计学意义(P>0.05)。见表2。2组患者的Hb水平差异可能与PNI计算方式偏向于生化来源有关。
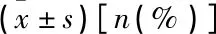
表2 PNI分组患者基线特征比较
2.5 PNI分组与MNA分组的人体测量学指标、生化指标、功能状态指标比较
MNA营养正常组与PNI营养正常组患者在年龄、性别、体质量、MUAC、CC、体质量减轻、BMI、入院时NIHSS评分和TLC、Hb、TP、CRP、ALB水平方面比较,差异均无统计学意义(P>0.05),见表3。MNA营养不良组与PNI营养不良组患者在年龄、性别、体质量、MUAC、CC、体质量减轻、BMI、入院时NIHSS评分和TLC、Hb、TP、CRP水平方面比较,差异均无统计学意义(P>0.05),见表4。由此说明,PNI分组与MNA分组患者的基线特征一致性良好。
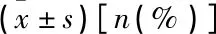
表3 MNA营养正常组与PNI营养正常组患者基线特征比较
MNA营养不良组与PNI营养不良组患者ALB水平比较,差异有统计学意义(P<0.05),见表4。分析原因,PNI是根据血清ALB水平和外周血TLC计算所得,故ALB对PNI影响较大。
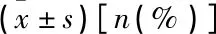
表4 MNA营养不良组与PNI营养不良组患者基线特征比较
2.6 PNI与MNA的一致性检验
PNI与MNA方法的符合率为82.5%,一致性检验显示κ=0.647,说明两者具有高度一致性,见表5。

表5 PNI与MNA的一致性检验
3 讨 论
营养不良与脑梗死患者的不良临床预后密切相关,营养不良可阻碍神经可塑性相关蛋白表达,抑制缺血半暗带蛋白质合成和葡萄糖利用,诱导全身急性期反应,加剧脑缺血引起的神经炎症,影响血脑屏障通透性,导致脑氧化应激,进而加重神经功能损伤,并抑制免疫功能,引发感染,使得患者住院时间延长和病死率升高[14-15]。因此,初步的营养评估对预测卒中预后至关重要,但由于临床缺乏公认的营养不良定义和营养评估金标准,脑梗死患者的营养评估工作具有一定挑战性。
营养状况评估常用的方法包括主观评估方法和客观评估方法。主观评估方法包括MNA、营养不良通用筛查工具(MUST)、营养风险筛查2002(NRS 2002)和主观全局评估法(SGA)等,但因其要求患者具有相对正常的认知功能以配合填写调查表,且具有一定程度的主观性,还需由经专业培训的医疗保健人员进行评估,因此并不适用于所有缺血性脑梗死患者的筛查。虽然MNA是目前使用最广泛的肠内营养评估方法,但其为主观评估方法,某些脑梗死患者并不适用。客观评估方法包括血液学指标、生化指标和人体测量学指标评估(如总胆固醇、血清ALB、转铁蛋白、前白蛋白和CRP等指标),但易受医学状况如恶性肿瘤、肝病、感染、压力和其他严重疾病的影响。
PNI是一种客观而简单的评估工具,易于获得,且无创。另一方面,与其他评估工具相比,PNI对营养不良具有很高的敏感性[16]。但应用PNI诊断老年急性脑梗死患者营养不良的分界值目前尚无统一标准,本研究根据急性脑梗死后3个月时不良预后的ROC曲线确定PNI分界值为50.375,而相关研究[17]将49.33作为分界值,这种差异可能与不同地区急性脑梗死患者的整体营养状况差异有关。
本研究中,MNA评估为营养不良者57例(47.5%),PNI 评估为营养不良者50例(41.7%),与既往研究[18]结论一致。PNI与MNA评估的营养不良组或营养正常组在人体测量指标、生化指标、功能状态等指标方面具有良好的一致性。进一步行一致性检验发现,PNI与MNA具有较高符合率(82.5%)和高度一致性(κ=0.647)。由此表明,PNI和MNA方法在营养状况评估方面具有良好的一致性。既往研究[19-20]证实,MNA与多种生化参数密切相关,林红等[21]发现MNA评分与ALB水平密切相关。同样,PNI亦与ALB、TP密切相关。此外,PNI、MNA评分与人体测量学参数如体质量、BMI、小腿和手臂围度及体质量减轻密切相关[22-23]。其中,体质量减轻(>5%)是影响营养状况的最重要因素之一,且与PNI、MNA评分均呈负相关,即体质量减轻越多,PNI、MNA评分越低[24]。
综上所述,PNI与MNA有很好的一致性,其中PNI评估更为客观,而MNA评估更加主观,两者均可用于评估老年急性脑梗死患者的营养状况,且与人体测量指标、生化指标、功能状态等指标有密切相关性。但当患者无能力完成MNA评估时,PNI可能是更合适的营养评估工具,尤其是在急诊环境中,可使患者在更有效的营养干预中受益。本研究存在一定局限性,如样本量偏小,营养不良的诊断缺乏金标准,还需在今后的进一步研究中对结论加以证实。
