应用高通量测序方法研究CRF01-AE亚型HIV-1毒株耐药突变的分子进化规律
2021-11-13邓永岳吴守丽邱丽君严延生
邓永岳,吴守丽,邱丽君,严延生
(1.福建医科大学 公共卫生学院,福建 福州,350001;2.厦门大学附属中山医院 感染科,福建 厦门,361000;3.福建省疾病预防控制中心 福建省人兽共患病研究重点实验室,福建 福州,350001;4.福建省立医院 医院感染管理部,福建 福州,350001)
大量研究[1-3]表明,随着艾滋病抗反转录病毒治疗(ART)的推广,耐药的流行趋势也越来越严重。一项针对来自64 个低中收入国家的56 044例感染人类免疫缺陷病毒(HIV)的成年人的荟萃分析[4]估计,在所有地区中每年的治疗前耐药率的年增长率均大幅增加。鉴于耐药现状,世界卫生组织(WHO)强烈推荐更有效地利用有限的资金对治疗患者进行耐药监测并努力确保提供适当的一线药物[5],这就要求对当地流行毒株耐药突变的分子进化规律有足够的了解,才能合理选择耐药监测的时间点。近年来,国外学者应用高通量测序方法研究HIV耐药突变取得了很好的效果,但国内未见报道。本研究参考DUDLEY D M等[6]建立的检测方法,重新设计适合的测序引物,研究本地区流行毒株在接受抗病毒治疗过程中耐药突变发生和发展的规律,现将结果报告如下。
1 资料与方法
1.1 一般资料
选择5例在福建省疾控中心经6~8年一线抗病毒治疗并发生耐药的人类免疫缺陷病毒1型(HIV-1)CRF01-AE亚型艾滋病患者作为研究对象,每例患者每年至少随访1次,总随访次数≥6次,随访时收集患者的EDTA抗凝全血,-80 ℃低温冰箱保存,统一检测。共收集41份血清标本用于分析,病毒载量>1 000 copies/mL的标本可用于耐药检测。
1.2 方法
1.2.1 扩增子文库准备:① 提取RNA,取140 μL血浆,采用Qiagen试剂盒提取RNA,操作严格按照说明书进行。② 巢式PCR第1轮,采用一步法RT-PCR,PCR反应条件为50 ℃ 60 min,94 ℃ 2 min,94 ℃ 15 s,60 ℃ 30 s,68 ℃ 30 s(循环2次),94 ℃ 15 s,58 ℃ 30 s,68 ℃ 30 s(循环2次),94 ℃ 15 s,55 ℃ 30 s,68 ℃ 30 s(循环16次),68 ℃ 10 min。引物信息见表1。③ 巢式PCR第2轮,分3个片段扩增pol基因2 199~3 285区域,标记为Pro、RT-A、RT-B,PCR反应条件为94 ℃ 2 min,94 ℃ 15 s,60 ℃ 30 s,68 ℃ 30 s(循环2次),94 ℃ 15 s,58 ℃ 30 s,68 ℃ 30 s(循环2次),94 ℃ 15 s,55 ℃ 30 s,68 ℃ 30 s(循环16次),68 ℃ 10 min。模板特异性引物序列信息见表2。

表1 一步法RT-PCR引物信息

表2 模板特异性引物序列信息
1.2.2 高通量测序:扩增子文库经过纯化、质控和定量以及稀释和富集后进行EmPCR和Roche 454高通量测序。
1.2.3 序列分析:使用Mothur软件(Version 1.31.2,http://www.mothur.org/)对原始测序数据进行过滤,根据质量分数修剪3′端,去除Roche/454 amplicon adaptors和短于50 bp的序列。将序列与HXB2参考株(GenBank NC_001802)进行比对,然后采用GATK软件进行SNP calling,使用参数为“stand_call_conf 50 -stand_emit_conf 10”。最后根据Stanford HIV drug resistance data base (Stanford HIVDB)已知耐药突变,列出相应位点的特定氨基酸改变,将SNP calling的结果与之比对,计算含有某个位点耐药突变的序列在覆盖到该位点的总序列中的比率,<20%的耐药突变定义为劣势耐药突变。
2 结 果
2.1 标本的基本信息
共选取5例患者在抗病毒治疗前后的系列标本进行高通量测序分析,随访7~9次,时间跨度6~8年,标本的基本信息见表3。

表3 标本的基本信息
2.2 耐药突变特征
第1例患者治疗5个月后,即检测到接近100%高频的核苷类逆转录酶抑制剂(NRTIs)M184V突变,此后一直持续存在,即使更换治疗方案并停用3TC长达29个月,也始终能被检测到,见表4。治疗3个月后,即检测到高频胸腺嘧啶脱氧核苷类似物变异(TAMs)D67N和K70R,其中D67N在整个治疗过程中持续存在,但K70R在下一次随访中就不再出现。一线方案治疗40个月后出现 Q151M/A62V/V75I,换二线方案治疗后又出现F77L和F116Y,形成完整的151复合体。非核苷类逆转录酶抑制剂(NNRTIs)类耐药突变比较简单,在用药后第1次随访即检测到高频主要耐药突变G190A,比率接近100.00%,停用奈韦拉平(NVP)后未用其他NNRTIs药,但4年后仍存在该类药物的高频突变。患者在启动治疗后第3次随访时换用含蛋白酶抑制剂(PIs)类药物茚地那韦(IDV)的方案,在第4次随访时就检测到PI类耐药,即高频的M46I(99.96%)和中高频的I84V(61.66%),第5次随访时其频率都接近100.00%,同时还新出现了L76V(100.00%),这3种耐药突变在随后的几次检测中一直存在,即使换含克力芝的二线方案也一样。

表4 第1例患者的主要耐药突变频率情况[n(%)]
第2例患者治疗3个月后,即出现高频M184V突变,且一直维持在整个治疗过程中,见表5。在治疗过程中也形成TAMs突变,与第1例患者不同的是,第2例患者主要通过TAM1途径。患者在用药后第1次随访即检测到NNRTIs类高频主要耐药突变K101E和G190A,停用相应药物或换二线药物后,突变也始终存在;患者换用含PIs类药物IDV的方案5个月后,检测到低频V82A(2.73%);在换含克力芝的二线方案2个月后,检测到都接近100.00%的M46I和V82A;第6次随访时,在此基础累加了高频的I47V(100.00%)、F53L (98.44%)和I54V(99.72%);第7次随访时继续增加了L76V(80.11%);总体上而言,使用PIs类药后,PIs类药物突变不断累加,至末次随访时共检测到5个接近100.00%高频的主要突变。
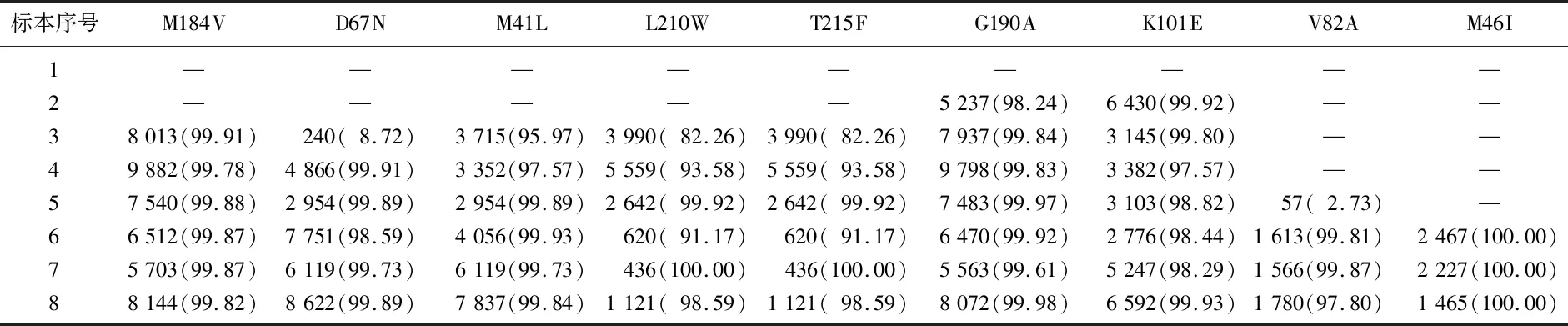
表5 第2例患者的主要耐药突变频率情况[n(%)]
第3例患者治疗7个月后出现M184V突变且一直维持在整个治疗过程中,见表6。与第1例和第2例患者不同的是,该患者的一线和二线方案都含拉米夫定(3TC),治疗过程中主要通过TAM2途径形成多重耐药TAMs,治疗早期即出现高频D67N、K70R,治疗中T215F和K219Q频率逐渐增加。治疗中还形成不完整的第2种多重耐药:69插入复合物,可以看到T69N/D从低频到高频的演变过程。NNRTIs类耐药突变方面,患者在用药后第1次随访即检测到K103N和G190A,停用相应药物或换二线药物,突变也始终存在。该患者在治疗后第6次随访前使用PIs类药物(含克力芝的二线方案),随后就检测到高频的M46I(100.00%)、I47V/A(98.88%)、I84V(100.00%)和低频V82A(1.16%);第7次随访时,3种高频突变维持不变,V82A未检测到,但检测到低频G73S(1.03%)。
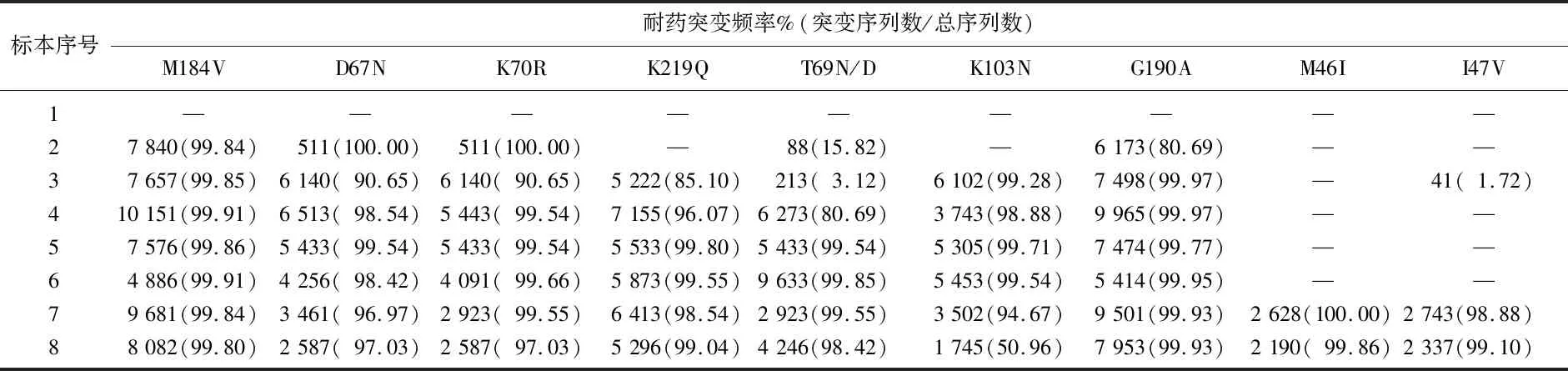
表6 第3例患者的主要耐药突变频率情况[n(%)]
第4例患者治疗7个月后出现M184V突变并一直维持在整个治疗过程中,换二线方案前未出现明显的多重耐药,TAM类突变仅有K219Q,而M41L和K70R一度出现低频,但随后消失。NNRTIs类耐药突变方面,患者在用药后第1次随访即检测到高频主要耐药突变G190A,还出现一过性低频K103N和V108I。该患者在第6次随访前才使用PIs类药物(含克力芝的二线方案),更换方案后治疗有效,病毒转阴。在整个治疗过程中,未监测到高频PIs类突变,仅在第2次随访时检测到一过性的低频PIs类K20R(14.15%),第4次随访时检测到一过性的低频PIs类I84V(1.69%)。
第5例患者治疗2个月后出现M184V突变并一直维持在整个治疗过程中,治疗中通过TAM2途径形成TAMs突变,但出现时间较第3例患者更晚,在第3次随访后逐渐形成,换二线方案前未出现明显的多重耐药。患者在用药后第1次随访即检测到高频主要耐药突变G190A,治疗中后期出现高频K103N。在第6次随访前才使用PIs类药物(含克力芝的二线方案),更换方案后治疗有效,病毒转阴。整个治疗过程中未监测到高频PIs类突变。
3 讨 论
HIV-1在宿主体内不断变异,形成了一个由高度同源而又各不相同的变异体组成的病毒群,即所谓的准种。由于耐药突变的适应性代价,耐药准种在治疗前一般以低比率劣势准种的形式存在,在药物选择压力下,劣势耐药准种具有生长优势,会被筛选出来,逐渐变成体内优势病毒株,这被认为是治疗失败的主要原因。掌握劣势耐药准种分子进化规律对制订耐药监测方案有重要意义,但由于受到检测劣势突变的方法学限制,在这方面的研究较少。既往研究[7-9]大多采用的是克隆RT-PCR产物测序法、单基因组扩增法、等位基因特异性PCR法等,但都不能很好地体现比率<20%的“劣势准种”,因此无法掌握耐药突变早期的发生发展规律。本研究成功运用高通量测序方法,检测出比率<1%的HIV“劣势准种”,观察到耐药准种从极低占比开始逐渐发展为高占比优势毒株的过程,这将为临床制订恰当的耐药监测方案提供科学依据。
3.1 NRTIs类耐药突变的进化规律
NRTIs是首类被美国食品药品监督局(FDA)批准的药物,也是目前应用得最多的一类药物。本研究的一线和二线方案中均包含3TC,本研究的5例患者均在治疗后第1次随访时就出现M184V,第5例患者更是在启动治疗2个月后即检测到了这一突变,提示耐药监测的时间应适当提前。本研究还发现的显著特征是M184V的顽固性,作者观察到M184V一旦出现后,就会一直维持在整个治疗过程中,即使停用3TC也不会消失,例如第1例患者停药达29个月,第2例患者停药达21个月,但仍然能继续检测到M184V突变。一线方案中的另一种NRTI药物是胸苷类似物齐多夫定(AZT)或司他夫定(D4T),其选择出来的耐药突变主要是TAMs,TAMs促进焦磷酸水解,并参与AZT和的D4T的切除[10-11]。TAMs的形成是不断积累的过程,其在HIV-1逆转录酶的氨基酸变化包括2个不同的的途径:TAM1途径(M41L、L210W、T215Y,偶见D67N)和TAM2途径(D67N、K70R、T215F、K219E/Q)[12]。作者观察到第1、3、4、5例患者是TAM2路径,第2例患者是TAM1途径。借助于低频突变的检测,本研究从第2例患者身上发现2种不同途径的进化模式,即在用药初期时所有6种突变TAMs都会产生,但存在竞争关系,其中一种途径的突变会占上风,频率逐渐增加,而另一种途径的突变会被淘汰。但是2种不同途径的突变并不是绝对不相容的,随着治疗时间的延长,不同途径的突变也会发生组合,例如第3例患者前期只有途径2的突变,第6次随访后累加途径1的突变(M41L),其原因可能是这位患者当时已经持续使用了5年的D4T。
3.2 NNRTIs类耐药突变进化规律
与其他类耐药显著减少复制适应性不同的是,NNRTIs的单核苷酸的变化就可能导致高水平耐药性,同时只有轻微的复制适应性损失[13]。本研究观察到5例患者中只有第3例患者在用药后期累积了4种突变,其他4例患者都只有1~2种突变。既往报道中,一般主要的NNRTIs突变包括:K103N、V106A/M、A98G、Y181C/I,但本研究观察到的是G190A几乎“一枝独秀”,其特点和此前讨论的M184V类似,出现的时间极早、持续时间极长、停药后不消失,似乎在CRF01-AE亚型中,G190A的竞争优势非常明显。因为,通过高通量测序可以发现治疗过程中其他突变通常只会低频出现,大多数随即消失,只有少数逐渐累积到耐药中,G190A的这种适应性优势现象在之前的报道中未被提及。有学者[14-15]分析中国治疗失败的HIV感染者耐药变异结果,NRTI类最多的是M184V(42.7%),NNRTI类最多的是G190A(23.4%),与本研究结果一致,5例患者都存在M184V+G190A的基本组合,说明这种组合有治疗失败的预警价值。关键的是,作者发现这2种突变都是非常迅速地出现,都在治疗后第1次随访就可以检测到,说明了及早进行耐药监测的重要性。
5例患者更换相同的二线方案后,3例无效,2例病毒转阴,换药有效。与患者开始二线方案前的耐药情况比较发现不同之处在于换药前是否存在针对NRTIs类的多重耐药突变,第1例患者有Q151M多重耐药复合体,第2例患者有TAM1途径耐药组合,第3例患者有T69插入多重耐药复合体,其都出现换药失败,而第4、5例患者未发现这些多重耐药突变,二线治疗获得成功。因此,耐药监测对用药及一线方案失败后更换二线治疗方案具有重要的指导意义。
综上所述,本研究应用高通量测序方法初步阐明了CRF01-AE亚型患者在接受抗病毒治疗过程中pol基因区耐药突变的分子进化规律,这对准确监测耐药发生并确保提供适当的一线药物方案有重要意义。同时,本研究也发现,随访间隔时间过长,特别是治疗初期没有尽早开展耐药检测,对完全掌握耐药突变的进化规律会造成一定的影响,今后的研究中还需改进。
