LncRNA MALAT1靶向miR-34a调控弥漫性大B细胞淋巴瘤细胞的增殖和凋亡
2021-11-13万阳阳
赵 寅,沈 芩,万阳阳
(四川大学华西医院血液科,成都 610041)
弥漫性大B 细胞淋巴瘤(DLBCL)是非霍奇金淋巴瘤(NHL)中经常见到的一种疾病,占所有病例的1/3。这类淋巴瘤占临床上的“侵袭性”或“中高度恶性”淋巴瘤的大多数病例。以前的治疗方式主要是化疗,但是副作用比较大,预后不良[1-2]。已经有许多研究报道,LncRNA参与了DLBCL的生物学功能和作用,调控其发生和发展。LncRNA HULC 在DLBCL 患者中的表达具有重要的临床意义[3];LncRNA MUC5 B-AS1 在DLBCL 中的表达在临床上具有十分关键的作用[4];LncRNA RP11-513G11.1 参与了DLBCL的发生和发展[5]。也有很多研究发现,miRNA 在DLBCL 的也有一定程度的表达,影响其发展进程。miR-148b参与调控DLBCL药物敏感性机制[6];DLBCL 患者中miR-149-5p 表达下调,通过凋亡途径影响肿瘤的发生[7]。本实验旨在研究LncRNA MALAT1 靶向miR-34a 对DLBCL 细胞增殖、凋亡的影响及其分子机制。
1 材料与方法
1.1 组织来源
收集2019 年1 月至2020 年2 月在四川大学华西医院治疗的50例DLBCL患者为DLBCL组,其中男24 例,女26 例,年龄30~75 岁,平均(50.38±6.18)岁,所有患者术前均未接受放疗、化疗等治疗。同时,选取同期到本院体检的健康志愿者48例为对照组,其中男25 例,女23 例,年龄31~73 岁,平均(52.38±7.06)岁。对照组与DLBCL组性别、年龄等一般资料比较,差异无统计学意义(P>0.05)。本研究已取得本院医学伦理委员会批准,所有研究对象均签署知情同意书。
1.2 试剂
人DLBCL 细胞OCI-Ly8 购自中科院上海细胞库,货号:222476;DMEM 培养基购自美国Hyclone公司,货号:3 332464;胎牛血清(FBS)购自美国Invitrogen 公司,货号:1 986468;胰蛋白酶购自美国BD公司,货号:2 755795;qRT-PCR 试剂盒购自大连宝生物科技,货号:3 138642;四甲基偶氮唑盐比色法(MTT)试剂购自北京天根生化科技有限公司,货号:3 479924;Annexin V-FITC/PI 试剂盒购自上海煊翎生物科技有限公司,货号:22 875467;RIPA蛋白裂解液、二辛可宁酸(BCA)试剂购自中国碧云天生物技术研究所,货号:1766590,277547;兔抗人细胞周期蛋白1(CyclinD1)、P21、B 淋巴细胞瘤-2(Bcl-2)、B 淋巴细胞瘤-2 相关蛋白(Bax)抗体购自购自美国Santa Cruz 公司,货号:1112903,110963,112093,114598;辣根过氧化物酶(HRP)标记的山羊抗兔二抗购自美国Gibco公司,货号:2 668084;MALAT1小分子干扰RNA(si-MALAT1)、乱序无意义阴性序列(si-NC)、miR-34a 寡核苷酸模拟物(miR-34a mimics)及阴性对照mimic NC 序列(miR-NC)、miR-34a特异性寡核苷酸抑制剂(anti-miR-34a)及其阴性对照(anti-miR-NC)购自广州锐博生物科技有限公司,货号:408642576。
1.3 方法
1.3.1 细胞培养和分组 选对数生长期细胞进行实验。分别将si-NC、si-MALAT1、miR-NC、miR-34a mimics 转染至OCI-Ly8 细胞中,记为si-NC 组、si-MALAT1组、miR-NC组、miR-34a组;将si-MALAT1与anti-miR-NC、si-MALAT1 与anti-miR-34a 共转染至OCI-Ly8细胞,记为si-MALAT1+anti-miR-NC组、si-MALAT1+anti-miR-34a 组。转染过程按照Lipofectamine 2000说明书进行操作。
1.3.2 实时荧光定量PCR(qPCR)检测细胞MALAT1和miR-34a表达 采用TRIzol试剂提取细胞总RNA,以RNA 为模板逆转录合成cDNA。按照qPCR 试剂盒的操作步骤进行扩增。分别以GAPDH和U6 为内参照,按照2-ΔΔCt公式计算MALAT1 和miR-34a的相对表达量。引物序列如下。MALAT1,F:5’-GGTCTCTGTGTCTTCGGAG-3’,R:5’-GGAAAACGCCTCAAT-CCCAC-3’;GAPDH,F:5’-CACTGCCAACGTGTCAGTG-3’,R:5’-GACAAAGTGGTCGTTGAGGG-3’;miR-34a,F:5’-TCGGCAGGAACACT GTCTGGTA-3’,R:5’-CTCAACTGGTGTCGTGGA-3’;U6,F:5’-GCTTCGGCAGCACATATACT-3’,R:5’-GTGCAGGGTCCGAGGTATTC-3’。
1.3.3 MTT 法检测细胞增殖 各组取3×104个/mL的OCI-Ly8 细胞,接种于96 孔板(100 μL/孔),每孔分别加入20 μL 的MTT 溶液,室温孵育4 h,再加入150 μL/孔的二甲基亚砜(DMSO),室温振荡孵育10min,在490nm波长处应用酶标仪检测的OD值。
1.3.4 流式细胞术检测细胞凋亡 取各组OCI-Ly8细胞,预冷的PBS清洗细胞2次,取适量结合缓冲液重悬细胞于流式管内,加入5 μL的Annexin V-FITC,再加入5 μL 的PI 进行染色,避光孵育15 min,流式细胞仪检测细胞凋亡。
1.3.5 双荧光素酶报告实验检测MALAT1 和miR-34a 的靶向关系 利用LncBase Predicted v.2 预测MALAT1和miR-34a的靶向关系。将WT-MALAT1或MUT-MALAT1 与miR-NC、miR-34a 分别转染至OCI-Ly8细胞,转染48 h后,采用双荧光素酶报告基因实验检测细胞荧光素酶活性。
1.3.6 蛋白质印迹(Western blotting)检测细胞蛋白表达 收集细胞,加入RIPA裂解液在冰上裂解30 min,提取细胞总蛋白,BCA法检测蛋白浓度。取蛋白样品进行SDS-PAGE、转膜、封闭后,加入一抗(1∶1 000稀释),4 ℃冰箱孵育过夜,加入二抗(1∶5 000 稀释),室温孵育2 h,ECL发光液显影。
1.4 统计学方法
采用SPSS 21.0 统计学软件分析数据,计量资料以均数±标准差()表示,组间比较采用独立样本t检验,多组间比较采用单因素方差分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 MALAT1和miR-34a在OCI-Ly8细胞中的表达
与对照组比较,DLBCL 组中MALAT1 表达量明显升高,miR-34a表达量明显降低(P<0.05),见表1。
表1 MALAT1和miR-34a在OCI-Ly8细胞中的表达
2.2 抑制MALAT1 表达对OCI-Ly8 细胞增殖和凋亡的影响
与si-NC 组比较,si-MALAT1 组细胞MALAT1表达明显降低(P<0.05);细胞活力、CyclinD1 蛋白、Bcl-2蛋白表达明显降低(P<0.05);细胞凋亡率、P21蛋白、Bax蛋白表达明显升高(P<0.05),见图1、表2。

图1 OCI-Ly8细胞增殖和凋亡
表2 抑制MALAT1表达对OCI-Ly8细胞增殖和凋亡的影响

表2 抑制MALAT1表达对OCI-Ly8细胞增殖和凋亡的影响
2.3 MALAT1和miR-34a的靶向关系
LncBase Predicted v.2预测MALAT1与miR-34a的结合位点,见图2。与miR-NC组比较,miR-34a组野生型载体WT-MALAT1 的荧光素酶活性明显降低(P<0.05),而突变型载体MUT-MALAT1 的荧光素酶活性无明显变化(P>0.05),见表3。
表3 miR-NC组和miR-34a组野生型载体WT-MALAT1、突变型载体MUT-MALAT1的荧光素酶活性比较

表3 miR-NC组和miR-34a组野生型载体WT-MALAT1、突变型载体MUT-MALAT1的荧光素酶活性比较

图2 MALAT1和miR-34a的靶向关系
2.4 干扰miR-34a可逆转抑制MALAT1对OCI-Ly8细胞增殖和凋亡的影响
与si-MALAT1+anti-miR-NC组比较,si-MALAT1+anti-miR-34a 组细胞活力、CyclinD1、Bcl-2 蛋白表达明显升高(P<0.05);细胞凋亡率、P21 蛋白、Bax蛋白表达明显降低(P<0.05),见图3、表4。
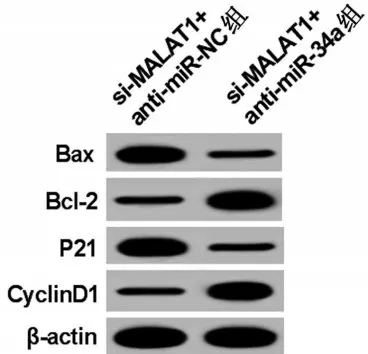
图3 Western blotting检测OCI-Ly8细胞蛋白表达
表4 干扰miR-34a可逆转抑制MALAT1对OCI-Ly8细胞增殖和凋亡的影响
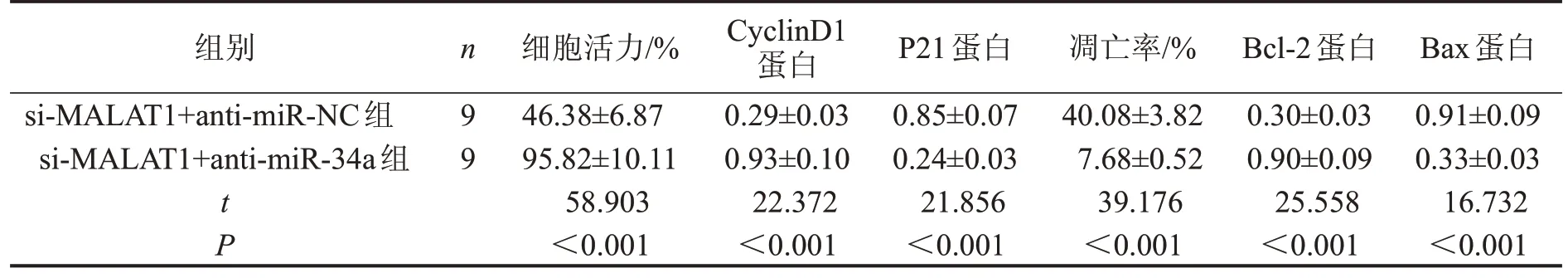
表4 干扰miR-34a可逆转抑制MALAT1对OCI-Ly8细胞增殖和凋亡的影响
3 讨论
DLBCL是血液系统的一种恶性肿瘤,也是NHL的一种,成人最常见的淋巴系统肿瘤,主要指的是细胞核大于2 个正常淋巴细胞的大B 细胞构成的,伴有弥漫生长的肿瘤。常见临床症状是发热、进行性淋巴结肿大和结外肿块[8-9]。LncRNA 靶向miRNA 可以调控肿瘤和癌症的进展,影响其增殖、凋亡、迁移和侵袭。
本实验研究发现,与对照组比较,DLBCL 细胞中MALAT1 表达量明显升高,miR-34a 表达量明显降低。抑制MALAT1 表达,DLBCL 细胞细胞活力明显降低,细胞凋亡率明显升高(P<0.05)。有研究发现,在DLBCL组织中MALAT1表达明显升高,下调MALAT1 表达可抑制DLBCL 细胞增殖[10],与本实验结果一致。黄珊等[11]研究表明,MALAT1 在DLBCL患者中的高表达与多项临床病理参数有关,有望成为判断DLBCL患者预后的标志物。有类似的研究报道,Lnc RNA AK093987在DLBCL中高表达,有可能成为DLBCL 独立的预后肿瘤标志物[12]。李攀等[13]研究发现,LncRNA KCNQ1OT1在DLBCL患者外周血中高表达,并且是DLBCL 患者预后的独立影响因素。
miRNA 是一类长度为20 多个核苷酸的非编码调控RNA,参与细胞增殖、分化、凋亡等一系列生物学过程。研究表明,miRNA 直接参与了DLBCL 的发生、发展。武君等[14]研究结果显示,miR-34a通过靶向FOXP1 表达,进而促进DLBCL 细胞凋亡。类似的研究结果表明,miR-215在DLBCL患者病理组织中低表达,miR-215 靶向抑制KDM1B 表达,抑制DLBCL细胞增殖,促进细胞的凋亡[15]。闻淑娟等[16]研究显示,下调miR-9 通过靶向FOXP1 促进DLBCL 细胞的增殖和侵袭。王馨瑗[17]研究发现,血清miR-155、miR-15a、miR-16-1 与DLBCL 近期疗效,临床分期密切相关,有望成为DLBCL 新一代肿瘤标记物。
本实验结果表4证明,细胞活力明显升高,细胞凋亡率明显降低(P<0.05),说明干扰miR-34a可逆转抑制MALAT1 对DLBCL 细胞增殖和凋亡的影响。LncRNA 与DLBCL 关系的联系十分密切[18]。已经文献报道,LncRNA SNHG8通过海绵miR-335-5p促进DLBCL的增殖并抑制其凋亡[19]。
综上所述,MALAT1在DLBCL细胞中高表达,miR-34a在DLBCL细胞中低表达,抑制MALAT1通过上调miR-34a表达抑制DLBCL细胞增殖,促进凋亡,为该疾病的治疗提供理论依据。
