circ_0030018靶向miR-1298抑制急性淋巴细胞白血病细胞KOCL44增殖和诱导其凋亡的实验研究*
2021-11-13刘天民陈婷婷吴舒懋左立旻
杨 璇,刘天民,陈婷婷,刘 青,吴舒懋,左立旻△
(1.四川电子科技大学医学院附属妇女儿童医院 成都市妇女儿童中心医院急诊科,成都 611731;2.四川大学华西第二医院病理科,成都 610041;3.四川电子科技大学医学院附属妇女儿童医院 成都市妇女儿童中心医院儿童心血管科,成都 611731)
急性淋巴细胞白血病(ALL)是儿童和青少年发病率较高的恶性肿瘤,以白血病细胞在骨髓大量聚集,骨髓正常造血功能受到抑制为特征[1]。虽然化疗在一定程度上提高了ALL 患儿的长期无病生存率,但依然有部分患者对化疗敏感性低,或者缓解后出现复发,预后不甚理想[2]。因此,全面了解ALL进展的潜在机制,寻找抑制ALL 细胞增殖、诱导其的凋亡方法有助于开发有效的ALL 防治策略。环状RNA(circRNA)是一类具有典型封闭环状结构的非编码RNA,其长度介于100 到数千个核苷酸之间,其可与微小RNA(miRNA)结合,在功能上抑制miRNA 从而恢复miRNA 靶基因mRNA 表达,参与细胞多个生物学过程,与包括ALL在内的人类疾病进展息息相关[3]。研究发现circRNA 0030018(circ_0030018)在食管癌中表达增加,沉默circ_0030018通过上调miR-599 可抑制食管癌细胞增殖、迁移和上皮间质转化(EMT)过程[4]。但circ_0030018 在ALL 中的表达和功能目前尚不清楚。把基因预测到miR-1298 是circ_0030018 的潜在靶点。研究报道miR-1298 低表达与胃癌患者淋巴结转移、TNM分期有关,并预示胃癌患者无病生存期和总生存期较差[5]。miR-1298下调还可预测非小细胞肺癌患者的不良预后,过表达miR-1298对非小细胞肺癌的发生具有抑制作用[6]。基于上述已有研究,本研究分析了ALL 患者骨髓组织中circ_0030018 和miR-1298 表达水平,研究circ_0030018 对ALL 细胞KOCL44增殖、凋亡的影响,并以miR-1298为切入点探讨其分子机制,旨在为临床治疗ALL 提供有效靶点。
1 材料与方法
1.1 组织来源
本研究所有组织样本来源于2017 年7 月至2019年12月在本院血液肿瘤科就诊的23例ALL患儿的骨髓组织。23 例ALL 患儿均为初诊ALL 患儿,男13 例,女10 例,年龄2.3~14.5 岁,中位年龄10.0岁。同时期招募23健康志愿者作为对照组,其中男13 例,女10 例,中位年龄10.5 岁。对照组和ALL 组比较年龄、性别差异无统计学意义(P>0.05),具有可比性。本研究获得本院医学伦理委员会的批准,所有受试者监护人均签署知情同意书。
1.2 细胞和试剂
人ALL 细胞KOCL44 购于美国限定培养物保藏中心;RPMI-1640培养液购于美国Gibco公司;Lipofectamine 2000 购于美国Invitrogen 公司;Prime-Script 逆转录试剂盒购于日本Takara 公司;通用型SYBR qPCR Master Mix 购于南京诺唯赞生物科技公司;小干扰RNA(si-RNA)、miRNA 模拟物(mimics)、miRNA抑制物(anti-miRNA)、重组荧光素酶质粒购于上海生工生物公司;细胞计数试剂盒(CCK-8)购于福州飞净生物科技公司;miRNA逆转录试剂盒、膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)/碘化丙啶(PI)凋亡检测试剂盒购于北京百奥莱博生物公司;兔抗人裂解的半胱氨酸蛋白酶3(cleavedcaspase-3)多克隆抗体、兔抗人cleaved-caspase-9 单克隆抗体、兔抗人磷酸甘油醛脱氢酶(GAPDH)多克隆抗体、山羊抗兔IgG二抗购于美国Abcam公司。
1.3 方法
1.3.1 实时定量PCR(qPCR)检测circ_0030018 和miR-1298 表达 ALL 组于治疗前采集骨髓4 mL,对照组于入院时采集骨髓4 mL,加入EDTA抗凝保存备用。用TRIzol 试剂从ALL 患者和健康志愿者骨髓组织中提取总RNA,然后使用PrimeScript逆转录试剂盒、miRNA 逆转录试剂盒将其反转录为cDNA。RT-qPCR 分析采用通用型SYBR qPCR Master Mix 进行。反应条件:95 ℃30 s;95 ℃10 s,60 ℃30 s,40 个循环。以GAPDH 为circ_0030018的内参,以U6为miR-1298的内参,采用2-ΔΔCt公式分析circ_0030018和miR-1298相对表达水平。
1.3.2 细胞的培养、转染和分组 KOCL44 细胞接种到12%胎牛血清的RPMI-1640 培养液中,在37 ℃、饱和湿度、含5% CO2培养箱内培养。取2×105个对数期KOCL44细胞接种到6孔板,参照Lipofectamine 2000 说明书转染si-RNA、miRNAs,最终浓度为100 nmol/L。转染48 h后,收集细胞进行进一步分析。实验分组如下:si-NC 组(转染si-NC)、si-circ_0030018 组(转染si-circ_0030018)、miR-NC组(转染miR-NC)、miR-1298 组(转染miR-1298 mimics)、si-circ_0030018+anti-miR-NC 组(转染sicirc_0030018与anti-miR-NC)、si-circ_0030018+antimiR-1298 组(转 染si-circ_0030018 与anti-miR-1298)。
1.3.3 平板克隆实验检测细胞克隆能力 按照5×102个/孔的密度接种细胞到6孔板,米字型转动平板均匀分散细胞。放入培养箱孵育10~14 d,当出现细胞集落时终止培养。分别用4%多聚甲醛、0.1%结晶紫对细胞集落进行固定和染色。用流水缓慢冲去染色液,空气干燥。在显微镜下计数大于50个细胞的集落形成数。
1.3.4 CCK-8 法检测细胞活力 取5×103个KOCL44细胞接种96孔板上,常规培养48 h,每孔加入10 μL CCK-8 试剂,细胞再孵育2 h,细胞活力以酶标仪测得的450 nm处的光密度(OD)值表示。
1.3.5 流式细胞术检测细胞凋亡率 PBS漂洗KOCL44 细胞两次,加入1×结合缓冲液调整细胞密度为1×106个/mL。取100 μL 细胞悬液加入到流式管内,加入5 μL 的Annexin V-FITC 和PI,暗室染色15 min。流式细胞仪分析细胞凋亡情况。
1.3.6 蛋白质印记法检测cleaved-caspase 3和cleavedcaspase 9 蛋白表达 向KOCL44 细胞中加入RIPA缓冲液,于冰上裂解细胞提取总蛋白,BCA 法进行蛋白定量。按照4∶1 比例将蛋白样品与5×上样缓冲液混匀,沸水浴3 min 变性蛋白。蛋白(30 μg/泳道)用10%十二烷基硫酸钠—聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,通过标准湿式转膜仪转移蛋白至硝酸纤维素膜。将膜在5%脱脂牛奶中在室温下封闭1 h。TBST洗涤后,用以下一抗4 ℃孵育过夜:抗cleaved-caspase-3 抗体(1 µg/mL)、cleaved-caspase-9 抗体(1:500)、内参GAPDH 抗体(1:2 500)。TBST 洗涤后,用1:2 000 的IgG 二抗室温孵育1 h。用吸水纸吸去膜上过多液体,放在保鲜膜上,滴加化学发光试剂孵育2 min。采用化学发光成像仪分析目的蛋白表达量。
1.3.7 双荧光素酶报告实验 将含有miR-1298 假定结合位点的circ_0030018 野生型(WT)序列或突变型(MUT)序列克隆到pGL3 载体中,命名为WTcirc_0030018 或MUT-circ_0030018。使 用Lipofectamine 2000 将miR-1298 mimics、miR-NC 与WTcirc_0030018或MUT-circ_0030018共转染细胞。转染48 h后,根据双荧光素酶报告基因检测系统说明书测定细胞的相对荧光素酶活性。
1.4 统计学方法
采用SPSS 20.0 软件进行数据处理,每组设置3个复孔,实验独立重复3次,实验数据以均数±标准差()表示。两组间比较采用独立样本t检验,多组比较采用单因素方差分析,组间两两比较,采用LSD-t检验。以P<0.05为有统计学意义。
2 结果
2.1 circ_0030018 和miR-1298 在ALL 组和对照组单核细胞中的表达
与对照组相比,ALL组骨髓组织中circ_0030018表达量显著升高(P<0.05),miR-1298 表达量显著降低(P<0.05)。见图1。
2.2 干扰circ_0030018 表达对ALL 细胞KOCL44增殖和凋亡的影响
与si-NC组比较,si-circ_0030018组KOCL44细胞circ_0030018 表达量、细胞OD 值、克隆形成数显著下降(P<0.05),凋亡率、cleaved-caspase 3 和cleaved-caspase 9 蛋白表达量显著升高(P<0.05),见图2。
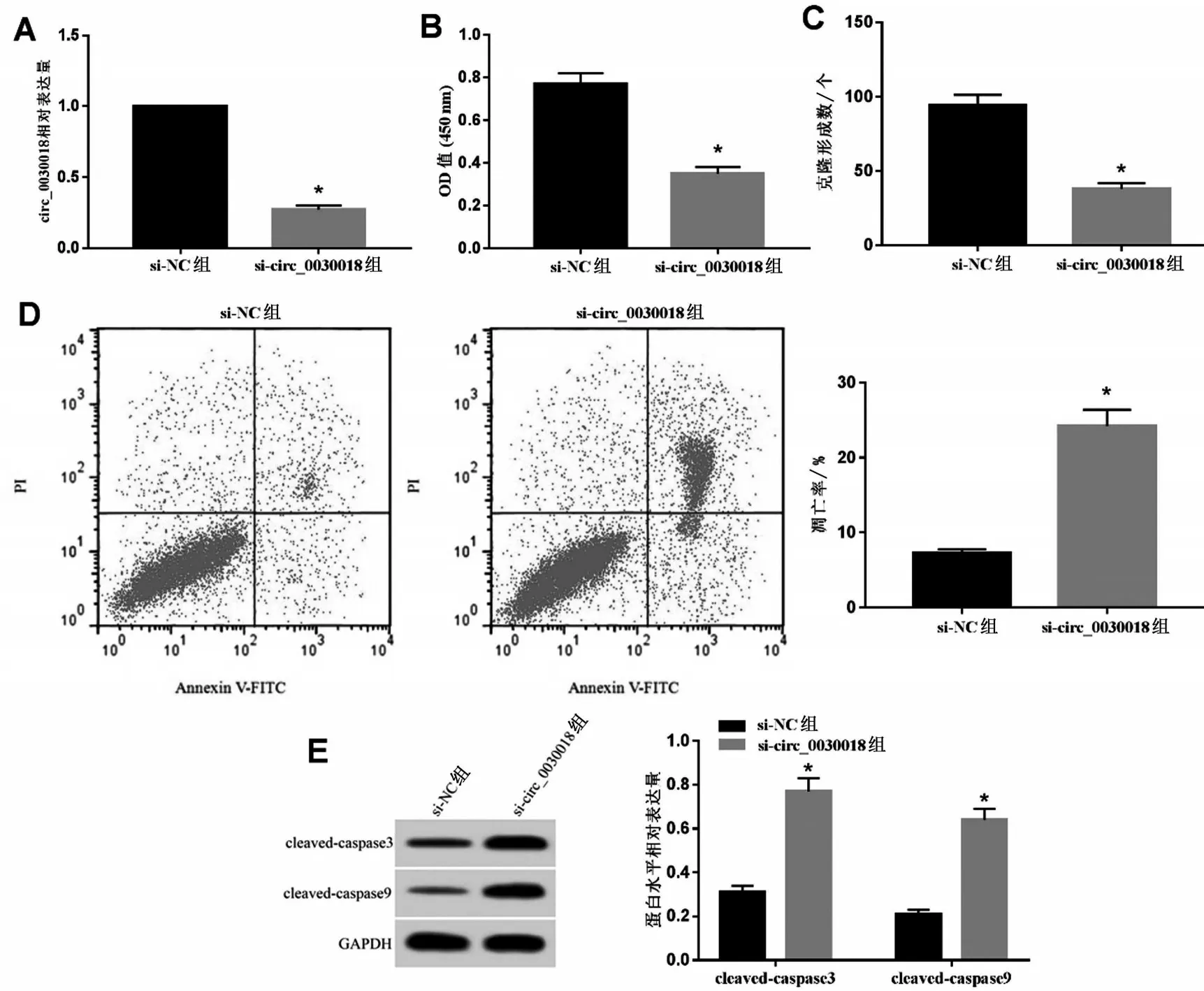
图2 干扰circ_0030018表达对ALL细胞KOCL44增殖和凋亡的影响
2.3 miR-1298 过表达对ALL 细胞KOCL44 增殖和凋亡的影响
与miR-NC 组比较,miR-1298 组KOCL44 细胞miR-1298表达量、凋亡率、cleaved-caspase 3 和cleaved-caspase 9 蛋白表达量显著升高(P<0.05),细胞活力、克隆形成数显著下降(P<0.05)。见图3。

图3 miR-1298过表达对ALL细胞KOCL44增殖和凋亡的影响
2.4 circ_0030018靶向调控miR-1298的表达
Circular RNA Interactome 预测到circ_0030018与miR-1298 序列间存在互补位点,见图4A。双荧光素酶报告实验显示,同与WT-circ_0030018 共转染,miR-1298组KOCL44细胞的相对荧光素酶活性显著低于miR-NC 组(P<0.05);同与MUT-circ_0030018 共转染,miR-1298 组KOCL44 细胞的相对荧光素酶活性与miR-NC 组比较无明显变化(P>0.05),见图4B。pcDNA-circ_0030018 组KOCL44细胞miR-1298 表达量显著低于pcDNA 组(P<0.05);si-circ_0030018 组KOCL44 细胞miR-1298 表达量显著高于si-NC组(P<0.05),见图4C。
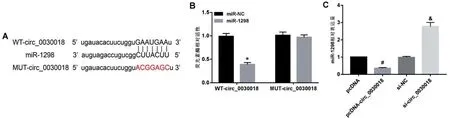
图4 circ_0030018靶向调控miR-1298的表达
2.5 抑制miR-1298 表达逆转了干扰circ_0030018表达对ALL细胞KOCL44增殖和凋亡的作用
与si-circ_0030018+anti-miR-NC组比较,sicirc_0030018+anti-miR-1298 组KOCL44 细胞miR-1298 表达量、凋亡率、cleaved-caspase 3 和cleavedcaspase 9 蛋白表达量显著降低(P<0.05),细胞活力、克隆形成数显著升高(P<0.05),见图5。

图5 抑制miR-1298表达逆转了干扰circ_0030018表达对ALL细胞KOCL44增殖和凋亡的作用
3 讨论
与长链非编码RNA不同,circRNA主要由前体RNA反向剪切形成,具有高度稳定性和组织分布特异性,在人类癌中可能作为潜在的预后、诊断标记物和治疗靶点。研究发现通过分析circ_0012152和circ_0001857表达能够准确区分ALL和急性髓系白血病[7]。ALL 细胞中circ_0000745 上调可通过激活细胞外信号调节激酶(ERK)通路增加ALL 细胞活力、降低细胞凋亡率[8]。circRNA浆细胞瘤多样异位基因1(circPVT1)在ALL 骨髓样本中高表达,沉默circPVT1通过抑制其原癌基因c-Myc和抗凋亡蛋白B 细胞淋巴瘤-2(Bcl-2)表达来抑制细胞增殖,诱导细胞凋亡[9]。本研究探讨了circ_0030018 在ALL 进展中的作用,结果表明ALL 患者骨髓组织中circ_0030018表达显著上调,提示circ_0030018表达增加可能促进ALL 进展。进行功能缺失实验验证circ_0030018 功能,结果表明转染si-circ_0030018 干扰circ_0030018 表达显著降低KOCL44 细胞活力和克隆形成能力,增加细胞凋亡。与本研究中干扰circ_0030018 的抗癌作用一致,Song 等[10]指出胶质瘤组织、细胞中circ_0030018 表达增加,干扰circ_0030018阻碍了胶质瘤细胞的增殖、迁移和侵袭,加速了细胞凋亡。当受到凋亡刺激时线粒体释放的细胞色素C 会介导caspase 9 激活,活化的caspase 9进一步加工其他caspase成员,启动caspase级联,进而导致细胞凋亡,因此cleaved-caspase 9 和cleavedcaspase 3 常被用作细胞凋亡的重要标记物[11-12]。本研究中干扰circ_0030018显著增加cleaved-caspase 9和cleaved-caspase 3 蛋白表达水平,这与干扰circ_0030018的促凋亡作用吻合。
miR-1298在多种恶性肿瘤中广泛下调,具有抑癌因子作用。研究发现胶质瘤组织中miR-1298-5p低表达,与胶质瘤患者的高组织学分级显著相关,可预测预后不良[13]。miR-1298 的下调与乳腺癌患者晚期进展显著相关,过表达miR-1298可抑制乳腺癌细胞增殖,诱导凋亡和细胞周期停滞[14-15]。miR-1298 通过下调黏着斑激酶(FAK)和层粘连蛋白亚基β3(LAMB3)抑制突变型鼠类肉瘤病毒癌基因(KRAS)驱动的肿瘤生长[16]。膀胱癌中miR-1298亦呈低表达,miR-1298通过靶向下调连接蛋白3(Cx43)表达明显抑制膀胱癌细胞的恶性表型[17]。与上述发现类似,本研究证实miR-1298 在ALL 患者骨髓组织中表达下调,转染miR-1298 mimics 过表达miR-1298降低了KOCL44细胞的活力和克隆形成能力,增加cleaved-caspase 9和cleaved-caspase 3蛋白表达量,诱导细胞凋亡,表明miR-1298 在膀胱癌中具有肿瘤抑制功能。进一步研究显示,miR-1298是circ_0030018 的直接下游靶点,且miR-1298 受到circ_0030018的负性调控。由于过表达miR-1298与干扰circ_0030018 在ALL 中抗癌作用一致,本研究推测KOCL44细胞中可能存在circ_0030018/miR-1298调控途径。深入分析发现,抑制miR-1298表达能够明显削弱干扰circ_0030018对KOCL44细胞增殖的增殖抑制和凋亡促进作用,这表明干扰circ_0030018通过靶向上调miR-1298 表达抑制ALL 进展。然而,本研究仍存在一些不足,是否存在其他miRNA参与circ_0030018调控ALL进展,miR-1298的下游靶点仍需要进一步研究。
综上,干扰circ_0030018 可抑制ALL 细胞KOCL44增殖,诱导细胞凋亡,其机制与靶向上调miR-1298表达有关,这表明circ_0030018/miR-1298有望成为临床治疗ALL的新型靶点。
