白藜芦醇抑制HIF-1α对肾癌细胞线粒体功能及抗乏氧增殖的调控*
2021-11-13杨清滔赵治国张永春
杨清滔,谷 江△,赵治国,张永春
(1.贵州医科大学附属医院泌尿外科,贵阳 550004;2.贵州医科大学附属白云医院泌尿外科,贵阳 550014;3.武警贵州总队医院外二科,贵阳 550002)
恶性肿瘤细胞侵袭性、异型性的生理特性可导致细胞内相对乏氧环境产生[1]。缺氧可刺激癌细胞内缺氧诱导因子-1α(HIF-1α)表达升高,且上调HIF-1α 表达可促进癌细胞在缺氧环境下增殖[2-4]。研究表明,减弱HIF-1α 的功能可明显抑制肾癌细胞增殖[5]。白藜芦醇(resveratrol,Res)是广泛存在于葡萄、花生和多种传统中药中的一种多酚类化合物,对HIF-1α 有明显的抑制作用[6],具有降血脂、抗炎、抗氧化及抑制肿瘤细胞增殖、转移和促进凋亡等生物学功能[7-9]。但Res对肾癌细胞抗乏氧增殖的作用及其机制目前尚未完全阐明。本研究用不同浓度Res 干预肾癌细胞,观察常氧和缺氧环境下肾癌细胞的增殖情况、线粒体功能相关指标变化以及HIF-1α 的表达,探讨Res 在肾癌细胞抗乏氧增殖过程中的机制。
1 材料与方法
1.1 细胞和主要试剂 人肾癌GRC-1 细胞株购于上海弗雷堡生物公司。二氯化钴购于成都科龙化工试剂厂;Res 购于Sigma 公司;总RAN 提取试剂盒、逆转录试剂盒、PCR MasterMix 均购于Fermentas 公司;酶联免疫吸附试验(ELISA)试剂盒购于R&D 公司;Fura-2/AM 钙离子探针购于碧云天生物技术研究所。
1.2 细胞分组及处理 将肾癌GRC-1 细胞分为正常组和缺氧组,缺氧组用150 μmol/L 二氯化钴干预GRC-1细胞48 h[10],构建缺氧GRC-1细胞模型,正常组在正常氧环境下培养。两组培养基中各加入不同浓度(0 μmol/L、20 μmol/L、40 μmol/L 和60 μmol/L)Res进行干预。
1.3 RT-qPCR 法检测HIF-1α 基因表达 提取细胞总RNA,逆转录成cDNA,在PCR 仪器(Eppendorf Mastercycler gradient,22331 型,德国)上进行PCR扩增反应。PCR反应条件:预变性94 ℃3 min;变性94 ℃30 s,退火30 s,退火温度均为53 ℃,延伸72 ℃1 min,共35个循环;终止反应72 ℃5 min。引物序列:β-actin 正向:5’-CCCTGGACTTCGAGCAAGAGAT-3’,反向:5’-GTTTTCTGCGCAAGTTAGG-3’,片段长度531 bp;HIF-1α 正向:5’-TCCAGCAGACTCAAATACAAGAAC-3’,反向:5’-GTATGTGGGTAGGAGATGGAG ATG-3’,片段长度130 bp。以β-actin作为内参,所得条带经Image J软件进行灰度分析,以目的基因条带灰度值与内参条带灰度值的比值代表目的基因的相对表达量。
1.4 HIF-1α 蛋白表达检测 采用苯甲基磺酰氟与细胞裂解液裂解各组细胞,12 000 r/min离心5 min,取上清,采用ELISA 法检测细胞HIF-1α 蛋白表达。检测过程严格按照试剂盒说明书进行操作。
1.5 MTT法检测细胞的增殖活性 细胞接种于96孔板,培养24 h 后每孔加入80 μL 无血清培养基和20 μL MTT溶液,37 ℃孵育4 h后弃去孔内液体,加入150 μL 二甲基亚砜,低速震荡10 min 后,用酶标仪检测490 nm波长处的吸光度(OD)值。
1.6 荧光探针检测细胞内钙离子含量 分组处理各组细胞,1 000 r/min 离心5 min,弃上清,用DHanks 液重悬细胞,再加入Fura-2/AM,37 ℃避光孵育45 min,再用D-Hanks 液洗涤细胞2 次,3 mL DHanks液重悬细胞。荧光分光光度计激发波长分别为340 nm、380 nm,发射波长510 nm 双波长测定负载探针细胞的荧光强度。
1.7 线粒体的提取及形态学鉴定 使用细胞裂解液裂解细胞,4 000 r/min 离心10 min,取上清;10 000 r/min 离心15 min,弃上清,收集沉淀为线粒体。将刚提取的线粒体均匀涂于载玻片上,加0.02%詹纳斯绿B 染液,覆盖玻片浸染10 min,用高倍镜(400×)观察线粒体形态。
1.8 线粒体通透性转换孔(mPTP)开放程度检测 提取两组线粒体悬液,加入测定介质P(甘露醇230 mmol/L、蔗糖70 mmol/L、Hepes 3 mmol/L,pH值7.4)至3 mL,摇匀,另取3 mL 测定介质P 作为空白对照。mPTP开放可使线粒体内膜对甘露醇及蔗糖高通透性导致线粒体发生膨胀,此时线粒体OD值降低,故可通过检测OD的变化来间接反映mPTP的开放程度。检测过程严格按照试剂盒(上海亨代劳生物有限公司)说明书进行操作。用752N 型紫外分光光度计(青岛聚创环保集团有限公司)测定540 nm 波长处的OD值。OD值越高,mPTP开放程度越低。
1.9 线粒体膜电位(Δψm)检测 采用罗丹明123法检测Δψm:在离体组织线粒体中,Δψm 摄取罗丹明123 导致荧光淬灭,并随着Δψm 去极化,罗丹明123 荧光强度逐渐增强,故可通过检测罗丹明123荧光强度变化来间接反映Δψm。检测过程严格按照试剂盒(上海远慕生物公司)说明书进行操作。用Cary Eclipse 荧光分光光度计检测激发光480 nm、发射光525 nm 波长下Rh 123 的荧光强度。荧光强度越高,Δψm越低。
1.10 统计学方法 采用SPSS 19.0 统计软件分析数据,计量资料以均数±标准差()表示,组间比较采用单因素方差分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 Res干预后两组GRC-1细胞增殖活性比较 Res 能显著抑制两组GRC-1 细胞增殖(均P<0.05),两组细胞活力均随Res浓度的增加而逐渐降低(P<0.05),但缺氧组细胞活力下降趋势明显缓于正常组,且缺氧组在不同浓度Res 干预下的细胞活力均显著高于相同浓度正常组(均P<0.05),见图1。
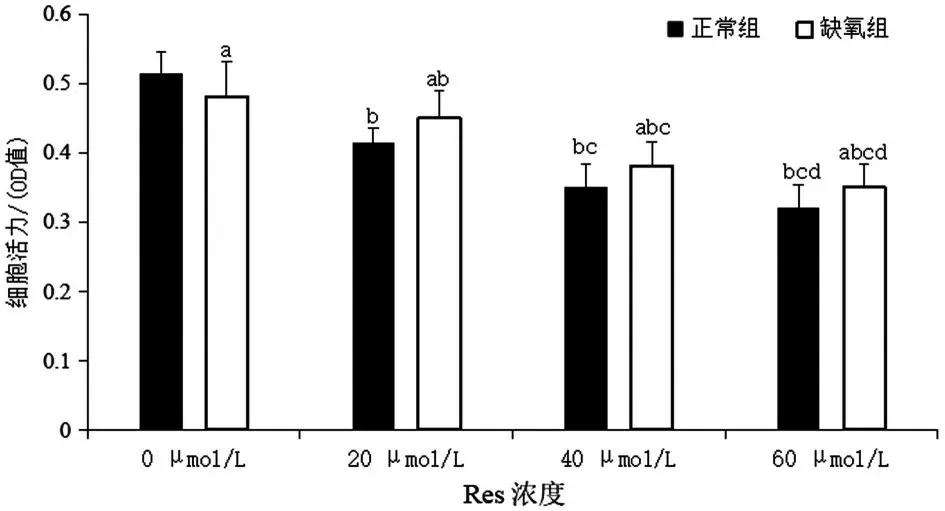
图1 Res对GRC-1细胞增殖活性的影响
2.2 Res 干预后两组GRC-1 细胞HIF-1α 基因及蛋白表达比较 两组HIF-1α 基因及蛋白表达量均随Res浓度的增加而逐渐降低(均P<0.05),缺氧组不同浓度Res 干预后HIF-1α 基因及蛋白表达量均显著高于相同浓度正常组(均P<0.05),见表1。
表1 Res 干预后两组GRC-1 细胞HIF-1α 基因及蛋白表达量比较

表1 Res 干预后两组GRC-1 细胞HIF-1α 基因及蛋白表达量比较
与正常组同一浓度比较,aP<0.05;与本组0 μmol/L 比较,bP<0.05;与本组20 μmol/L比较,cP<0.05;与本组40 μmol/L比较,dP<0.05。
2.3 线粒体形态学鉴定 詹纳斯绿B 染色结果显示,提取的线粒体呈现圆形、椭圆形和杆状的蓝绿色颗粒,见图2。

图2 线粒体的詹纳斯绿B染色(400×)
2.4 Res干预后两组GRC-1细胞内钙离子含量、荧光强度及OD值比较 两组细胞内钙离子含量均随Res 浓度的增加而逐渐升高(均P<0.05),缺氧组20 μmol/L、40 μmol/L的Res干预后细胞内钙离子含量显著高于相同浓度正常组(均P<0.05);荧光强度越高,Δψm越低。两组Δψm均随Res浓度的增加而逐渐降低(均P<0.05),缺氧组不同浓度Res干预后Δψm 均显著低于相同浓度正常组(均P<0.05);OD 值越高,mPTP 开放程度越低。两组mPTP 开放程度均随Res浓度的增加而逐渐升高(均P<0.05),缺氧组不同浓度Res干预后mPTP开放程度均显著高于相同浓度正常组(均P<0.05),见表2。
表2 Res干预后两组GRC-1细胞内钙离子含量、荧光强度及OD值比较

表2 Res干预后两组GRC-1细胞内钙离子含量、荧光强度及OD值比较
与正常组同一浓度比较,aP<0.05;与本组0 μmol/L 比较,bP<0.05;与本组20 μmol/L 比较,cP<0.05;与本组40 μmol/L比较,dP<0.05。
3 讨论
与正常细胞比较,恶性肿瘤需要更多氧及能量维持其异常增殖及恶性倾向,其细胞间乏氧微环境不可避免,乏氧可诱导细胞内HIF-1α 稳定表达,继而激活下游多种靶基因参与对乏氧的局部和整体调节[2];同时,乏氧导致的细胞内钙超载会增加不溶性磷酸钙含量[11],下调呼吸链电子传递速度,促氧化磷酸化解偶联,影响线粒体功能[12]。线粒体作为氧化磷酸化“能量工厂”,是细胞维持正常生理功能的结构基础;正常情况下,线粒体以电化学势能方式将其能量储存于线粒体内膜,偶联与ATP生成的质子转运引起线粒体膜两侧离子的不均匀分布,从而形成Δψm,而Δψm 又取决于线粒体内外的离子梯度,其中细胞内Ca2+起着关键性作用。Ca2+作为胞内介导信号传导的重要信使,与线粒体离子平衡、阴离子蛋白交换、电荷转移等密切相关[13],并参与调控作为线粒体关键枢纽的mPTP,亦影响Δψm,且与肿瘤发生发展关系密切[14]。Lemasters 等[15]研究表明,肿瘤由于细胞自身代谢高、相对乏氧环境等因素使其持续存在氧化应激,导致钙超载,进而诱发mPTP开放,但持续开放的mPTP又将导致Δψm降低或丧失。故本实验采用二氯化钴构建缺氧GRC-1 细胞模型,并使用Res干预正常组和缺氧组细胞,通过观察线粒体功能相关指标mPTP、Δψm、钙离子变化水平,初步探讨Res 参与肾癌细胞抗乏氧增殖的可能发生机制。
本实验首先构建了缺氧GRC-1细胞模型,检测正常组和缺氧组细胞内HIF-1α基因及蛋白表达,结果发现缺氧组显著高于正常组,说明缺氧可诱导GRC-1 细胞表达HIF-1α 增加,这与既往研究[4]结果相符。当给予不同浓度Res 干预正常组和缺氧组GRC-1细胞,发现细胞内HIF-1α基因及蛋白表达逐渐降低,且相同浓度下缺氧组明显高于正常组,这与缺氧诱导HIF-1α表达增加,而Res对HIF-1α抑制作用结果相吻合。本研究进一步提取细胞线粒体,检测mPTP、Δψm、钙离子,发现随着Res干预浓度的增加,正常组和缺氧组GRC-1细胞内钙离子含量逐渐升高,mPTP 逐渐开放,Δψm 逐渐降低,且变化程度缺氧组明显高于正常组;然而MTT 结果提示,正常组和缺氧组GRC-1细胞增殖活性在Res干预后均表现出明显下降作用,但缺氧组下降趋势明显缓于正常组,且缺氧组细胞在不同浓度Res 干预下的增殖活性均显著高于相同浓度正常组。
本研究中,正常组细胞随着Res 干预浓度的增加,HIF-1α 表达水平逐渐下降,细胞内钙离子含量逐渐升高,Res 对GRC-1 细胞的抑制作用可能是通过增加细胞内钙离子含量,诱导mPTP 开放,降低Δψm,使线粒体解偶联功能受损,抑制产能而实现;但HIF-1α 是使细胞抗乏氧的有利基因,Res 升高钙离子的同时也抑制了HIF-1α,而缺氧又促进HIF-1α表达,该作用逐渐拮抗了Res 抑制HIF-1α 表达效能,故缺氧组Res 对细胞的抑制作用弱于正常组。由此推测:Res可能通过上调细胞内钙离子含量,使mPP开放,ΔΨm降低,使线粒体解偶联功能受损,从而抑制细胞增殖,但该抑制作用随着Res 对HIF-1α的进行性抑制而逐渐减弱,该作用可能参与了肾癌细胞的抗乏氧增殖机制。
本研究观察到Res 能抑制HIF-1α 表达,并升高细胞内钙离子水平,从mPTP开放、Δψm降低层面探讨了线粒体结构及功能变化,但本实验尚不能明确Res对钙离子水平调节后是通过何种途径作用于线粒体,本组将引入相关抑制剂或激动剂处理后深入研究其可能的发生机制。
