miR-372靶向LATS2对结肠癌SW620细胞增殖、迁移侵袭的影响*
2021-11-13姚春和
姚春和,张 荣
(陕西省延安大学咸阳医院 1.普通外科一病区 2.消化内科二病区,咸阳 712000)
结肠癌是我国常见的高发性消化系统恶性肿瘤,近年来其发病率和死亡率均有明显攀高趋势[1]。结肠癌中存在着许多异常表达的微小RNAs(microRNAs,miRNAs),而这些miRNAs 可通过调控多种靶基因影响细胞增殖、侵袭和迁移等生物学功能[2-4]。已有研究证实,miR-372 在结肠癌组织和血液中高表达,与肿瘤大小和肿瘤结节转移有关,且与大肿瘤抑制同系物2(large tumor suppressor homolog 2,LATS2)之间存在负相关关系[5-6];而LATS2在结肠癌恶性进展中发挥着重要的抑制作用[7]。有研究指出,miR-372 可通过靶向调控LATS2 表达促进乳腺癌细胞增殖,而抑制miR-372 表达可通过调控LATS2 表达抑制前列腺癌细胞增殖和迁移[8-9]。猜测miR-372可能通过靶向调控LATS2促进结肠癌恶性进展。因此,本研究以人结肠癌SW620细胞为研究对象,通过观察miR-372 与LATS2 的靶向关系,探讨miR-372靶向调控LATS2对SW620细胞增殖、侵袭和迁移的影响,旨在阐明miR-372在结肠癌中的作用及其机制。
1 材料与方法
1.1 主要试剂与仪器 人结肠癌细胞株SW620 购于美国ATCC,miR-372模拟物及其阴性对照购于广州锐博生物。脂质体2000 和PVDF 膜购于美国Invitrogen 公司,MTT 试剂、青霉素-链霉素溶液(100×)、ECL 显色液、辣根过氧化物酶标记山羊抗兔IgG、BCA 定量试剂盒和荧光素酶试剂盒购于碧云天生物技术有限公司,二甲基亚砜购于南京凯基生物公司。PrimeScript™反转录试剂盒和SYBR Premix Ex Taq 试剂盒购于TaKaRa 公司,Transwell小室购于美国BD Bioscience 公司,CO2培养箱购于美国Thermo Scientific 公司,pLV-LATS2 慢病毒载体质粒购于上海吉凯基因化学技术公司,兔抗人LATS2抗体购于英国Abcam公司,兔抗人β-actin抗体购于武汉博士德公司。PCR 引物由上海生工设计合成。
1.2 SW620细胞培养与转染 将冻存的SW620细胞以温水浴解冻复苏后,以DEME 完全培养基(含10%胎牛血清、1%青链霉素)于37 ℃、饱和湿度、含5% CO2培养箱内常规培养。将对数生长期的SW620 细胞以适当密度接种至6 孔细胞板上,培养箱过夜培养。将其分为对照组(未处理)、miR-NC组(转染miR-372模拟物阴性对照)、miR-372组(转染miR-372 模拟物)、pLV-LATS2 组(转染pLVLATS2 质粒)和miR-372+LATS2 组(转染miR-372模拟物和pLV-LATS2 质粒)。待细胞融合度超过75%时,参照脂质体2000 说明书步骤将miR-372 模拟物及其对照和pLV-LATS2 质粒转染至SW620 细胞中。
1.3 实时荧光定量PCR(qPCR)检测miR-372 和LATS2 mRNA 的表达 胰蛋白酶收集转染48 h 后的miR-372组、miR-NC组和对照组细胞,Trizol法提取总RNA,紫外分光光度计法测定总RNA 浓度。以1 µg RNA 为模板利用PrimeScript™反转录试剂盒合成单链cDNA。再以cDNA 为模板利用SYBR Premix Ex Taq 在ABI 7500 型PCR 仪上进行PCR 扩增。反应体系:SYBR Premix Ex Taq™Ⅱ(2×)12.5 μL,上游引物(10 μmol/L)1 μL,下游引物(10 μmol/L)1 μL,DNA 模板2 μL,灭菌蒸馏水8.5 μL,配置25 μL反应体系。反应条件:预变性95 ℃30 s;然后在95 ℃5 s 和60 ℃30 s,共40 个循环。miR-372 上游引物:5’-TCGACAAAGTG CTGC GACATTT-3’,下 游:5’-CTCAACTGGTGTCGTGGAGTCGGC-3’;U6 上游引物:5’-CGCTTCGGCA GCACATATAC-3’,下游:5’-TTCACGAATTTGCGTGTCAT-3’;LATS2 上游引物:5’-TGGCACCTAC TCCCACAG-3’,下游:5’-CCAAGGGCTTTCTTCATCT-3’;GAPDH 上游引物5’-TCATGGGTGTGA ACCATGAGAA-3’,下游:5’-GGCATGGACTGTGGTCATGAG-3’。采用2-ΔΔCt法计算miR-372 和LATS2 mRNA 的相对表达量。
1.4 荧光素酶实验测定 TargetScan软件在线预测显示miR-372与LATS2的3’UTR存在结合位点,为了验证miR-372 与LATS2 有无靶向关系,构建LATS2 3’UTR 的野生型(LATS2-WT)、突变型(LATS2-MUT)荧光数酶报告载体。参照转染试剂脂质体2000 说明书步骤行miR-NC+LATS2-WT、miR-NC+LATS2-MUT、miR-372+LATS2-MUT 和miR-372+LATS2-MUT 四组共转染,收集转染48 h各组细胞测定细胞的荧光素酶活性。
1.5 Western blotting 检测LATS2 蛋白的表达 胰蛋白酶消化收集转染48 h 后的miR-372 +LATS2组、pLV-LATS2 组、miR-372 组和对照组细胞,蛋白裂解液于冰上裂解细胞20 min以提取总蛋白,随后按照BCA试剂盒说明书进行蛋白定量。按照5×上样缓冲液:蛋白体积=1:4 比例加入上样缓冲液,于沸水中煮5 min 变性。将蛋白样品以每孔60 μg 上样至SDS-PAGE凝胶孔中,先以80 V电压行蛋白浓缩30 min,再以120V电压行蛋白分离70 min。接着以100 V 电压转PVDF 膜70 min。采用含去脂奶粉的封闭液摇床孵育4 h 后,4 ℃下加入LATS2 一抗(1:200)、内参β-actin(1:800)孵育过夜,次日封闭液洗膜后,常温下加入二抗(1:1 000)孵育1 h。ECL显色液显影后,凝胶成像系统扫描分析灰度值。LATS2 蛋白表达量以其灰度值和内参β-actin 条带灰度值比值表示。
1.6 MTT法测定SW620细胞增殖 胰蛋白酶消化收集转染48 h后的miR-372+LATS2组、pLV-LATS2组、miR-372组和对照组细胞,以适当密度接种至96孔细胞板上,每组设6 个复孔。置于培养箱内分别培养1 d、2 d和3 d后,每孔加入5 g/L MTT溶液10 μL。孵育4 h 后,加入二甲基亚砜100 μL 至蓝紫色结晶溶解,上酶标仪于490 nm波长处检测各组细胞的吸光度值。
1.7 Transwell小室法测定SW620细胞侵袭和迁移 收集转染48 h 后的对照组、miR-372 组、pLVLATS2组和miR-372+LATS2组细胞,以无血清培养基重悬调整细胞浓度为5×103个/mL 单细胞悬液。在包被或未包被无基质胶包被的Transwell 小室上室中加入200 μL细胞液,下室中加入600 μL含血清培养基,培养箱内培养24 h。拭去上室内未穿过滤膜的细胞,采用4%多聚甲醛对膜下细胞固定30 min,0.5%结晶紫染色15 min。显微镜下随机选取5个视野行细胞计数。
1.8 统计学方法 采用SPSS 22.0 进行统计学分析,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,两组间比较采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 转染miR-372 模拟物后SW620 细胞中miR-372 表达升高而LATS2 mRNA 表达降低 miR-372组细胞中miR-372 的表达水平显著高于对照组,而LATS2 mRNA 的表达水平显著低于对照组(P<0.05);而miR-NC组细胞中miR-372 和LATS2 mRNA的表达水平与对照组比较,差异无统计学意义(P>0.05),见表1。
表1 各组细胞中miR-372和LATS2 mRNA的相对表达量
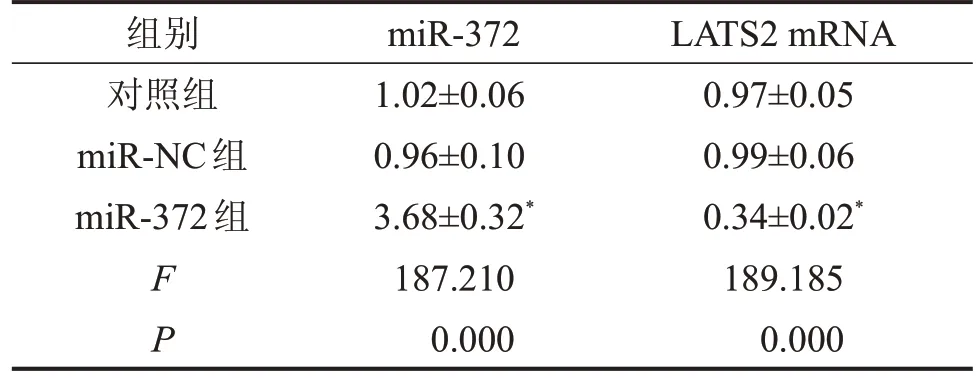
表1 各组细胞中miR-372和LATS2 mRNA的相对表达量
与对照组相比,*P<0.05。
2.2 miR-372 直接靶向作用于LATS2 采用TargetScan 软件预测发现,LATS2 3’UTR 存在可与miR-372 互补的核苷酸序列,见表2。同时,与miRNC+LATS2-WT 组相比,miR-372+LATS2-WT 组细胞的荧光素酶活性显著降低(P<0.05),而miRNC+LATS2-MUT 组与miR-372+LATS2-MUT 组细胞的荧光素酶活性比较,差异无统计学意义(P>0.05),见表3。

表2 LATS2 3'UTR与miR-372互补结合位点
表3 各组细胞的荧光素酶活性

表3 各组细胞的荧光素酶活性
与miR-NC+LATS2-WT组相比,*P<0.05。
2.3 miR-372 可 负向调控SW620 细胞中LATS2 蛋白的表达 miR-372组细胞LATS2蛋白的表达水平较对照组显著降低,而pLV-LATS2组细胞中LATS2蛋白表达较对照组显著升高;且miR-372+LATS2组细胞中LATS2 蛋白表达显著高于miR-372 组(P<0.05),见图1和表4。
表4 各组细胞中LATS2蛋白的相对表达量

表4 各组细胞中LATS2蛋白的相对表达量
与对照组相比,*P<0.05;与miR-372组相比,#P<0.05。

图1 Western blotting检测LATS2蛋白的表达
2.4 miR-372靶向LATS2促进SW620细胞增殖 与对照组相比,miR-372组细胞在1~3 d的增殖活力显著增强,而pLV-LATS2 组显著减弱,且miR-372+LATS2 组的增殖活力显著低于miR-372 组(P<0.05),见表5。
表5 各组细胞的吸光度值
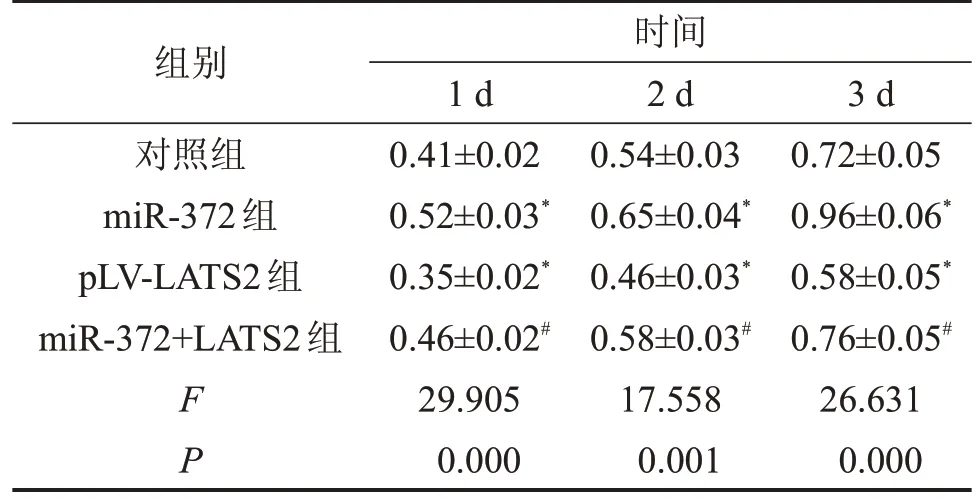
表5 各组细胞的吸光度值
与对照组相比,*P<0.05;与miR-372组相比,#P<0.05。
2.5 miR-372 靶向LATS2 促进SW620 细胞的侵袭和迁移 相对于对照组,miR-372 组中侵袭细胞数和迁移细胞数均显著增多,pLV-LATS2 组中均显著减少(P<0.05);且miR-372+LATS2 组中侵袭细胞数和迁移细胞数均显著低于miR-372组(P<0.05),见图2和表6。
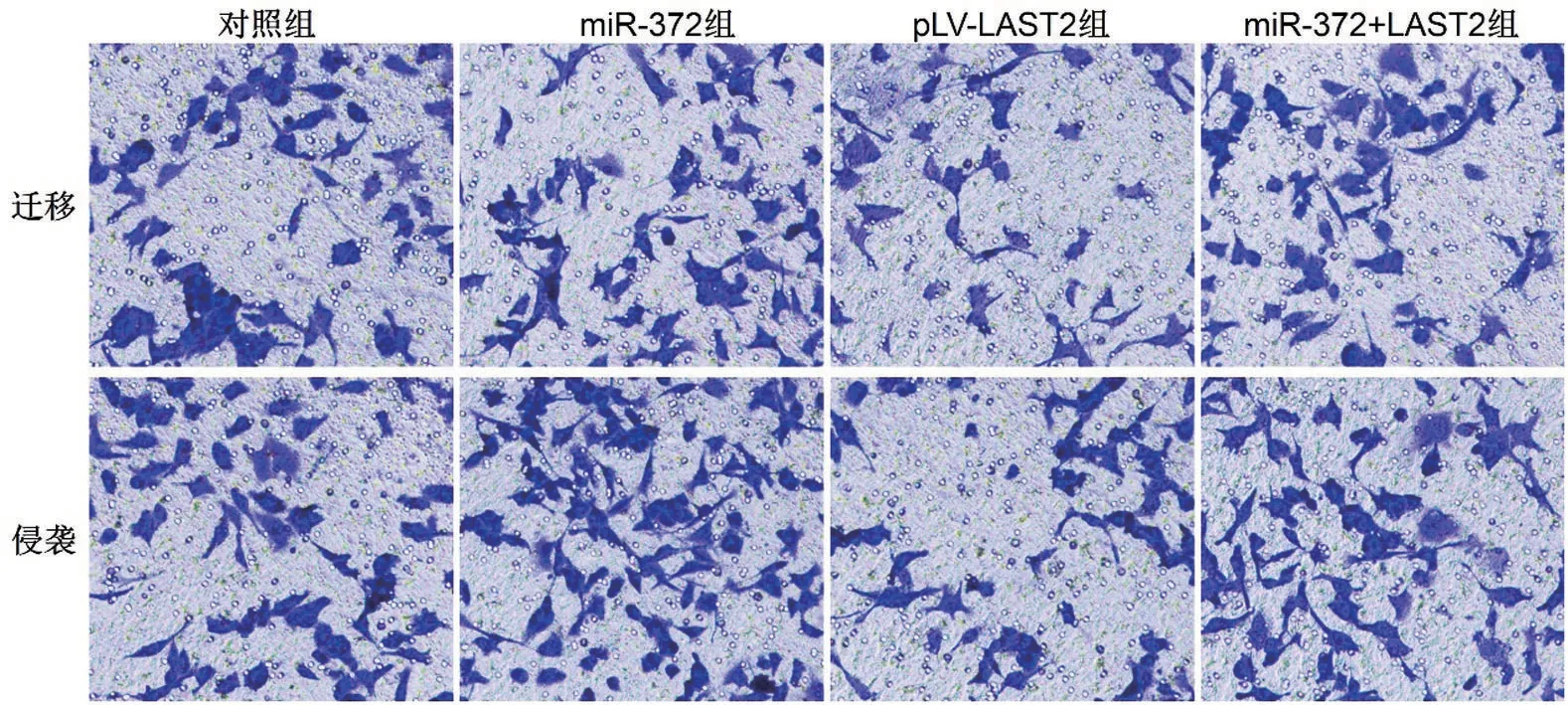
图2 各组细胞的侵袭和迁移
表6 各组中的侵袭和迁移细胞数
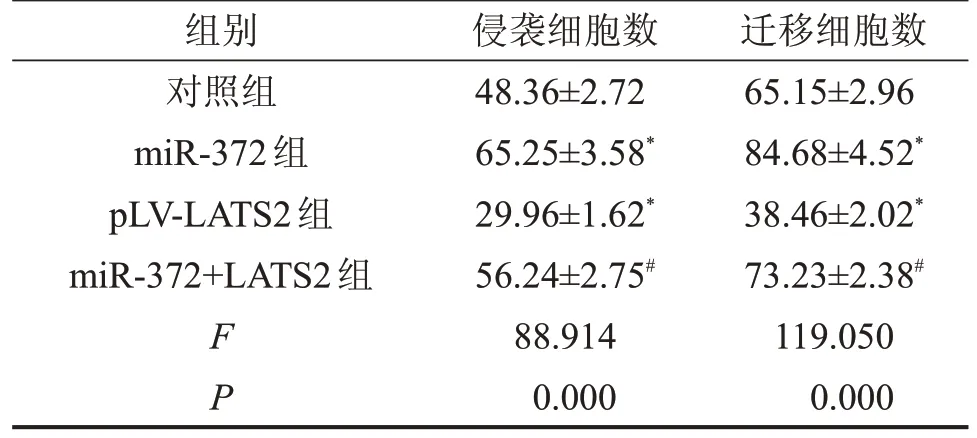
表6 各组中的侵袭和迁移细胞数
与对照组相比,*P<0.05;与miR-372组相比,#P<0.05。
3 讨论
由于多数结肠癌患者确诊时已发生局部转移,错失了根治性手术治疗的最佳时期,而目前常用的抗肿瘤药物治疗结肠癌的效果不佳。随着分子生物学的飞速发展,具有较强特异性的分子靶向治疗逐渐成为癌症治疗的重要手段,而结肠癌中异常表达的miRNAs 是治疗靶点的重要来源。因此,深入研究miRNAs 在结肠癌发生发展中的作用,筛选新的有效的miRNAs 对结肠癌治疗具有重要意义。miR-372 是一种与肿瘤发生发展关系密切的miRNA,其异常高表达可通过调控下游多种靶基因表达参与调控细胞增殖、侵袭、迁移和凋亡等多种生物学过程。口腔鳞状细胞癌中miR-372 表达上调,与淋巴结转移、淋巴血管侵犯和生存率低有关,且可通过靶向调控p62调控细胞周期和凋亡发挥致癌作用[10-11]。miR-372 在胶质瘤组织和细胞中异常高表达,干扰其表达可通过靶向调控PHLPP2 表达诱导细胞周期阻滞、凋亡,并抑制细胞增殖和侵袭[12]。在肺鳞状细胞癌组织和细胞中miR-372过表达并通过靶向抑制FGF9表达促进癌细胞增殖和侵袭[13];上调肝癌中miR-372 表达可通过靶向调控PTEN 增强YB-1表达促进肝癌细胞生长[14-15]。
在结肠癌中,miR-372被证实异常高表达,与肿瘤大小和肿瘤结节转移有关,且与LATS2之间存在负相关关系[5-6]。LATS2属于拉特抑癌家族成员,可通过调控p53 基因、Ras-ERK 和Hippo 信号通路影响细胞周期、增殖和凋亡等介导肿瘤的发生发展[16-17]。LATS2被证实在包括结肠癌在内的多种肿瘤中发挥着重要的抑制作用[18-20]。有研究发现,miR-372可通过靶向调控LATS2促进乳腺癌细胞增殖,而抑制其表达可通过调控LATS2表达抑制前列腺癌细胞增殖和迁移[8-9]。本研究通过荧光素酶实验证实LATS2 是miR-372 的靶基因,同时通过转染miR-372模拟物上调结肠癌SW620细胞中miR-372表达后发现,SW620 细胞增殖、侵袭和迁移能力均明显增强;而转染LATS2 慢病毒表达载体后,上调LATS2 表达显著降低miR-372 对SW620 细胞增殖、侵袭和迁移的影响(P<0.05)。上述结果提示,miR-372 可通过靶向调控LATS2 促进SW620 细胞增殖、侵袭和迁移。
综上所述,LATS2 是miR-372 的潜在靶基因,miR-372 可通过靶向下调LATS2 促进癌细胞增殖、侵袭和迁移,进而在结肠癌中发挥致癌作用。该结果进一步丰富了miR-372在结肠癌发生发展中的致癌机制,也为miR-372 有望成为结肠癌治疗的后选靶基因提供了新的实验依据。
