急性缺血性脑卒中患者血清DKK1水平与炎性反应及氧化应激的相关性研究*
2021-11-13霍会永赵聪慧刘晓霞刘佳佳张文超吴亭亭李军涛
刘 冰,霍会永,赵聪慧,刘晓霞,刘佳佳,张文超,刘 超,吴亭亭,李军涛
河北省邯郸市中心医院神经内二科,河北邯郸 056001
急性缺血性脑卒中(AIS)是临床常见的致死、致残性脑血管疾病,其发病机制复杂,涉及炎性反应、氧化应激、神经细胞凋亡等[1],脑缺血时缺血神经元可产生大量白细胞介素(IL)-6、肿瘤坏死因子-α(TNF-α)等炎症因子诱导急性炎性反应。在缺血缺氧刺激下,一氧化氮合酶、氧自由基等大量合成,进一步诱导炎症介质基因表达,加剧炎性反应和局部脑组织损伤[2]。Dickkopf同源物1(DKK1)是Wnt蛋白信号通路拮抗剂,可促进炎症因子释放,介导内皮细胞损伤,参与动脉粥样硬化病变过程。临床研究显示DKK1是急性冠脉综合征患者发生主要不良心血管事件的独立预测因子[3];动物研究显示DKK1表达上调可加速缺血性神经元细胞凋亡,阻断DKK1可保护神经细胞免受损伤[4-5]。DKK1在AIS中的研究报道并不多见,现有的报道显示AIS患者血清DKK1水平明显升高,DKK1是AIS潜在的预后生物标志物[6],但是DKK1在AIS发病过程中的作用机制尚不清楚,本研究拟通过检测AIS患者血清DKK1、炎症因子和氧化应激指标水平,分析它们之间的相关性,旨在初步明确DKKI影响AIS的作用机制。
1 资料与方法
1.1一般资料 选择2018年1月至2019年12月本院收治的135例AIS患者作为AIS组。AIS组纳入标准:(1)首次AIS发病,头颅CT提示局灶性脑实质低密度影、大血管高密度征、皮质脑沟后岛带消失等AIS征象,符合《中国急性缺血性脑卒中诊治指南(2014)》[7];(2)年龄18~80周岁;(3)发病12 h内入院。AIS组排除标准:(1)出血性脑卒中、短暂性脑缺血发作(TIA)、颅脑肿瘤、颅脑外伤;(2)既往有AIS或脑出血病史;(3)近3个月有颅内手术史;(4)合并恶性肿瘤、急慢性感染、免疫性疾病。另选择71例TIA患者作为TIA组,106例同期于本院门诊体检健康的志愿者作为对照组,TIA诊断参考《英国急性卒中和短暂性脑缺血发作的诊断与初始治疗指南(第一部分)》[8]。本研究获本院医学伦理委员会批准。3组受试者均知晓本研究且签署同意书。3组年龄、性别资料比较,差异均无统计学意义(P>0.05)。见表1。
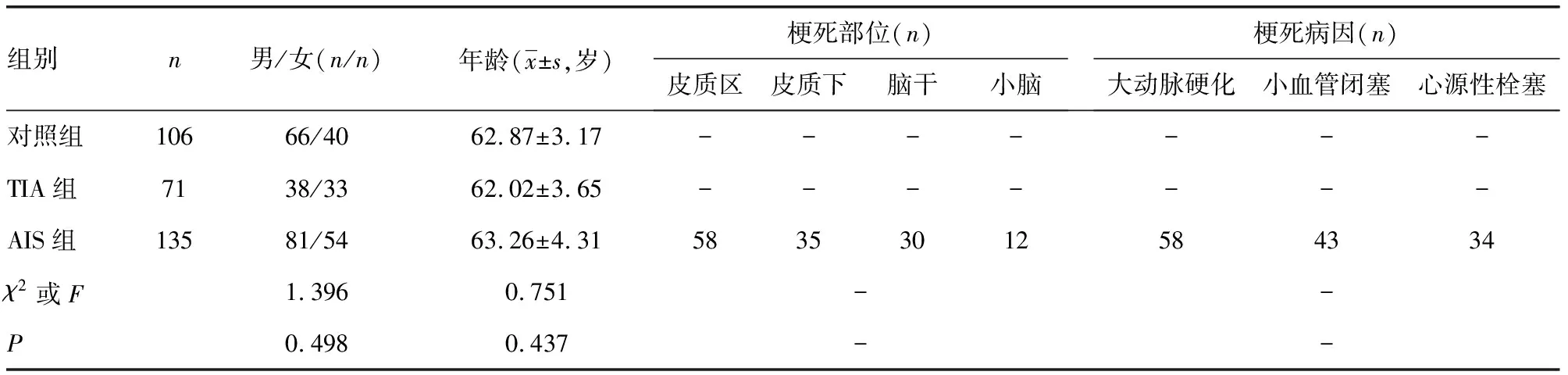
表1 两大组基线资料及比较
AIS患者入院后24 h内采用美国国立卫生研究院卒中量表(NIHSS)评分评估患者神经缺损程度,NIHSS评分从意识、视野、凝视、面瘫、上下肢运动、共济失调、感觉、语言、构音障碍进行评分,评分越高,患者神经功能缺损越严重。根据NIHSS评分将AIS患者分为3个亚组[9],轻度损伤组:NIHSS评分≤6分,共39例;中度损伤组:NIHSS评分7~14分,共67例;重度损伤组:NIHSS评分≥15分,共29例。轻度损伤组、中度损伤组、重度损伤组性别、年龄、梗死部位比较,差异均无统计学意义(P>0.05),但梗死病因差异有统计学意义(P<0.05)。见表2。
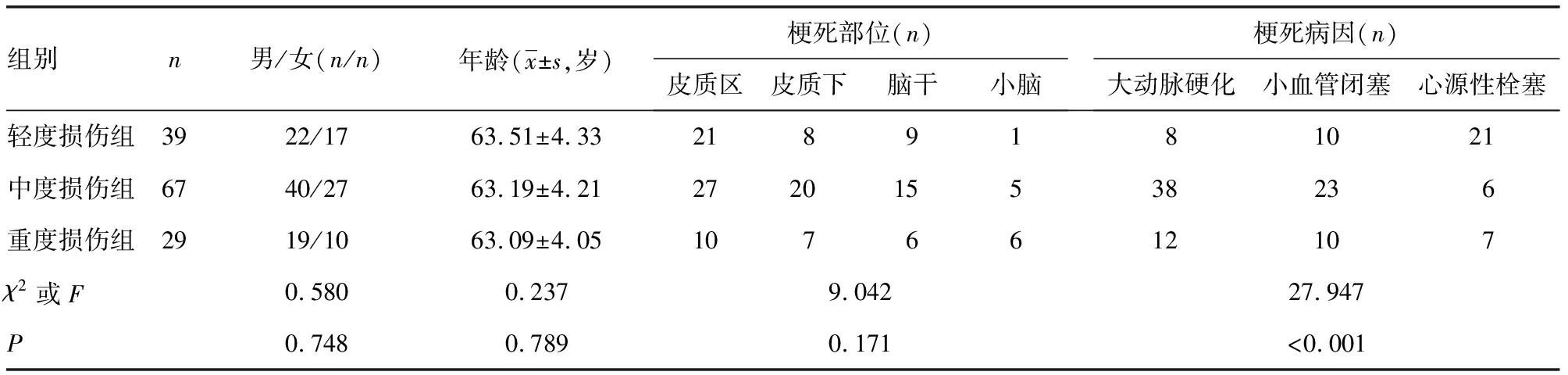
表2 AIS组的3个亚组基线资料及比较
1.2方法 AIS组、TIA组患者于入院24 h内,对照组于体检当日,采集外周静脉血5 mL,4 ℃ 3 000 r/min离心15 min(离心半径10 cm),取血清于-70 ℃冰箱保存,48 h内完成检测。应用酶联免疫吸附试验检测血清DKK1、炎性反应指标[促炎因子:IL-6、TNF-α、转化生长因子β(TGF-β);抗炎因子:IL-4、IL-10、IL-13]、氧化应激指标[氧化指标:活性氧(ROS)、晚期蛋白氧化产物(AOPP);抗氧化指标:超氧化物歧化酶(SOD)、过氧化氢酶(CAT)]水平,仪器为瑞士Hamilton FAME全自动酶联免疫分析仪,试剂盒购自美国R&D公司。本研究实验室检测项目均由本院检验中心完成,板内、板间变异系数<10.00%,所有步骤均严格按说明书要求进行操作。
2 结 果
2.1血清DKK1水平比较 AIS组、TIA组、对照组的血清DKK1水平分别为(640.50±35.49)、(381.15±31.52)、(356.50±32.49)pg/mL,3组血清DKK1水平差异有统计学意义(P<0.05),AIS组血清DKK1水平高于TIA组和对照组(P<0.05),TIA组血清DKK1水平高于对照组(P<0.05)。
AIS患者重度损伤组、中度损伤组、轻度损伤组的血清DKK1水平分别为(803.25±35.73)、(624.45±34.47)、(547.05±36.72)pg/mL,3组血清DKK1水平差异有统计学意义(P<0.05),重度损伤组血清DKK1水平高于中度损伤组和轻度损伤组(P<0.05),中度损伤组DKK1水平亦高于轻度损伤组(P<0.05)。
2.2血清炎性反应指标比较 AIS组、TIA组和对照组血清IL-6、TNF-α、TGF-β、IL-4、IL-10、IL-13水平差异均有统计学意义(P<0.05);AIS组血清IL-6、TNF-α、TGF-β水平均高于TIA组和对照组(P<0.05),IL-4、IL-10、IL-13水平均低于TIA组和对照组(P<0.05);TIA组血清IL-6、TNF-α、TGF-β水平均高于对照组(P<0.05),IL-4、IL-10、IL-13水平均低于对照组(P<0.05)。见表3。
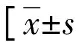
表3 AIS组、TIA组和对照组血清炎症因子水平的比较或M(P25~P75),pg/mL]
AIS患者轻度损伤组、中度损伤组、重度损伤组血清IL-6、TNF-α、TGF-β、IL-4、IL-10、IL-13水平差异均有统计学意义(P<0.05)。其中,重度损伤组血清IL-6、TNF-α、TGF-β水平均高于中度损伤组和轻度损伤组(P<0.05),IL-4、IL-10、IL-13水平均低于中度损伤组和轻度损伤组(P<0.05);中度损伤组血清IL-6、TNF-α、TGF-β水平均高于轻度损伤组(P<0.05),IL-4、IL-10、IL-13水平均低于轻度损伤组(P<0.05)。见表4。
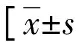
表4 AIS患者轻度损伤组、中度损伤组、重度损伤组血清炎症因子水平的比较或M(P25~P75),pg/mL]
2.3氧化应激指标比较 AIS组、TIA组和对照组血清ROS、AOPP、SOD、CAT水平差异均有统计学意义(P<0.05);AIS组血清ROS、AOPP水平均高于TIA组和对照组(P<0.05),SOD、CAT水平均低于TIA组和对照组(P<0.05);TIA组血清ROS、AOPP水平均高于对照组(P<0.05),SOD、CAT水平均低于对照组(P<0.05)。见表5。
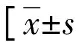
表5 AIS组、TIA组和对照组血清氧化应激指标水平的比较或M(P25~P75)]
AIS患者轻度损伤组、中度损伤组、重度损伤组血清ROS、AOPP、SOD、CAT水平差异均有统计学意义(P<0.05);重度损伤组血清ROS、AOPP水平均高于中度损伤组和轻度损伤组(P<0.05),SOD、CAT水平均低于中度损伤组和轻度损伤组(P<0.05);中度损伤组血清ROS、AOPP水平均高于轻度损伤组(P<0.05), SOD、CAT水平均低于轻度损伤组(P<0.05)。见表6。
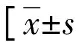
表6 AIS患者轻度损伤组、中度损伤组、重度损伤组血清氧化应激指标水平的比较或M(P25~P75)]
2.4AIS患者的血清DKK1水平与炎性反应、氧化应激指标的相关性 Pearson相关分析结果显示,AIS患者血清DKK1与IL-6(r=0.612,P<0.001)、TNF-α(r=0.539,P=0.003)、TGF-β(r=0.571,P<0.001)、ROS(r=0.602,P<0.001)、AOPP(r=0.531,P=0.005)呈正相关,与IL-4(r=-0.503,P=0.007)、IL-10(r=-0.498,P=0.009)、IL-13(r=-0.612,P<0.001)、SOD(r=-0.542,P=0.002)、CAT(r=-0.539,P=0.003)呈负相关。
3 讨 论
AIS是世界范围内导致人类死亡和残疾的主要病因,该病由脑动脉系统血管痉挛、闭塞导致,患者可出现不同程度的神经损伤[1]。AIS发病机制尚未完全阐明,探讨与AIS发病相关的分子机制对于诊断、治疗、预后预测均具有重要意义。
DKK1是近年发现的一种分泌型蛋白,可负性调控Wnt信号通路,促进神经退行性病变的发生和发展,并参与应激诱导的神经元凋亡[10]。动物研究显示脑出血大鼠脑组织DKK1表达增强,抑制DKK1可增加Wnt-1 mRNA转录,上调紧密连接蛋白1(ZO-1)表达,减少血脑屏障破坏和脑水肿,减轻神经缺陷[4],DKK1通过抑制Akt表达诱导神经元凋亡[5]。临床报道显示AIS患者血清DKK1水平显著升高[11],血清DKK1水平是AIS患者长期预后不良的独立预测因子[6]。本研究结果同样显示AIS患者血清DKK1水平升高,高于TIA组和对照组(P<0.05),且DKK1水平与AIS患者神经损伤程度存在一定关系,说明AIS发病可诱导DKK1生成增加,在AIS病情进展过程中DKK1过度升高可能加重神经缺损程度。本研究发现,TIA组血清DKK1水平较对照组亦增高(P<0.05),提示脑组织短暂缺血也可引起 DKK1水平出现小幅度的升高,DKK1对脑缺血反应较为敏感。DKK1参与AIS发病的作用机制:首先,DKK1参与AIS发病前的动脉粥样硬化过程。Wnt/β-连环蛋白(β-catenin)信号通路可通过抑制脂质合成,阻碍巨噬细胞泡沫化和动脉粥样硬化斑块坏死和纤维帽破裂,抑制平滑肌细胞增殖、迁移,发挥抗动脉粥样硬化作用[12]。DKK1作为Wnt/β-catenin信号通路抑制剂,其过度表达可阻断Wnt/β-catenin信号通路,促进动脉粥样硬化进程。动物研究也显示抑制DKK1可减弱血管单核细胞黏附和内皮损伤,沉默DKK1基因则限制ApoE-/-小鼠动脉粥样硬化发生[13]。其次,DKK1参与AIS后神经细胞凋亡过程。Wnt通过正向调节Akt信号通路,促使细胞存活、增殖生长,发挥保护神经的作用[14]。DKK1作为Wnt/β-catenin信号通路拮抗剂,可负向调控Akt信号通路,诱导神经细胞凋亡。
动脉粥样硬化是AIS发病的主要病理基础,炎性反应贯穿动脉粥样硬化和不稳定斑块形成、脱落、栓塞等整个过程[15]。IL-6、TNF-α、TGF-β是典型的促炎因子,IL-4、IL-10、IL-13是公认的抗炎因子。现有研究显示IL-6、TNF-α、TGF-β、IL-4、IL-10、IL-13与脑梗死局部炎性反应密切相关[16]。本研究结果表明,AIS发病过程中炎性反应处于激活状态,炎症因子生成显著增多,炎性反应参与AIS发病和疾病进展过程。相关性分析结果显示,DKK1与IL-6、TNF-α、TGF-β呈正相关,与IL-4、IL-10、IL-13呈负相关,说明AIS患者体内过度合成的DKK1对炎性介质分泌具有促进作用,对抗炎因子分泌具有抑制作用。DKK1可能通过Wnt/β-catenin信号通路调控AIS炎性反应,Wnt/β-catenin信号通路可通过抑制巨噬细胞向经典激活巨噬细胞分化,抑制CD4+T细胞向Th2和Treg细胞分化,抑制促炎介质分泌、促使抗炎因子表达,发挥抗炎作用[17]。因此DKK1过度表达可能抑制Wnt/β-catenin信号通路,导致促炎因子过度释放,加剧炎性反应。
局部脑血管堵塞可引起周围神经细胞缺血缺氧,大量ROS、氧自由基、一氧化氮合酶生成,促使脂质过氧化,直接损害神经细胞,导致神经细胞凋亡和神经功能异常[18]。氧化物自由基作为炎性反应启动因子,可促进炎症因子释放,加重炎性反应损伤[19]。 ROS、AOPP是典型氧化代谢产物,SOD、CAT是抗氧化物质[20],脑组织缺氧状态下氧化代谢产物合成增加,消耗体内抗氧化物质,引起局部及全身氧化/抗氧化失衡,脑损伤越严重,氧化应激反应越强烈[21]。本研究结果表明,AIS患者发病过程中氧化/抗氧化失衡,氧化代谢产物生成增多,导致过度氧化应激反应。相关性分析结果显示,DKK1与氧化产物ROS、AOPP均呈正相关,与抗氧化因子SOD、CAT呈负相关,说明AIS患者体内过度合成的DKK1可导致氧化/抗氧化失衡,引发局部缺血病灶氧化应激损伤。现有研究显示Wnt/β-catenin信号通路与缺血再灌注损伤诱导的氧化应激密切相关,氧化应激可抑制Wnt/β-catenin信号通路,Wnt/β-catenin信号通路活化可抑制氧化应激反应,抑制氧化应激诱导的细胞凋亡[22]。推测AIS患者在缺血缺氧应激下发生过度氧化应激反应,抑制了Wnt/β-catenin信号通路,导致DKK1合成增多,DKK1又进一步抑制Wnt/β-catenin信号通路,引起氧化/抗氧化失衡。
综上所述,AIS患者血清DKK1水平与TIA人群及健康人群相比明显升高,且患者的神经功能缺损程度越严重,其水平越高。DKK1可能通过Wnt/β-catenin信号通路激活炎性反应和氧化应激反应参与AIS的发病和进展过程,检查其在血清中的表达水平有助于评估AIS患者的病情。
