虾酱中益生芽孢杆菌的筛选及其潜在益生效果的研究
2021-11-13田亮金朱薇薇张冬冬关博元王世锋
田亮金,朱薇薇,蔡 岩,张冬冬,姜 柳,张 倩,关博元,王世锋
(1.海南大学南海海洋资源利用国家重点实验室,海南海口 570228;2.海南大学海洋学院,海南省热带水生生物技术重点实验室,海南海口 570228)
虾酱(Shrimp Paste)又名虾膏,全国科学技术名词审定委员会将其定义为“毛虾等小型虾类经腌制、捣碎、发酵制成的糊状食品”[1].在传统虾酱生产工艺中,虾体表及体内的微生物是虾酱发酵的主要微生物类群,包括乳酸杆菌属(Lactob acillusspp.)、酵母菌属(Sacch aromycesspp.)、片球菌属(Pedi ococcusspp.)、芽孢杆菌属(Baci llusspp.)等[2-3],由于在生产期间很少灭菌,这些天然共生的微生物在虾酱中存活了下来[4-5].有研究表明,芽孢杆菌属是虾酱微生物群落中的重要组成部分[6].
芽孢杆菌是一种革兰氏阳性菌,可通过食物进入动物的胃肠道[7].在众多水生动物中,芽孢杆菌属是研究最多的益生菌,作为微生态制剂添加到饲料中促进了水产养殖技术的开发和水产养殖业的可持续发展[8].许多研究表明,芽孢杆菌可以对动物起到很好的益生效果,具有产酶活性的芽孢杆菌可以增强宿主的生长性能[9-11];其抗菌活性可以抑制肠道病原菌,改善肠道菌群环境[12];其产酸能力也可抑制肠道中对酸敏感的病原菌[13];分泌的多种物质可以提高宿主消化酶活性和抗氧化活性[9-10,14];且可显著降低水体中NH+4-N、NO-2-N含量,改善水体环境等[15].同时,益生菌应对肠胃环境有一定的耐受力,粘附性和疏水活性也间接反映其定植能力[16-17].因此,本研究以传统发酵工艺制作的虾酱为材料,筛选出可以产酸的,具有较强产酶能力、抗病原菌、对抗生素敏感的潜在益生菌,并测定株菌的耐受性、粘附性、表面疏水活性,以期筛选优良的益生菌株,为开发水产动物益生菌制剂提供理论支持.
1 材料与方法
1.1 材料虾酱购于海口市美兰区某食用品杂货店,分别为定安定城益民调味厂生产的帮辉海虾调味酱(500 g,A酱)和海口本地虾酱(500 g,无商标,B酱).
指示菌无乳链球菌S treptococcus a gal act iae、嗜水气单胞菌Aeromonas h ydro phila、哈维氏弧菌Vi bri o h arveyi、溶藻弧菌V.alginol yticus和鳗弧菌V.an gui llarum均由本课题组前期分离得到,保存于-80℃冰箱.
1.2 培养基BCP培养基:乳糖5 g,蛋白胨5 g,酵母膏3 g,琼脂18 g,H2O 1 000 mL,0.5%溴甲酚紫溶液10 mL,pH 7.0.
脱脂牛奶固体培养基:琼脂18 g,H2O 900 mL,pH值7.0.灭菌后冷却至60℃时加入100 mL脱脂牛奶.
淀粉固体培养基:可溶性淀粉10 g、蛋白胨10 g、葡萄糖5 g、牛肉膏5 g、琼脂粉18 g,H2O 1 000 mL,pH 7.0.
改良刺激芽孢生长培养基:胰蛋白胨10 g/L,淀粉3 g/L,酵母粉3 g/L,K2HPO42 g/L,MnSO40.1 g/L,MgSO40.1 g/L,H2O 1 000 mL,pH 7.0.
1.3 方法
1.3.1 菌株筛选将虾酱震荡混匀后用生理盐水稀释10倍,再混匀后取100μL的稀释液涂布到BCP培养基上,37℃培养24 h.挑选出使培养基变黄色,即可以产酸的菌株,在BCP平板上划线纯化,单菌落转接到斜面培养基上37℃过夜培养后,保存于4℃冰箱备用.
1.3.2 溶血活性菌种活化后用接种环挑取菌液在血琼脂平板(广东环凯微生物科技有限公司)上划线,在37℃培养24 h后,根据菌落周围透明圈的形成检测菌株的溶血活性.
1.3.3 产酶能力参考Gu等[18]的方法用打孔器在含1%脱脂牛奶的固体培养基(测定蛋白酶)上均匀打孔,每孔加20μL菌液后37℃条件下正置培养24 h,测量水解圈.淀粉酶的测定参考刘观斌等[19]和Saxena等[20]的方法,用打孔器在淀粉固体培养基上均匀打孔,每孔加20μL菌液后37℃条件下正置培养24 h,加入2 mL的碘液,将碘液均匀覆盖整个培养基,10 min后记录蓝色培养基上出现水解透明圈的情况并测量其直径.水解圈大小均以水解圈直径(mm)减去打孔直径(mm)表示.
1.3.4 拮抗能力实验取活化的菌液3μL点种于改良刺激芽孢杆菌固体培养基[21]上,在37℃下正置培养24 h后,将各指示菌的半固体琼脂培养基(无菌半固体琼脂∶菌液=9∶1)分别倒板于点种好的改良刺激芽孢杆菌固体培养基上,倒置37℃培养24 h后测量菌落直径C(mm)和抗菌圈直径H(mm)[22].拮抗活性的大小以抗菌圈直径H(mm)和菌落直径C(mm)的比值H/C表示.
1.3.5 16S rRNA分子生物学鉴定以细菌16S rRNA基因通用引物27F(5′-AGAGTTTGATCCTGGCTCA-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)进行PCR扩增,50μL反应体系为:5μL 10×GC Buffer,4μL dNTPs,上、下游引物(10 mmol/L)1μL,0.5μLTaq酶,1μL DNA模板,37.51μL去离子水.扩增程序为:95℃5 min,94℃30 s,54℃1 min,72℃2 min,30个循环,72℃10 min.PCR产物凝胶系统检测后送至上海生工测序.
1.3.6 产酸能力活化的菌种用接种环挑取1环,分别接种于装有30 mL LB液体培养基(pH 7.2)的50 mL离心管中培养12 h,用pH计测出12 h后的pH值,并进行平板计数[19].
1.3.7 耐人工胃肠液对Gebara等[23]的方法略作修改,配制待用溶液:1.12 g/L KCL,0.11 g/L CaCl,0.4 g/L KH2PO4.在待用溶液中加粘蛋白(3.5 g/L),胃蛋白酶(0.26 g/L),加入1 mol/L HCl使pH值至3.0模拟胃液环境;在待用溶液中加入胰蛋白酶(1.95 g/L),加入1 mol/L NaHCO3使pH值至7.0模拟肠液环境,配制完成后用0.22μm滤膜过滤除菌.取0.4 mL菌液分别接种到3.6 mL模拟胃液/模拟肠液中,摇床100 r/min、37℃分别培养3 h、4 h后进行菌落计数,表示为log10CFU mL-1,分别计算存活率.
1.3.8 自凝集率参照Manhar等[24]的方法调节菌液OD(600 nm)值为0.8±0.05,室温静置培养2 h、4 h、24 h时分别测上层菌液OD值(600 nm).自凝集率=(At-A0)/A0×100%(式中:A0为600 nm处初始菌液的OD值;At静置th后上清液在600 nm处的OD值).
1.3.9 表面疏水活性调节菌液的OD值(600 nm)为0.8±0.05,然后将等体积的菌液分别和二甲苯(非极性溶剂)、氯仿(极性酸性溶剂)及乙酸乙酯(极性碱性溶剂)混合[25],涡旋震荡2 min后室温静置2 h,取水相测其OD值.表面疏水活性=(At-A0)/A0×100%(式中:A0为600 nm处初始菌液的OD值;At静置th后上清液在600 nm处的OD值)[26].
1.3.10 药敏试验药敏试验采用纸片扩散法(K-B法)及琼脂稀释法.调节菌液浓度至CLSI标准规定的1.5×108CFU/mL,取300μL培养过夜的菌液到厚度均为4 mm MH琼脂平板上,涂板晾干后,每个平板均匀贴4个药敏纸片,每种纸片(杭州微生物试剂有限公司)设3个重复,室温放置15 min后于37℃倒置培养24 h,测量抑菌圈直径(mm).
1.4 数据处理所得数据用Excel(Excel 2016)、SPSS(19.0)进行图表绘制及统计学分析.
2 结果
2.1 溶血性和产酸能力利用BCP培养基从两种虾酱中筛选到306株产酸菌株,再经血平板培养筛选得到36株不溶血的菌株:A1、A2、A8、A11、A12、A14、A16、A20、A27、A28、A35、A40、A41、B3、B14、B15、B35、B37、B38、B39、B45、B47、B53、B55、B56、B65、B76、B81、B83、B85、B87、B89、B94、B117、B169、B182.
2.2 产酶能力对36株不溶血的菌株进行产酶能力测定,挑选出产酶能力相对较好的6株菌,并进行显著性分析,结果如表1.A27、A35和B47的淀粉酶水解圈大小在4 mm以上,且蛋白酶水解圈大小超过5 mm,显著高于其他菌株(P<0.05),A20次之;B3和B89相较于前者,产酶能力一般.
2.3 拮抗能力6株菌的体外拮抗实验结果同表1.同时对5种病原菌有拮抗能力的菌株只有A20和B3,并且至少对4种病原菌的拮抗能力显著高于其它菌株(P<0.05),A27、A35和B47只对一种病原菌有拮抗能力,且没有显著差异(P>0.05).部分候选菌株对5种病原菌的拮抗作用如图1所示.
结合产酶和拮抗实验结果来看,A20的产酶和拮抗能力都较好,A27和B47虽然只对一种病原菌有拮抗能力,但产酶能力突出;B3和B89产酶能力一般,但至少对四种病原菌有一定的拮抗能力,因此选用这6株菌进行后续的筛选.
2.4 菌落形态特征菌株活化后在改良刺激芽孢杆菌固体培养基上划线,37℃倒置过夜培养后,6株芽孢杆菌菌落形态如图2所示.
2.5 16S rRNA分子生物学鉴定使用BLAST方法将测序结果与GenBank数据库中已知菌序列进行比对,菌株A20、A27、B3、B89分别与巨大芽孢杆菌MF431757.1、MF431757.1、MK307787.1、MK521072.1序列相似度最高,均达到99%以上,菌株A35、B47分别与枯草芽孢杆菌KU179323.1、弯曲芽孢杆菌MK012676.1序列相似度最高,也达到99%以上.
将比对获得的序列用MEGA 6软件进行构建系统发育树,结果如图3,A20、A27、A35、B3、B47、B89这6株菌株均为芽孢杆菌属,其中,A20、A27、B3、B89为巨大芽孢杆菌(B.me gat erium),A35为枯草芽孢杆菌(B.subt i lis),B47为弯曲芽孢杆菌(B.flexus).
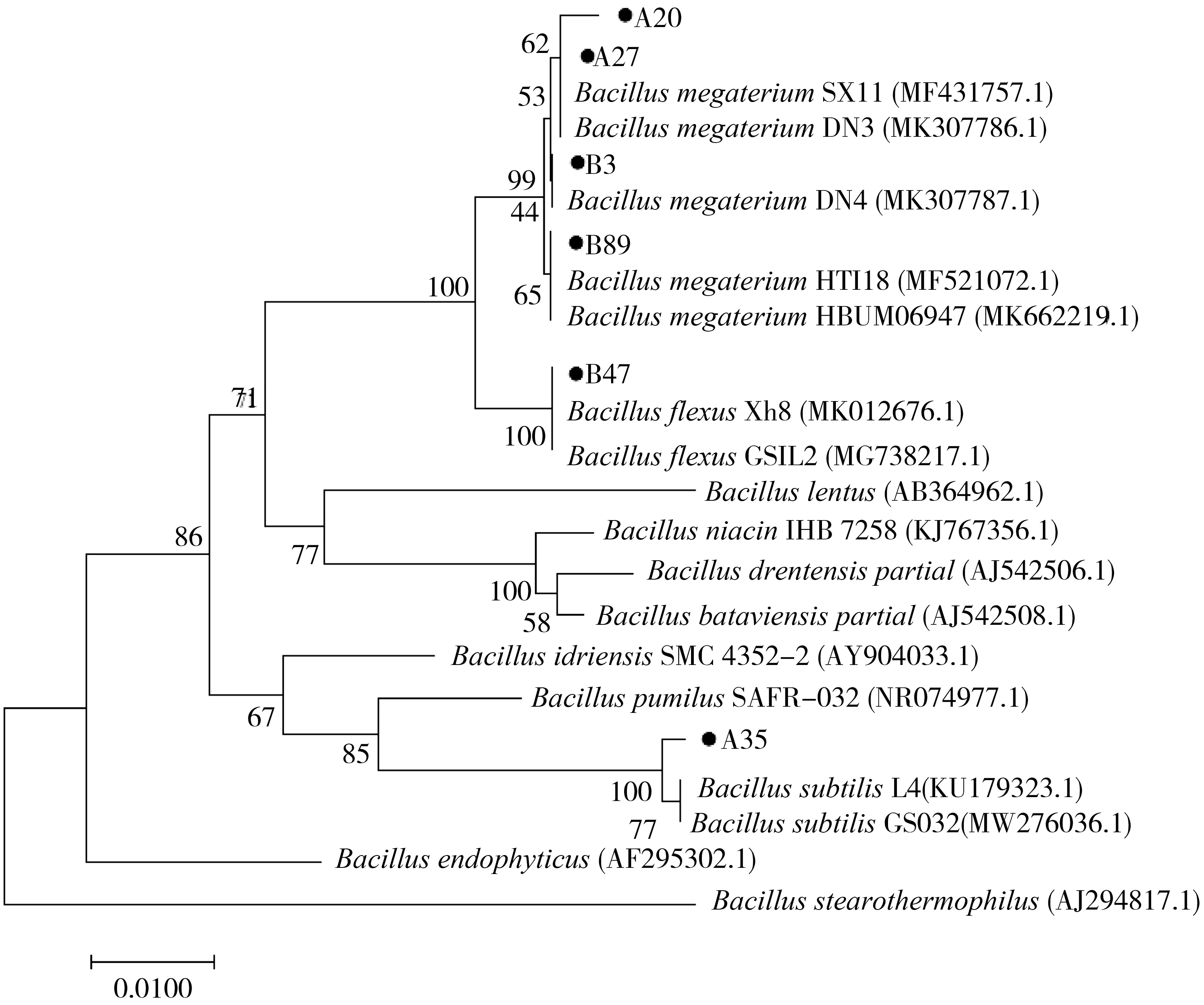
图3 6株潜在益生菌的系统进化树
2.6 产酸能力如表2所示,B47、A20、B89和B3菌株培养12 h后,其菌液pH值的降低值显著低于与其他菌株(P<0.05),具有一定的产酸能力.

表2 6株芽孢杆菌12h的产酸能力
2.7 耐人工胃肠液
2.7.1 耐人工胃液由图4可以得出,当人工胃液作用时间为3 h时,B47和B89的存活率显著高于A35(P<0.05),但是与A20、A27无显著差异(P>0.05).

图4 6株芽孢杆菌在人工胃液中3h的存活率[注:各组 数据用mean±SD表示,不同字母表示各组间的差异显著(P<0.05)]
2.7.2 耐人工肠液由图5可得,当人工肠液作用时间为4 h时A27的存活率最高,为90%,与A20、A35、B3和B47有显著差异(P<0.05).

图5 6株芽孢杆菌在人工肠液中4h后的存活率[注:各组数据用mean±SD表示,不同字母表示各组间的差异显著(P<0.05).]
2.8 自凝集能力自凝集率见图6,由图可知A20和A27各个时间段的自凝集效果都比较好,24 h的自凝集率达到了98%及以上;A35、B3和B89的自凝集率在2 h、4 h和24 h时都一般,24 h时达到了70%左右;B47的自凝集效果较差.

图6 6株芽孢杆菌的自凝集率[注:各组数据用mean±SD表示]
2.9 表面疏水活性菌株表面疏水活性结果见图7,A35、B3和B89在二甲苯溶剂中的疏水率较高(P<0.05);6株菌在氯仿溶剂中的疏水率均超过36%,A35和B89显著高于其他菌株(P<0.05);A35和B89在乙酸乙酯溶剂中的疏水率显著高于其他菌株(P<0.05).综合来看,A35和B89在这三种溶剂中的疏水率比较高.
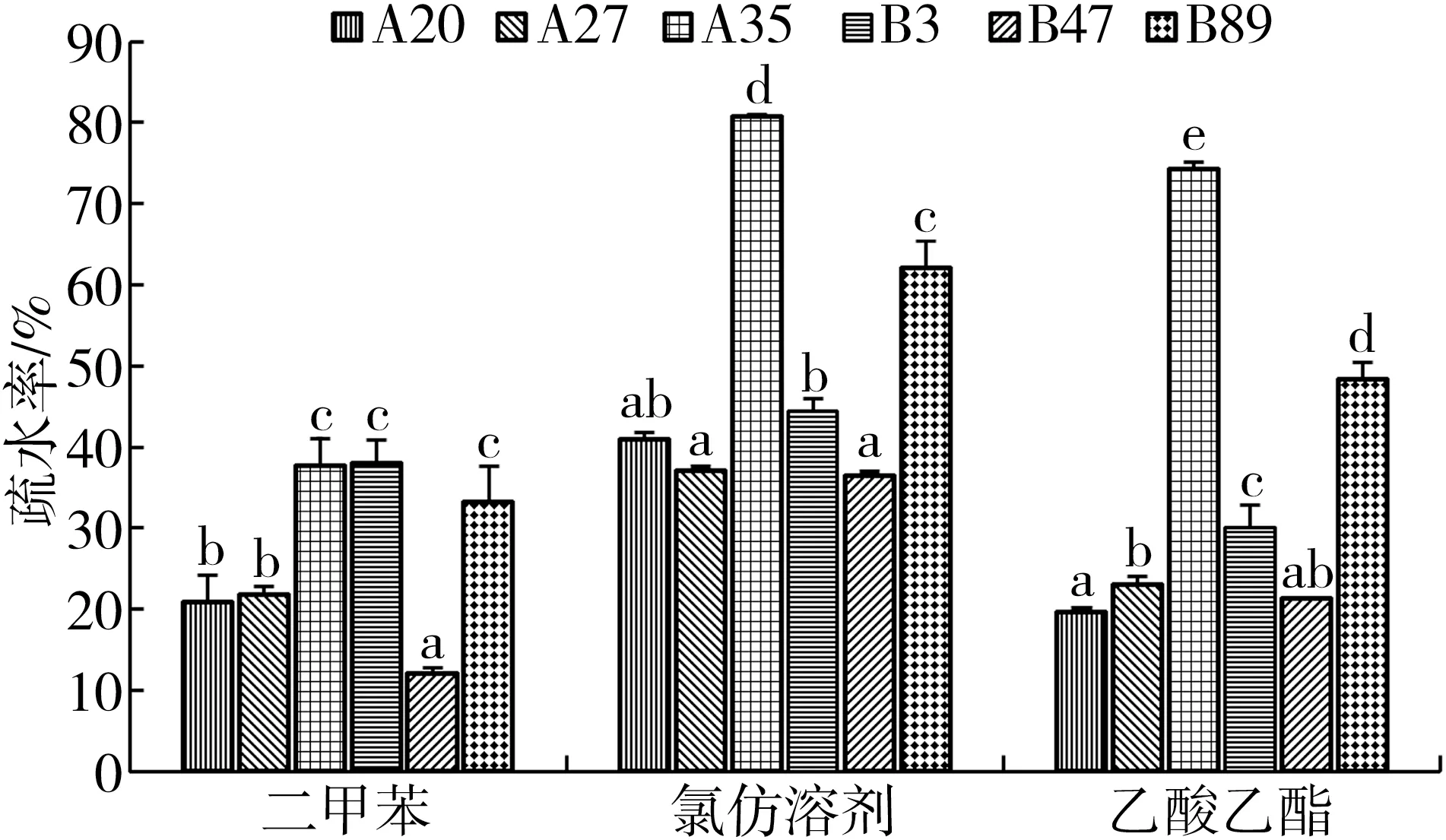
图7 6株芽孢杆菌的表面疏水活性[注:各组数据用mean±SD表示,不同字母表示各组间的差异显著(P<0.05)]
2.10 药敏试验结果由表3可得,6株芽孢杆菌对26种抗生素的药敏实验中,A20对其中的21种抗生素敏感,其敏感率最高为80.8%.A20、A27、A35、B47、B89对青霉素类的阿洛西林和阿莫西林都敏感;6株菌均对糖肽类的万古霉素、氯霉素类敏感,对杆菌肽耐药.

表3 6株芽孢杆菌的药敏试验
3 讨 论
芽孢杆菌是一类应用比较广泛的可饲用益生菌[27],具有良好的益生作用,并且产生的芽孢生命力强,利于储存和运输[28].产酸的芽孢杆菌还能降低肠道的pH值,抑制病原菌的大量增殖[13].张飞等[29]在筛选乳酸菌时发现培养基pH值下降了1.99~2.08,体现出一定的产酸能力,与本研究类似,芽孢杆菌A20、B3、B47和B89在培养12 h后,使培养基pH值下降了1.44~1.71,说明这五株芽孢杆菌也具有一定的产酸能力.
3.1 产酶能力饲料消化率会对养殖鱼类的生长和生产成本产生直接影响,而添加产蛋白酶和淀粉酶等消化酶的芽孢杆菌能够提高鱼类的消化能力[30-32],促进鱼类对营养物质的消化和吸收,提高饲料利用率[9,33-34].Liu等[9]和Debasis等[35]等发现将具有淀粉酶和蛋白酶活性的枯草芽孢杆菌(B.subtil us)添加到饲料中并投喂后显著提高了鱼类的特定生长率和增重率.Cai等[10]也将具有这两种产酶能力的两株芽孢杆菌分别投喂21天时,发现显著促进了对虾(Lito penaeus vannamei)的生长.孙娜[11]将具有产蛋白酶和淀粉酶活性的蜡状芽孢杆菌(B.cer eus)添加于饲料中分别投喂许氏平鲉(S ebastes s ch le gel ii)和大菱鲆(S cophthalmus maximus)幼鱼50天后,也发现增重率和特定生长率显著提高.Liu等[36]和Han等[37]在各自的研究中也发现了类似的结果.本研究中,A20、A27、A35和B47的淀粉酶和蛋白酶水解圈大小均在4 mm以上,具有较强的产淀粉酶和蛋白酶的活性,可作为促进水产动物生长性能的候选菌株.
3.2 对病原菌的拮抗能力芽孢杆菌可通过分泌细菌素、磷脂类、脂肽类等抗菌物质,破坏病原菌的细胞壁和细胞膜,干扰病原菌能量代谢[12].研究表明,在饲料中添加对病原菌具有拮抗效果的益生菌,可提高机体抵抗病原菌侵染的能力[12,32-33].Li等[38]发现一株贝莱斯芽孢杆菌(B.velez ensis)对7种病原菌有抑制活性,在投喂珍珠龙胆石斑鱼(E pineph el us lanceol at us♂×E.fus co gut tatus♀)4周后感染哈维氏弧菌,存活率和免疫基因显著提高(P<0.05).Gobi等[39]投喂地衣芽孢杆菌(B.licheniformis)提高了罗非鱼对嗜水气单胞菌的抵抗力.类似地,Meidong等[40]投喂空气芽孢杆菌(B.aerius)也增强了巴沙鱼(Pan gasius bocourt i)的免疫力和对嗜水气单胞菌的抵抗力.Nayak等[41]、Kumar等[42]和Wu等[30]也在添加芽孢杆菌后发现了类似的结果.本研究筛选的A20、B3和B89至少对4种病原菌具有拮抗作用,其中A20对病原菌的拮抗能力最强,对4种水产动物病原菌的拮抗能力显著高于其它菌株(P<0.05),作为益生菌添加到饲料中也存在一定的保护潜力.
3.3 肠胃道定植能力肠胃道环境中的胃酸、胃蛋白酶、胰蛋白酶及胆盐等物质会对益生菌的定殖产生不利影响[43],因此益生菌发挥功能的前提是要对胃肠道有一定的耐受性[16-17,44].对益生菌进行耐受性的检验是必要的,只有在肠胃环境中存活并增植到一定的数量才能发挥其益生作用[45-46].吴振超等[47]在研究蜡状芽孢杆菌对肠胃液的耐受性时发现,处理4 h后的存活率分别为62.91%和69.54%,体现出较好的耐受能力,与本研究结果相似.在人工胃液和肠液分别作用3、4小时之后,A20、A27、B47和B89的存活率均高于60%,表明该菌株可以在肠胃道中存活.益生菌益生菌的体外粘附能力和体内定植是相关的[17,48],自凝集与表面疏水活性是影响两相反应的重要因素之一,与多种黏附作用相关[49].自凝聚水平可分为:低(16%~35%),中等(35%~50%)和高(50%以上)三类[50].在粘附性实验中,A20和A27 24 h的自凝集率为98%及以上,体现出高自凝性.A35和B89在三种溶剂中都表现出较高的表面疏水活性.
3.3 抗生素敏感性益生菌具有在肠道中转移抗生素抗性基因至病原菌中的潜在能力,因此应用前必须先通过体外试验对其相关的抗生素易感性进行检测[51].在本试验中,芽孢杆菌A20和A27分别对21、16种抗生素敏感,敏感率比较高的还有A35和B47这2株菌,携带耐药性基因较少,其作为水产微生物制剂成分,耐药基因转移到病原菌中,提高病原菌耐药性的可能性较小,在此方面A20具有较好的安全性.
3.4 菌株特异性微生物泛基因组(Pan-genomoe)研究显示,同种不同菌株间基因组存在差异,根据基因在不同菌株中基因出现的频次不同,可分为核心基因、非必需基因和菌株特有基因三部分[52],根据中心法则[53],不同菌株在基因组成上的差异直接决定了其特定功能的有无[54].因此,即便是同一菌种的不同菌株之间因基因组成的差异,其益生功能特性和安全性等方面也不尽相同,具有菌株特异性[55-57].可见,在益生菌筛选中通过多项实验针对特定菌株评价其益生作用是必要的[58].在本研究中发现,尽管A20、A27、B3和B89均为巨大芽孢杆菌,但在酶活、病原菌拮抗活性、产酸能力等益生特性均存在一定差异,为今后益生菌的益生机制研究提供了菌种,奠定了基础.
4 结 论
本研究以虾酱为原料,比较了菌株的产酸能力、溶血活性、产酶能力、对病原菌的拮抗能力、耐人工胃/肠液、粘附性、表面疏水活性和药物敏感性等,巨大芽孢杆菌A20无溶血活性,发酵12小时后可使培养液pH降低1.5;蛋白酶和淀粉酶水解圈大小在4 mm以上;对5种致病菌均具有较强的拮抗能力,H/C比值超过1.5;具有较强的耐人工胃肠液能力,胃、肠液分别处理3、4小时后,菌株存活率在60%左右;24 h自凝集率达98%;A20对21种抗生素敏感,敏感率为80.7%.鉴于其较强的产酶和拮抗能力,同时具有一定的耐受性、粘附性和药物敏感性,体现出优良的益生潜能,可作为潜在益生菌株用于后续水产动物饲料益生菌制剂的开发利用.
