地塞米松通过下调Reelin表达抑制小鼠胚胎大脑皮质神经元迁移
2021-11-12苏画画黄瑞瑞王博延张天宝柴学军
苏画画,黄瑞瑞,刘 敏,王博延,张天宝,柴学军,徐 曦
(西安医学院基础医学部,陕西西安 710021)
糖皮质激素是一类具有神经活性的甾体类激素,在新生鼠神经系统发育阶段,糖皮质激素可引起脑源性神经营养因子BDNF的减少[1]。大剂量多疗程的糖皮质激素应用可引起体外培养的海马神经元炎症小体增加,导致神经元死亡[2]。由于妊娠晚期正是胚胎大脑发育的关键时期,母亲接受糖皮质激素治疗的新生儿精神和行为障碍风险显著增加[3]。目前,糖皮质激素的应用是如何引起胚胎大脑发育异常的报道却很少。
摇晃蛋白(Reelin)是一种大分子糖蛋白,胚胎发育期间主要由大脑皮质边缘区(Marginal Zone,MZ)的Cajal-Retzius(CR)细胞分泌,其对大脑皮质神经元迁移起着重要的调节作用。神经元在大脑皮质的室区出生,然后沿着放射状胶质细胞纤维向MZ迁移,最终以“由内向外”的方式形成大脑皮层的六层结构,即早出生的神经元定位于大脑皮质深部,晚出生的神经元定位于大脑皮质表层。Reelin通过与迁移神经元膜表面的受体结合,稳定细胞骨架,促进神经元向着Reelin阳性的MZ迁移[4]。当神经元胞体接触到Reelin阳性的MZ时,迁移停止。因此,Reelin既被认为是一种吸引信号,又被证明是一种终止信号[5]。缺乏Reelin的小鼠,大脑皮层六层结构翻转,边缘区充满神经细胞[5]。给孕鼠注射生胃酮可促进母体将糖皮质激素转给胚胎,引起仔鼠大脑皮质Reelin蛋白、Reelin受体VLDLR以及适配器Dab1蛋白表达下降[6]。说明糖皮质激素增加可导致仔鼠Reelin信号减弱。但孕鼠糖皮质激素的直接应用是否引起仔鼠Reelin信号的改变以及神经元迁移障碍,尚无明确报道。地塞米松(dexamethasone,简称Dxms)是一种人工合成的糖皮质类激素,可通过血脑屏障和胎盘屏障,本文通过建立母鼠孕晚期地塞米松暴露模型,研究地塞米松对仔鼠大脑皮质中Reelin表达以及神经元迁移的影响,阐明地塞米松对胚胎大脑皮质发育作用的分子机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级昆明小鼠,购自西安交通大学实验动物中心,饲养于西安医学院陕西省重点脑疾病研究所鼠房,室温18℃~23℃,湿度50%~60% ,保持每日12 h灯照与12 h黑暗交替。选择健康2~3月龄昆明雌鼠12只(体重30 g~35 g),雄鼠4只(体重35 g~40 g),按照3∶1雌雄比,于下午6:00同笼,次日晨查阴栓(阴道处乳白色、固态胶状物),查有阴栓者分笼饲养,并记为妊娠第0.5天(E0.5)。所有试验操作均符合西安医学院实验动物管理办法。
1.1.2 主要试剂 地塞米松磷酸钠注射液,中国辰欣药业股份有限公司产品;多聚甲醛,中国国药集团化学有限公司产品;琼脂糖(Agarose),美国Biowest公司产品;正常山羊血清,Triton X-100, SDS-PAGE凝胶制备试剂盒,5×蛋白上样缓冲液,三羟甲基氨基甲烷(Tris), 氨基乙酸(Glycine),十二烷基硫酸钠(SDS),Tris-HCl,氯化钠(NaCl),吐温T-20,均为美国Solarbio公司产品;多克隆山羊抗Brn2一抗,多克隆兔抗β-actin一抗,山羊抗小鼠或兔共轭辣根过氧化物酶HRP的二抗,均为美国Abcam公司产品;多克隆小鼠抗Reelin一抗(G10),驴抗山羊共轭的IgG Alexa-488,碘化丙啶(Propidium Iodide,PI),蛋白酶抑制剂,磷酸酶抑制剂,组织RIPA裂解液,均为美国Sigma-Aldrich公司产品;防荧光淬灭封片剂(Fluromount-G),美国Southern Biotech公司产品;BCA蛋白检测试剂盒,美国Pierce公司产品;聚偏二氟乙烯(PVDF)膜,牛血清白蛋白(BSA),化学发光液PierceTMECL Western Blotting substrate,均为美国Thermo Fisher公司产品。
1.1.3 主要仪器 振荡切片机(VT1000S),德国Leica公司产品;体视显微镜(Stemi 508)、共聚焦显微镜(SP8),德国Leica公司产品;凝胶电泳与成像仪(ChemiDocTMTouch Imaging System),美国Bio-Rad公司产品。
1.2 方法
1.2.1 动物分组与地塞米松用药 母鼠于妊娠第14.5天(E14.5)随机分为2组,各6只。试验组,于E14.5~E18.5,每天上午9:00~10:00腹腔注射0.4 mg/kg地塞米松磷酸钠注射液;对照组,注射等剂量生理盐水,其他同试验组。
1.2.2 脑组织固定及切片 试验组与对照组仔鼠于出生当天(P0)分别取6只仔鼠断头取脑,称重,用40 g/L多聚甲醛溶液浸泡固定24 h,之后置于0.1 mol/L磷酸缓冲液 (Phosphate buffer,PB,pH7.4) 12 h漂洗;经40 g/L琼脂糖包埋后,用振荡切片机将小鼠大脑作冠状切片,厚度为50 μm。
1.2.3 免疫荧光染色 切片用0.1 mol/L PB洗3次,每次15 min,之后用含50 mL/L正常山羊血清,2 g/L Triton X-100 的0.1 mol/L PB(pH7.4)封闭液室温孵育30 min,封闭非特异性抗原;封闭液加多克隆山羊抗Brn2一抗(1∶1 000),4℃孵育过夜;次日,回收一抗,切片用0.1 mol/L PB洗3次,每次15 min;在驴抗山羊共轭的Alexa-488(1∶300)二抗里室温下孵育2 h;0.1 mol/L PB洗3次,每次15 min,用PI染细胞核30 min;0.1 mol/L PB洗3遍,防荧光淬灭封片剂封片,激光共聚焦显微镜拍照。
1.2.4 大脑皮质蛋白质提取 实验组与对照组于P4各取4只仔鼠断头取脑,在体视显微镜下分离大脑皮质,按1 mL/g加入含10 g/L蛋白酶抑制剂和10 g/L磷酸酶抑制剂的组织裂解液RIPA,液氮快速冷冻,机械研磨,使组织彻底分解,4℃ 、13 000 r/min离心30 min。吸取上清液,用BCA蛋白检测试剂盒测蛋白质浓度后,立即用于Western blot检测或储存于-80℃。
1.2.5 蛋白免疫印迹检测(Western blot) 按照SDS-PAGE凝胶制备试剂盒说明书配方制胶(80 g/L的分离胶,50 g/L浓缩胶)备用。配制上样液:每20 μg蛋白加入5×蛋白上样缓冲液至终浓度为1×,终体积用纯水稀释为20 μL。上样液于金属浴中95℃煮5 min,取出后立即放冰上。蛋白样品经1×跑胶液(250 mmol/L Tris,1.9 mol/L Glycine,10 g/L SDS,加纯水至1 000 mL配成10×,pH8.6,稀释10倍为1×使用),用1×转膜液(181.5 mmol/L Tris,1.48 mol/L Glycine,加纯水至1 000 mL配成10×,再取100 mL加入200 mL甲醇加纯水至1 000 mL配成1×使用,pH8.3)。电转至PVDF膜上。封闭液为含50 g/L(w/v) BSA的1×TBST (200 mmol/L Tris-HCl,1.5 mol/L NaCl,加纯水至1 000 mL,稀释10倍为1×TBS,pH7.5。1×TBS中再加入10 g/L吐温T-20为1×TBST ),室温封闭膜1 h,一抗加入封闭液(小鼠抗Reelin抗体,1∶1 000;兔抗β-actin抗体,1∶1 000),4℃孵育过夜。次日漂洗后,膜在室温下用山羊抗小鼠或兔共轭辣根过氧化物酶HRP的二抗(1∶3 000,用1×TBST稀释)孵育1 h,用1×TBST洗3遍,1×TBS洗1遍,化学发光液PierceTMECL Western blot substrate 与HRP化学反应,凝胶成像仪检测发光信号和拍照。
1.2.6 Image J灰度测量 蛋白印迹检测的蛋白质条带灰度用Image J软件测量分析 (National Institutes of Health)。
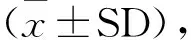
2 结果
2.1 地塞米松对仔鼠大脑重量的影响
孕鼠于E14.5~E18.5每天腹腔注射0.4 mg/kg地塞米松,基本情况良好,无明显异常反应,仔鼠出生后外观无明显异常。取P0仔鼠大脑,称重,对照组(A)脑重为177.76 mg±3.79 mg,地塞米松组(B)脑重为168.80 mg±4.24 mg。根据数据统计分析发现,与生理盐水注射的对照组相比,孕晚期地塞米松处理引起仔鼠大脑重量减轻,T检验结果如图1所示,差异极显著P<0.01,(图1)。
A.对照组;B.地塞米松处理组 A.Control group;B.Dxms treatment group
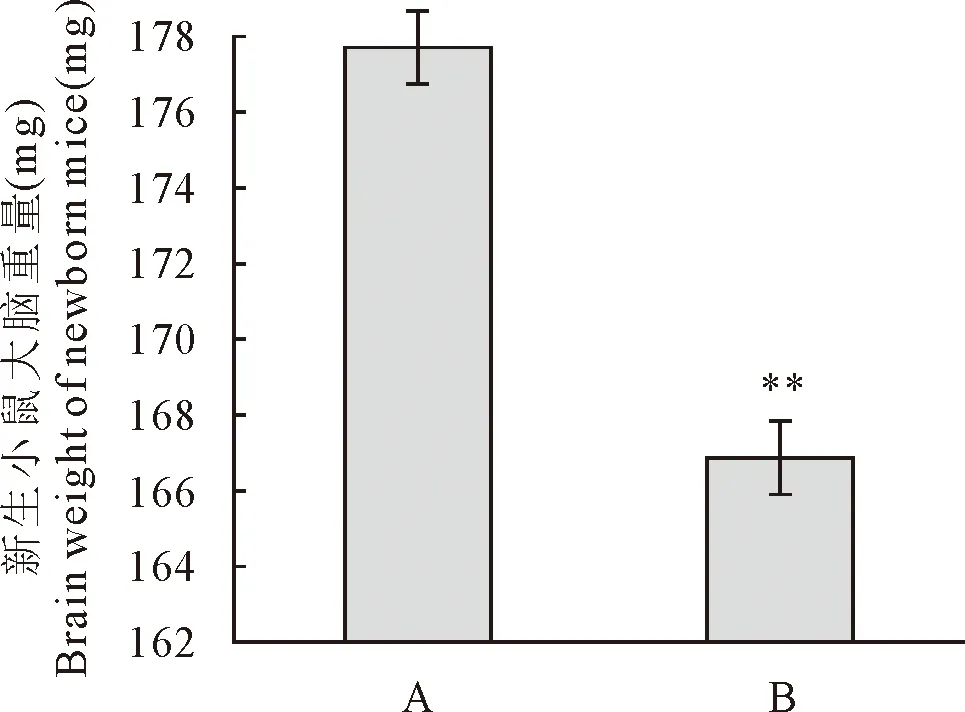
2.2 地塞米松对仔鼠大脑皮层神经元迁移的影响
为了研究孕晚期地塞米松暴露对仔鼠大脑皮层神经元迁移的影响,对E14.5~E18.5孕鼠腹腔注射0.4 mg/kg地塞米松,通过免疫荧光染色法用Brn2抗体标记仔鼠大脑皮层晚期出生的神经元,并用激光共聚焦显微镜拍照(图2),Ⅰ-Ⅵ表示大脑皮层六层结构;Ⅰ为大脑皮层第一层,即大脑皮层边缘区,主要由Cajal-Retzius细胞组成,这些细胞来自位于脉络丛以及将来发育为海马的暂时存在的结构组织;Ⅱ-Ⅲ为大脑皮层第二、三层,由最晚出生于大脑皮质室区的神经元组成,这些细胞以由内向外的方式迁移至此;Ⅳ为大脑皮层第四层,由出生于大脑皮质室区的神经元迁移至此组成;Ⅴ/Ⅵ为大脑皮层第五、第六层,由最早出生于大脑皮质室区的神经元迁移至此组成(标尺为80 μm)。
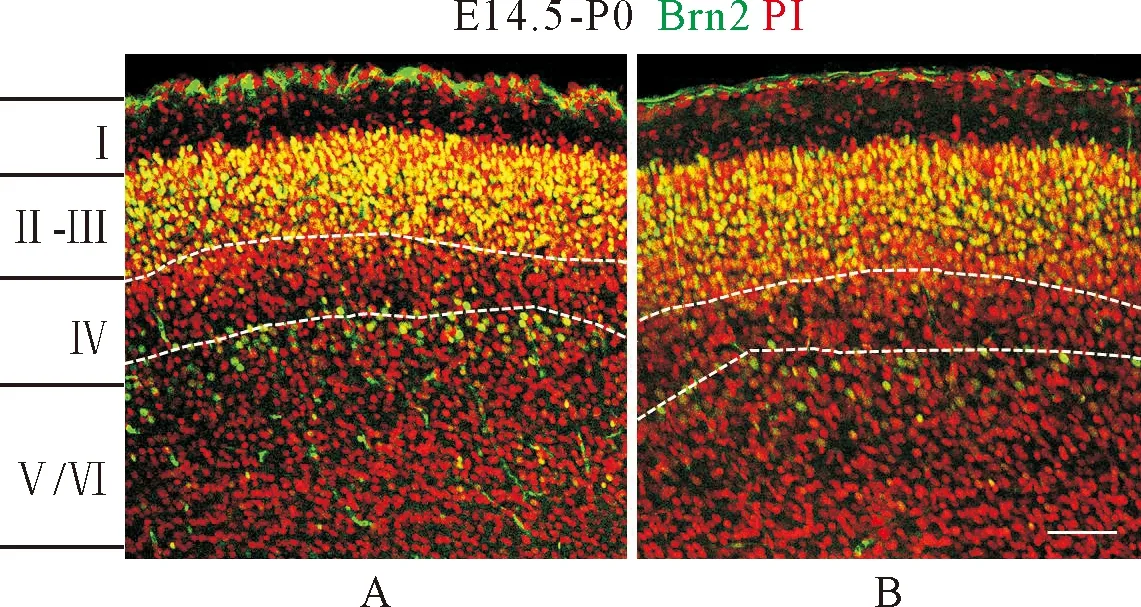
图2 孕晚期地塞米松暴露引起仔鼠大脑皮质神经元迁移障碍(10×)
结果发现,对照组(A)P0仔鼠大脑皮质中晚期出生的Brn2阳性(绿色)神经元都到达了大脑皮质的Ⅱ-Ⅲ层,即它们的最终目的地,而且细胞排列紧密;地塞米松组(B)P0仔鼠大脑皮质晚期出生的Brn2阳性神经元大部分也已到达Ⅱ-Ⅲ层,但与对照组相比,仍有很多细胞没有到达它们的最终目的地Ⅱ-Ⅲ层,而是聚集在Ⅱ-Ⅲ层下方,致使Brn2阳性细胞带增厚,但细胞密度稀疏,第Ⅳ层下移(虚线所示范围),说明孕晚期地塞米松暴露引起仔鼠大脑皮层神经元迁移障碍。
对照组与地塞米松组Brn2阳性细胞带的厚度测量结果显示,对照组(A)Brn2阳性细胞带的厚度为122.06 μm±5.37 μm,地塞米松组(B)为158.20 μm±9.54 μm;通过T检验分析地塞米松组与对照组仔鼠大脑皮质Brn2阳性细胞带的厚度,结果显示,地塞米松组较对照组明显增厚(P<0.001)(图3)。
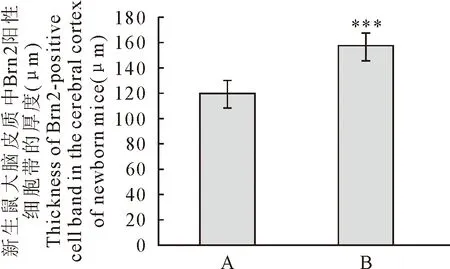
A.对照组;B.地塞米松处理组 A.Control group;B.Dxms treatment group
2.3 地塞米松对仔鼠大脑皮质Reelin表达的影响
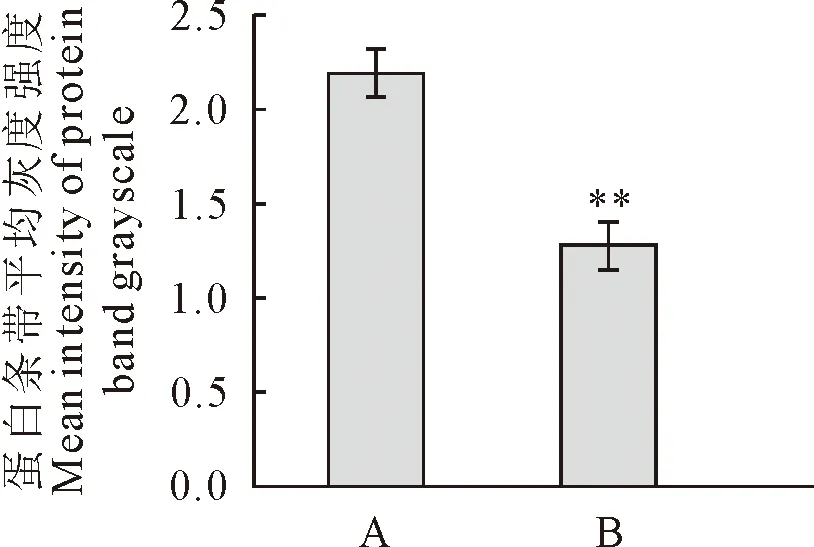
Reelin全长蛋白分子量约380 ku,分泌出来被基质中的金属蛋白酶剪切成大小不等的片段[6]。母鼠于E14.5~E18.5连续5 d腹腔注射地塞米松,P4仔鼠大脑皮质Western blot结果显示,地塞米松组(B)仔鼠大脑皮质中Reelin全长蛋白表达较对照组(A)减少。Actin蛋白作为上样对照(图4)。
用Image J测量蛋白质条带灰度密度,结果使用T检验的方法进行统计学分析,显示具有极显著差异(P<0.01)(图5)。

A.对照组;B.地塞米松处理组A.Control group;B.Dxms treatment group
A.对照组;B.地塞米松处理组A.Control group;B.Dxms treatment group
3 讨论
大脑皮质发育过程中,新生神经元由室区产生并向大脑皮质边缘带迁移。边缘带紧贴软脑膜,含有分泌Reelin 的CR细胞。室区不断产生的新生神经元穿过早出生的神经元,向表层迁移,到达Reelin阳性的边缘带停下来,形成“由内向外”的皮质板六层结构,即最早出生的神经元定位于皮质深处第Ⅵ层,而最晚出生的神经元则位于浅层Ⅱ-Ⅲ层[4]。大量研究发现,Reelin与神经细胞膜上的阿朴脂蛋白受体2(APOER2)和极低密度脂蛋白受体(VLDLR)结合共同调节神经元迁移。Reelin片段与神经元引导纤维上的APOER2结合,引起细胞内SFK家族的Src和Fyn激酶磷酸化,激活胞内适配器蛋白Dab1,从而引起肌醇磷脂激酶PI3K磷酸化,导致肌动蛋白解聚蛋白Cofilin磷酸化(p-Cofilin),使Cofilin失活,稳定细胞骨架,使神经元在皮质板内稳定迁移[4-5]。当神经元到达Reelin阳性的边缘带时,Reelin与神经元膜上VLDLR结合,导致神经元从放射状胶质纤维上脱落,迁移停止[5]。
本试验给妊娠晚期小鼠注射地塞米松,结果显示,仔鼠大脑皮质神经元迁移障碍,本应到达最终目的地Ⅱ-Ⅲ层的细胞还在Ⅱ-Ⅲ层的下方。为了探究地塞米松影响神经元迁移的机制,研究了给孕鼠注射地塞米松处理是否会影响仔鼠大脑皮质Reelin的表达,因为Reelin是大脑发育期间调节神经元迁移的重要分子。通过Western blot检测结果显示,地塞米松组仔鼠大脑皮质Reelin表达明显下降。说明地塞米松确实通过影响Reelin表达从而影响神经元迁移。然而,地塞米松是如何下调Reelin表达的机制仍然不是很清楚。
在胚胎发育期间,Reelin主要由边缘区的CR细胞合成分泌[4],出生以后CR细胞逐步凋亡,其分泌的Reelin也逐渐减少。此时,Reelin由大脑皮质及海马的γ氨基丁酸(GABA)中间神经元继续分泌,稳定大脑皮质及海马突触结构,增强学习与记忆能力[6]。研究表明,给孕鼠注射糖皮质激素引起出生前仔鼠大脑皮质Reelin信号改变,新生鼠空间学习与记忆障碍;给成年鼠反复注射糖皮质激素,导致成年鼠海马CA1区和齿状回颗粒下层Reelin阳性细胞显著减少,神经突触减少[7-10]。所以,孕晚期地塞米松的应用可能导致子代大脑皮质中Reelin 阳性细胞数量减少,Reelin表达下降。
糖皮质激素主要通过与糖皮质激素受体(glucocorticoid receptor,GR)结合发挥作用。GR属于核受体超家族,主要位于细胞质中,在大脑神经元中广泛分布。糖皮质激素为脂溶性激素,能够透过细胞膜进入细胞质结合并活化GR。GR以同源二聚体形式与DNA特定序列或糖皮质激素反应元件(GREs)相互作用,调控基因表达[11]。因此推测,地塞米松可能使仔鼠大脑皮质Reelin基因表达下降,导致CR细胞分泌Reelin蛋白减少。
地塞米松组的仔鼠大脑重量减轻,表明地塞米松可影响仔鼠的大脑发育。有文献证明,地塞米松对体外培养的成年大鼠海马祖细胞增殖有抑制作用[12]。地塞米松是否引起胚胎神经元增生减少尚有待进一步验证。研究证明,孕晚期母鼠地塞米松的反复运用可引起仔鼠大脑发育迟缓,神经元迁移调节因子Reelin表达下降,神经元迁移障碍。这些发现对于深入研究地塞米松在大脑发育过程中的作用机理有很大帮助,对指导临床用药,防止与发育相关的神经精神疾病的发生有着重大的临床意义。
本研究建立了妊娠晚期地塞米松暴露模型,利用免疫组织化学染色发现,地塞米松引起仔鼠大脑皮层晚期出生的神经元迁移障碍;Western blot结果显示,地塞米松引起仔鼠大脑皮质Reelin蛋白表达下降。这些发现提示,妊娠期地塞米松暴露对仔鼠大脑发育有明显的抑制作用,而这种作用可能与影响Reelin信号的正常传递有关。本研究为妊娠晚期用地塞米松可引起后代患神经精神性疾病提供了理论依据。
