亚洲璃眼蜱和小亚璃眼蜱Ferritin 2基因的原核表达及蛋白特性预测
2021-11-12翟雪洁宋瑞其郝蕴伟何文文郑会珍祖力亚克力木江刘一凡巴音查汗
翟雪洁,宋瑞其,郝蕴伟,何文文,郑会珍,祖力亚·克力木江,刘一凡,巴音查汗*
(1.新疆农业大学动物医学学院,新疆乌鲁木齐 830052;2.新疆农业大学动物科学学院,新疆乌鲁木齐 830052)
蜱是一种重要的吸血性体外寄生虫,是除蚊子外第二大病媒,不仅对动物和人体造成直接伤害,还是人畜共患传染病病原的传播媒介和储存宿主[1]。亚洲璃眼蜱(Hyalommaasiaticum,H.as)和小亚璃眼蜱(Hyalommaanatolicum,H.an)属于硬蜱科璃眼蜱属,主要分布于伊朗、哈萨克斯坦[2]、蒙古[3]、印度、巴基斯坦及中国新疆[4]和内蒙古[5]等地,是新疆的优势蜱种[6-7]。该蜱及其传播的疾病不仅对人类和动物的健康构成了威胁,而且造成了农牧民巨大的经济损失[8]。现如今,控制蜱虫的主要手段依然是化学药剂杀灭,但存在如药物残留、食品安全和环境污染等诸多问题[9]。抗蜱疫苗作为近几年的一个热点研发方向,不仅可以保护人和动物不受其侵害,还可以有效避免环境污染和耐药性等问题。铁蛋白(ferritin)为动植物体内广泛存在的一类储存铁的蛋白,在生物体内有调节铁代谢平衡、抗氧化胁迫、消除部分重金属和有毒分子的毒害等功能[10]。有研究表明 ,铁蛋白在没有获得性免疫系统的节肢动物的先天免疫中起着至关重要的作用[11-12]。蜱以吸血为生,在消化和吸收含有大量铁元素的宿主血液时,铁蛋白的功能显得非常重要。本研究基于H.as和H.an的Fer2基因序列构建重组质粒、原核表达重组蛋白并进行生物信息学分析,最后用纯化后的重组蛋白免疫 Balb/c 小鼠,制备鼠抗H.as和H.an重组蛋白多克隆抗体,并通过 Western blot 检测抗原性,以期为后续抗蜱疫苗研制筛选保护性候选抗原提供参考依据。
1 材料与方法
1.1 材料
1.1.1 蜱和实验动物 亚洲璃眼蜱和小亚璃眼蜱由新疆农业大学动医学院寄生虫实验室提供;清洁级Balb/c小白鼠购自新疆医科大学实验动物中心。
1.1.2 质粒与菌株 pGEX-4T-1、pET-28a载体由新疆农业大学动医学院寄生虫实验室提供;pEASY-T1购自北京全式金生物技术有限公司;大肠埃希氏菌DH5α、BL21(DE3)感受态细胞为Takara公司产品。
1.1.3 试剂 FastKing cDNA第一链合成试剂盒和质粒小提试剂盒,天根生化科技有限公司产品;琼脂糖凝胶回收试剂盒,美国Axygen公司产品;TRIZOL试剂、限制性内切酶BamHⅠ、EcoRⅠ和T4连接酶,Takara公司产品;其他常规试剂均为国产分析纯;所用水均为超纯水。
1.1.4 主要仪器 PCR仪(T100),美国Bio-Rad公司产品;高速冷冻离心机(CTR16-2),北京时代北利离心机有限公司产品;台式高速离心机(H1650),湖南湘仪实验室仪器开发有限公司产品;超净台(SW-SJ-2D),苏州净化设备有限公司产品;台式恒温振荡器(THZ-D),金坛市盛兰仪器制造有限公司产品;超声细胞粉碎机(JY92-IIN),宁波新芝生物科技有限公司产品;稳压电泳仪(DYY-Ⅲ-5),北京六一生物科技有限公司产品。
1.2 方法
1.2.1 蜱的总RNA提取及反转录 取实验室饲养亚洲璃眼蜱和小亚璃眼蜱半饱血雌性成蜱,分别用预冷PBS清洗后,置于液氮中进行研磨成粉未状,使用500 μL PBS重悬,加入2 mL Trizol试剂,于涡旋仪进行涡旋,之后按照Trizol RNA提取试剂盒的说明书进行操作;将提取的总RNA使用FastKing cDNA第一链合成试剂盒反转录为cDNA,置-20℃保存备用。
1.2.2 引物设计与目的基因的扩增 基于亚洲璃眼蜱Fer2基因序列(KT924235)和小亚璃眼蜱Fer2基因序列(ALJ92581.1)利用PrimerPremier 5.0和Oligo 6.24(绿色版英文)软件设计特异性原核表达PCR引物,引物序列信息见表1,由上海生工生物工程技术服务有限公司合成。
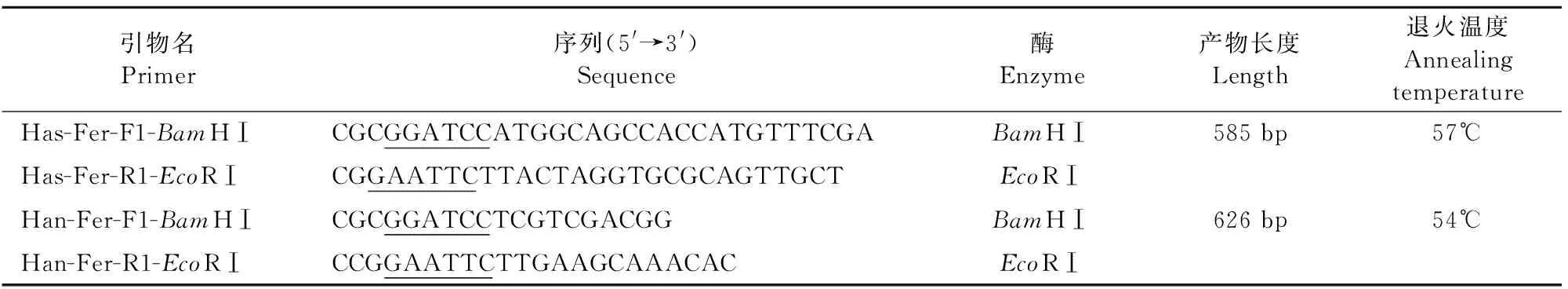
表1 表达载体构建引物
以cDNA为模板对Fer2基因进行PCR扩增。PCR反应条件:94℃预变性4 min;94℃变性30 s,57℃/54℃退火30 s,72℃延伸45 s,35个循环;72℃再延伸10 min。扩增的PCR产物用10 g/L琼脂糖凝胶电泳加以验证,并根据琼脂糖凝胶回收试剂盒说明书进行目的片段胶回收。
1.2.3 原核表达载体的构建 将回收的Fer2基因片段物连接到pEASY-T1克隆载体中,转化至大肠埃希氏菌DH5α感受态细胞,挑取单菌落分别接种至含100 μg/mL氨苄青霉素(rHasFer2)和卡那霉素(rHanFer2)的LB液体培养基中,收集菌液送上海生工生物工程技术服务有限公司进行测序。使用质粒小提试剂盒提取克隆质粒(pEASY-T1/HasFer2、pEASY-T1/HanFer2),分别对pGEX-4T-1、pET-28a空载质粒和克隆质粒进行双酶切(BamHⅠ和EcoRⅠ),回收空载和目的片段,使用T4 DNA连接酶于16℃过夜连接,然后将连接产物转化至大肠埃希氏菌DH5α感受态细胞,挑取单菌落,扩大培养,收集菌液送上海生工公司进行测序,测序正确后提取重组质粒pGEX-4T-1/HasFer2、pET-28a/HanFer2,并转化至大肠埃希氏菌BL21(DE3)感受态细胞,经筛选和扩大培养后,提取重组质粒进行双酶切(BamHⅠ/EcoRⅠ)验证。
1.2.4 蛋白特性预测 用生物信息学软件预测分析HasFer2和HanFer2的结构和功能。Prot Param软件(http://web.expasy.org/protparam/)分析蛋白的分子量及等电点等;TMHMM软件(http://www.ch.embnet.org/software/TMPRED_form.html)预测蛋白的跨膜结构域;SignalP-5.0 Server在线分析软件(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽;Antibody Epitope Prediction在线分析软件(http://tools.immuneepitope.org/bcell/)分析B细胞表位;利用在线分析软件SYFPEITHII(http://www.syfpeithi.de/bin/MHCServer.dll/FindYourMotif.htm)分析T细胞表位;PSORTII 在线分析软件(https://psort.hgc.jp/)分析亚细胞定位;使用SWISS-MODEL在线软件(https:∥swissmodel.expasy.org/)预测蛋白的三级空间模型,然后使用EzMol-2.1在线软件(http://www.sbg.bio.ic.ac.uk/~ezmol/)对蛋白进行建模,并对空间抗原表位进行标记。
1.2.5 rHasFer2和 rHanFer2 的表达及纯化 分别在含100 μg/mL氨苄青霉素(rHasFer2)和卡那霉素(rHanFer2)的LB培养基中进行扩大培养,至OD600=0.4~0.6时使用终浓度为1 mmol/L IPTG诱导5 h,测定rHasFer2和rHanFer2的表达情况。rHasFer2使用8 mol/L尿素超声破碎后,离心收集上清,分别置于4 mol/L、2 mol/L、0 mol/L尿素溶液以及 PBS 中进行蛋白复性和纯化[13];rHanFer2 使用His Trap亲和层析柱纯化,通过15 g/L的SDS-PAGE分析蛋白质表达和纯化情况。
1.2.6 免疫试验 使用9只6周龄~8周龄的无菌Balb/c雌性小鼠,分为3组,分别取100 μg rHasFer2/rHanFer2与等体积氢氧化铝佐剂进行涡旋乳化,分别免疫3只小鼠,采用背部皮下多点注射,对照组3只Balb/c小鼠注射等体积的磷酸盐缓冲盐水(PBS)。在免疫后的21 d断尾采血,分离血清并保存在-20℃备用。
1.2.7 SDS-PAGE和Western blot分析 取10 μL(约5 μg)rHasFer2和rHanFer2经SDS-PAGE电泳分离后,将分离的蛋白转移到PVDF膜上,使用封闭液(50 g/L脱脂乳,PBST稀释)于4℃进行过夜封闭;以免疫蛋白21 d的小鼠血清(1∶100 稀释)为一抗,以免疫 PBS的小鼠血清作为阴性对照,37℃孵育2 h;加入HRP标记山羊抗鼠IgG二抗(1∶1000稀释)于37℃孵育2 h。每个反应步骤之后使用PBS洗涤3次。最后滴加ECL化学发光试剂进行显色。
2 结果
2.1 原核表达载体的构建
构建pGEX-4T-1/HasFer2和pET-28a/HanFer2重组质粒,经双酶切验证插入基因片段大小与预期大小一致(图 1),测序结果为目的片段,表明重组质粒pGEX-4T-1/HasFer2和pET-28a/HanFer2构建成功。

A.pGEX-4T-1/HasFer2重组质粒;B.pET-28a/HanFer2重组质粒;M.DNA标准;1:酶切前;2:酶切后
2.2 蛋白特性预测结果
Prot Param软件分析HasFer2和HanFer2氨基酸序列的理化性质(表2)。通过在线分析软件TMHMM对HasFer2跨膜区预测,可知其1-193位氨基酸均位于胞外;SignalP-5.0对蛋白信号肽预测,可知的18-19位氨基酸是信号肽;B细胞表位预测结果(表 3)。 HanFer2跨膜区预测1-12位氨基酸位于胞内、13-30位氨基酸位于跨膜区、31-204位氨基酸位于胞外;信号肽预测是29-30位氨基酸;B细胞表位预测结果(表3)。均无T细胞表位。亚细胞定位预测结果表明HasFer2主要存在于胞外(66.7%)和分泌系统的囊泡(22.2%),且线粒体(11.1%)中也有少量分布;HanFer2主要分布于胞质(34.8%)和胞外(26.1%),且在线粒体(17.4%)、细胞核(8.7%)、分泌系统的囊泡(8.7%)和内质网(4.3%)中也有少量分布。利用在线SWISS-MODEL软件预测Fer2的3D模型,是由24个亚基组成的球形低聚物,使用EzMol-2.1对蛋白进行B细胞抗原表位进行标记,HasFer2和HanFer2(图 2)。

表2 氨基酸理化性质

表3 B细胞表位预测
2.3 rHasFer2和rHanFer2的表达、纯化及免疫印迹
重组质粒pGEX-4T-1/HasFer2和pET-28a/HanFer2导入BL21(DE3)感受态细胞中,用IPTG诱导表达rHasFer2(47.45 ku)和rHanFer2(28.95 ku)。rHasFer2以包涵体形式表达在沉淀中,用透析法复性纯化,rHanFer2使用His Trap亲和层析柱纯化,通过150 g/L的SDS-PAGE分析蛋白质表达、纯化情况(图 3)。重组蛋白大小与预期重组蛋白大小基本一致,纯化后蛋白条带单一。经Western blot分析表明,rHasFer2和rHanFer2均能被抗血清特异性识别。
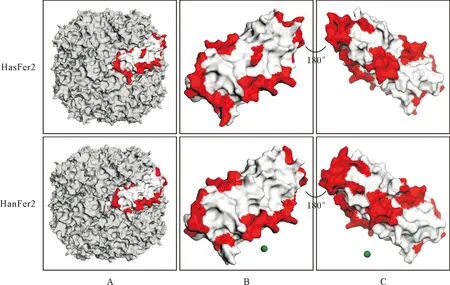
A.Fer2 3D结构,为24个亚基构成的球体;B.Fer2亚基模型,B细胞表位(红色区域);C.Fer2亚基向右旋转180°展示,B细胞表位(红色区域)

A:rHasFer2;M.蛋白分子质量标准;1、2.纯化前;3、4.纯化后;5.免疫印迹结果;6.阴性对照;B:rHanFer2;M.蛋白分子质量标准;1.纯化前;2、3.纯化后;4.免疫印迹结果;5.阴性对照A:rHasFer2;M.Protein Marker;1,2.Before purification;3,4.After purification;5.Western blot results;6.Negative control; B:rHanfFer2;M.Protein Marker;1.Before purification;2,3.After purification;4.Western blot results;5.Negative control
3 讨论
亚洲璃眼蜱和小亚璃眼蜱可传播出血热、立克次体病、莱姆病和森林脑炎等传染病,近年有新的蜱传病原被发现,如两种蜱均可传播的克里米亚-刚果出血热为烈性传染病,国内主要流行于新疆南部,人群普遍易感。Bm91、丝氨酸蛋白酶抑制剂(RAS-1、RAS-2、RAS-3 和 RAS-4)和铁蛋白 2[14]等作为抗蜱疫苗候选抗原,已研制出基于微小牛蜱 Bm86 基因的抗蜱亚单位疫苗,但存在宿主选择性和交叉保护效率不高的问题[15-16]。所以筛选可保护动物的优良抗蜱抗原尤为重要。宿主血液是蜱虫生存和繁殖所需能量的唯一来源,在蜱虫消化血液的过程中,不仅血液中的微生物会给蜱体造成损伤,而且铁元素过量亦会造成铁中毒。蜱有一种解毒机制,Fer2 在该机制中起到了维持铁平衡等重要作用,降解在中肠消化囊泡(血小体)中血红蛋白消化导致的过量血红素聚集,抵御过多铁带来的有害影响。国内有关寄生虫铁蛋白研究主要报道于蠕虫方面,在蜱方面研究了麻点璃眼蜱、钝刺血蜱、镰形扇头蜱和微小牛蜱等少数蜱种。在微小牛蜱铁蛋白研究中,其被认为在蜱体内起到对过多铁进行贮存和调控的解毒作用,使铁维持在正常生理水平[17]。在麻点璃眼蜱铁蛋白研究中显示,干扰 HrFer2 基因会显著削弱蜱的吸血功能[18]。有研究证明 Fer2 是蓖麻硬蜱肠道和周围组织之间非血红素铁的主要转运体[19-20]。本研究对亚洲璃眼蜱和小亚璃眼蜱 Fer2 进行跨膜、信号肽和蛋白亚细胞定位预测,结果显示两者均具有信号肽且在细胞外和囊泡中有定位,在亚洲璃眼蜱和小亚璃眼蜱体内 Fer2 蛋白可能被运输到膜外发挥作用。体液免疫应答在抗蜱保护方面的作用已在许多免疫研究中得到证实,疫苗效力与抗体应答直接相关,在长角血蜱的研究发现,吸食免疫 rHIFER2 的家兔血液的蜱饱血重量与对照组相比明显下降,并限制了长角血蜱的生长和繁殖[21]。本研究对 HasFer2 和 HanFer2 T 细胞表位、B 细胞表位预测和应用 SWISS-MODEL 基于同源建模的方法构建 Fer2 蛋白质三级结构的结果显示,虽然两者的 Fer2 蛋白可能不含 Th 细胞表位,不能介导细胞免疫,但均有 B 细胞表位且大部分暴露在表面,说明能较好的被识别和发挥功能,两者作为抗原可能使宿主体产生较强的体液免疫,在免疫小鼠试验中也得到了抗体效价较高的抗血清。本研究首次对新疆优势蜱种亚洲璃眼蜱和小亚璃眼蜱的 Fer2 基因进行了克隆,构建了重组质粒 pEGEX-4T-1/HasFer2和pET-28a/HanFer2,对 HasFer2 和 HanFer2 两个蛋白预测分析结果显示,两个蛋白均符合寄生虫免疫学诊断和免疫防控候选基因的特点,高效表达出 rHasFer2 和 rHanFer2 重组蛋白,免疫小鼠后能产生特异性识别该蛋白的抗体,进一步验证了蛋白具有良好的抗原性,为后续在该蛋白功能、蜱免疫防治和抗蜱亚单位疫苗的研究提供了理论依据。
