红花玉兰硬枝扦插生根解剖结构及酶生理响应研究
2021-11-12梁玉婷夏文胜段庆明
梁玉婷,夏文胜,王 朴,段庆明
(武汉市园林科学研究院,武汉 430081)
扦插是快速繁殖植物的方式之一,扦插通常利用植物茎、叶或芽通过适合的条件培育长成完整植株。扦插生根是首要解决的问题。插穗生根是植物再生的过程,通过化学物质激活根原基,促进生根[1],其中植物不定根的发生和生长与过氧化物酶(POD)、多酚氧化酶(PPO)和吲哚乙酸酶(IAAO)有紧密的联系[2],高等植物体内普遍含有的IAAO、POD、PPO 等酶类,在生根过程中呈现出规律性的变化,它们的活性在植物不定根生长和发育中起重要作用。吲哚乙酸(IAA)是植物体内最常见的主要内源生长调节剂,其含量随着吲哚乙酸酶和过氧化物酶发生一系列的动态变化,通过分解代谢维持植物体内的生长素含量,维持植物的正常生长发育,POD具有利用酚类和吲哚类化合物作为供氢体催化IAA氧化脱羧[3],高浓度的酚类物质在PPO 的作用下促进愈伤组织分化,进而合成促进生根的物质[4],PPO被认为是“生根素”的组成部分,影响细胞分裂、分化及根原基的产生和生长[5,6]。有研究认为,不定根表达时IAAO 活性较高,可降低体内IAA 含量以促进根的伸长[7]。有学者认为IAA 氧化产物可以促进根原基形成,酚类复合体可以促进根原基形成[8],也有学者认为在不定根表达期,较高浓度的IAA 促进不定根生长[9,10]。已知IAA 一个非常重要的生理功能是促进不定根的形成,而POD 能氧化IAA[11],难生根植物叶的POD 活性高,降解IAA 的作用强,叶中IAA 被破坏较多,向下输送的IAA 含量就会减少,这对诱导生根不利[12]。
茎是扦插生根的基础材料,茎的解剖结构与扦插生根难易有关[13]。张焕欣等[14]认为不定根的产生由外部环境信号和内部遗传因子共同作用,是一个复杂的器官发生过程,扦插生根过程可以分为4个阶段:愈伤组织形成的阶段、不定根的诱导阶段、不定根的发生阶段、不定根的伸长阶段[15]。扦插后可由愈伤组织、皮部诱导产生不定根,出现皮部生根、愈伤组织生根、愈伤组织兼具皮部生根3 种类型;有的插穗中存在少量潜伏根原基,插穗生根类型以诱导生根为主;不定根原基诱导产生于愈伤组织、木质部、形成层及次生韧皮部等部位[16]。一般存在潜伏根原基的树种扦插较易生根[17],皮部生根型植物为扦插后根直接从皮部伸出,不产生愈伤组织,或产生的愈伤组织与扦插生根无关,皮部生根通常在插穗切口附近或切口上方皮部产生。与愈伤组织生根相比,皮部生根型的根原基直接与茎维管组织相连,更有利于对水分养分的输送,有利于插穗后续成活,硬枝中皮层较薄,周皮中栓质化的木栓层层数较多,导致硬枝扦插生根较困难[18],外源信号刺激可诱导不定根原基的发生,甚至改变不定根发生类型,从而提高生根率并缩短生根周期[19-21]。
不定根的形成是木本植物扦插繁殖关键步骤,本试验材料红花玉兰(Magnolia wufengensisL.Y.Ma et L.R.Wang)是一种少有的高大观花落叶乔木[22],能适应华中至华北大部分区域的气候,可栽植于山体、街道、公园,是具推广价值的园林绿化树种,其繁殖方式仅靠嫁接及播种,至今扦插技术仍未取得突破进展,扦插生根率仅为36%~56%[23,24],而国内外对红花玉兰扦插生根机理研究较少,对于PPO 和IAAO 与红花玉兰不定根形成关系的研究就更少。本试验通过测定红花玉兰插穗在生根过程中IAAO、PPO、POD 活性,以及在扦插生根过程中的细胞解剖结构进程,以揭示难生根树种的IAAO、POD、PPO 与生根能力大小的内在联系,以验证红花玉兰扦插生根IAAO、PPO、POD 有动态响应,红花玉兰插穗生根方式为诱导式。
1 材料与方法
1.1 材料
试验材料红花玉兰采于湖北省武汉市园林科学研究院中试基地,生根诱导剂使用750 mg/L NAA 蘸1 min,清水处理组(CK)蘸清水1 min。
1.2 材料采集与处理
于2017年4月2日剪取无病虫害、直径约0.6 cm已经木质化的嫩枝作插穗,插穗保留2~3 个芽,长度约为10~12 cm,上切口平剪,距顶上端芽1 cm 左右,下切口在芽下方斜切,距芽0.5 cm 左右。准备50 穴穴盘6 组,其中3 组为试验组,另外3 组为对照组,分别进行扦插生根统计、酶活性处理、解剖结构用。穴盘中装入体积比为1∶1 的园土和沙作为扦插基质在扦插前灭菌,浇透水后,用筷子扎好小洞,备用;将剪好的插穗下端迅速在配置好的750 mg/L NAA 中浸泡处理1 min,对照组的插穗在清水中浸泡1 min。随后插入事先戳好的洞中,扦插深度为2~3 cm,然后抚平;每隔7 d 喷施1 次稀释1 000 倍的多菌灵溶液,另外每隔3 d 喷施100 mg/L 磷酸二氢钾溶液。
1.3 试验设计
自扦插日起,每隔7 d 取样一次,选取插穗基部2 cm 范围内的皮层剪碎混合均匀用于进行POD 和IAAO、PPO 活性测定。POD 采用愈创木酚比色法测定,PPO 采用邻苯二酚比色法测定[25]、IAAO 采用二氯酚比色法测定[26]。
每隔7 d 观察插穗的形态变化及褐化情况,随机选取5 支插穗,分别记录愈伤组织出现期、不定根出现期,于70 d 进行生根率统计。选取不同时期插穗各6 支,在其基部0.5 mm 范围进行石蜡切片,从细胞解剖学探究其不定根萌发机理[27]。
2 结果与分析
2.1 红花玉兰硬枝扦插生根外部表现以及生根率
红花玉兰插穗CK 组在处理7 d 后愈伤组织侧芽开始萌动(图1),同时部分插穗基部开始褐化,在后续时间褐化深度达2 cm 左右,萌发叶开展,21 d萌发叶干枯凋落,紧接着整个枝条褐化;清水处理组(CK)个别插穗在15 d 后出现愈伤组织,但直到35 d仍未出现不定根,且插穗几乎全部干枯。处理组一部分插穗下端在7 d 时出现0.5 cm 宽的褐化,在后续的时间褐化上升同时上端芽膨大伸展,14 d 时叶展开,21 d 时叶干枯,绝大部分插穗在扦插后7 d 处理组出现皮孔增大,少部分基部出现膨大现象,14~21 d基部出现白色愈伤组织,皮孔增大现象更普遍,28 d肉眼可见皮孔有小凸起,愈伤组织变毛糙,35 d 肉眼可见皮孔生根,愈伤组织生根,42 d 根继续生长,生根率为36%。从图2 可见,红花玉兰的生根方式为混合生根,即不定根产生方式有皮部生根和愈伤组织生根两种。

图1 红花玉兰扦插情况

图2 红花玉兰插穗基部的愈伤组织(a)和生根情况(b、c)
2.2 红花玉兰处理组插穗解剖研究
2.2.1 红花玉兰扦插前插穗茎基部 试验第1 天时,取样后得到的红花玉兰茎段横切显示了正常的组织结构(图3a、图3b),木质部有一个圆形的维管环和韧皮部,光学显微镜显示表皮以及从内至外的各层细胞,包括厚壁组织、初生木质部、次生韧皮部和木质部,以及一定数量的皮孔。
从插穗横切面观察到,由里向外依次为维管柱(维管束和髓)、皮层、表皮3 大部分(图3a),通过对插穗3 段不连续和3 张连续横切面切片进行观察,在插穗木质部、韧皮部、皮层、形成层等部位均未发现潜伏根原基,表明在红花玉兰的自然生长过程中其枝条内没有根原基存在。

图3 红花玉兰插穗茎基部横切面
2.2.2 红花玉兰生根过程 扦插7 d 后,观察到插穗基部切口处逐渐产生一圈白色或黄色的愈伤组织(图2),愈伤组织最初是一团近圆形、排列疏松、形状较大的薄壁细胞。14 d 茎段生根区域的横切面(激发阶段)显示拟分生组织日益增多,逐渐变成特化、典型的根原基(图4a),根从形成层中柱鞘向次生木质部和韧皮部延展;增加根原基的细胞数量和体积,并产生突出物在茎的外部。根原基的分化是观察它们向周皮的延伸垂直于主轴。扦插21 d 后,形成愈伤组织的薄壁细胞胞数量不断增加,其中一些细胞分化形成新的木质部和形成层,特化成具有根原始体特征的细胞在木质部外侧显现出来。具有根原始体特征的细胞继续分化成近圆形的细胞团,根原基团继续伸长(图4b)。
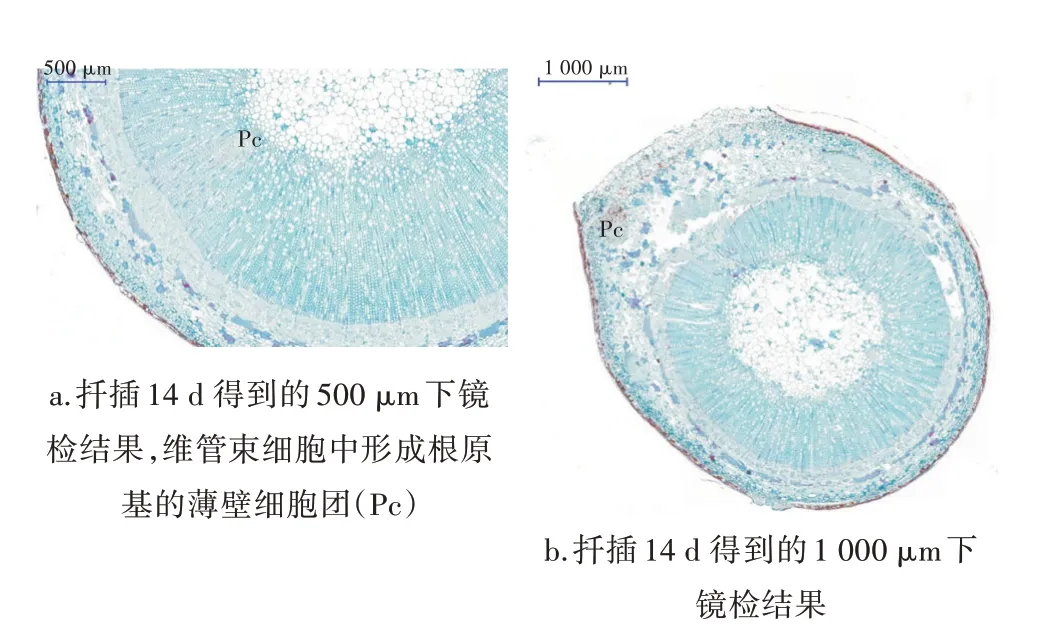
图4 红花玉兰插穗茎基部横切面
插穗扦插21 d 后,茎基部距切口5~10 mm 处皮孔开裂,有不定根产生(图2),该不定根起源于木质部和韧皮部之间维管形成层的具有强烈分裂能力的薄壁细胞,逐渐构成的分生组织团块继续进行平周和垂周分裂,形成不定根原基,根原基沿着韧皮射线伸展方向发展,形成不定根维管系统,并与插穗中的维管组织相连,内部出现明显的分层,逐渐形成具有根冠、分生区及伸长区结构的不定根,根穿越皮层,最终伸出周皮(图5);在28 d 时,根部横切显示,不定根冲出表皮细胞,向外延展(图6),正常情况下,在木本植物枝条的形成层处有许多特殊的薄壁细胞群,称为根原始体或根原基,这是产生大量不定根的细胞基础。通过细胞分裂,分化成钝圆锥形的根原始体,向外穿过韧皮部与皮孔相通,向内连接木质部与髓相通,为不定根的产生从髓吸取营养物质。根原基与外植体的气孔相通,部分根原基的顶端有一组细胞排成半圆形,形成根冠。根原基穿透表皮和周皮突出于外植体组织外,逐渐形成不定根。

图5 红花玉兰插穗茎基部横切

图6 红花玉兰插穗茎基部横切面
2.3 红花玉兰扦插生根过程中3 种氧化酶活性变化分析
2.3.1 吲哚乙酸氧化物酶活性变化 IAAO 含量变化影响不定根的形成,在扦插前期,IAAO 活性相对较低,有利于不定原基激活。在红花玉兰不定根诱导期,IAAO 活性升高,降低内源IAA 水平,与低浓度IAA 有利于生根的观点不同。由图7 可知,在扦插过程中清水处理组(CK)和生长调节剂处理的红花玉兰枝条相比,整体趋势基本一致,但在个别时间段有差别。扦插后生长调节剂处理组IAAO 活性直线上升,到28 d 达到顶峰,随后急剧下降;清水处理组(CK)IAAO 活性在扦插后前7 d 开始下降然后逐渐升高,到28 d 达到峰值。清水处理组(CK)和生长调节剂处理组IAAO 活性在14、21 和28 d 之间差异达极显著水平。
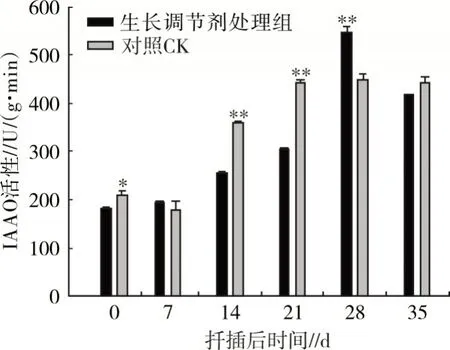
图7 红花玉兰扦插生根过程中IAAO 活性变化
2.3.2 多酚氧化物酶(PPO)活性变化 由图8 可知,扦插后生长调节剂处理组的PPO 含量远低于清水处理组(CK),生长调节剂处理组在前14 d 呈升高趋势,14 d 后开始下降,后期变化较小。清水处理组(CK)前14 d PPO 含量迅速升高,至14 d 后又急剧下降,21 d 后缓慢下降。生长调节剂处理组在7 d 内PPO 含量呈上升趋势,这个时期PPO 的活性不强,补充生长调节剂可能增加生根辅助因子的含量,促进生根。清水处理组(CK)组PPO 活性远高于处理组,这可能与其没有外在生长调节剂刺激有关,需要启动体内更多的生根辅助因子。在扦插的35 d,清水处理组(CK)和生长调节剂处理组插穗的PPO 活性差异显著,0、14、21 和28 d 差异极显著。
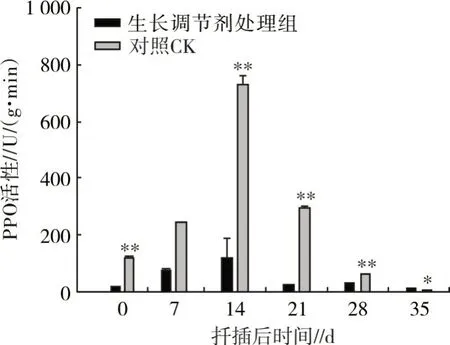
图8 红花玉兰扦插生根过程中PPO 活性变化
2.3.3 过氧化物酶活性变化 在整个试验过程中,生长调节剂处理组和清水处理组(CK)整体趋势一致,个别时间有差异。由图9 可知,生长调节剂处理组POD 活性在7 d 时呈下降趋势,之后持续增加,28 d 之前增加较缓慢,但在28 d 后快速升高。清水处理组(CK)插穗中过氧化物酶含量在21 d 内缓慢升高,21 d 后迅速升高。POD 普遍存在于植物体内,可氧化体内IAA,在生根前期,POD 活性逐渐上升氧化体内过多的IAA,在7 d 时补充生长调节剂后,POD 活性最低,可能在生根前期,外源生长调节剂含量对POD 活性有一个抑制作用。清水处理组(CK)与处理组间POD 活性分别在21 d 差异显著,7、28 d 差异极显著。

图9 红花玉兰扦插生根过程中POD 活性变化
3 讨论
3.1 植物过氧化物酶与生根的关系
扦插育苗是一种常用的无性繁殖手段,指在合适的条件下,利用植物枝条、茎、叶或芽培育生根,成长为完整的植株。扦插生根这个生理代谢过程与IAAO、POD、PPO 等酶类有重要关系。植物体内吲哚乙酸的水平主要受IAAO 调节,IAAO 氧化IAA,IAA 被氧化破坏后,失去活性,降低植物体内IAA 含量;另外,POD 也能氧化IAA,从而影响植物的生长。PPO 主要通过催化形成IAA-酚酸复合物来影响木本植物生根,在不定根形成时活性迅速上升,产生高浓度的IAA-酚酸复合物来促进生根。当植物受到损伤或病菌侵染后,PPO 催化酚与O2氧化形成醌,使组织形成褐变,以便恢复损伤,防止感染[28]。本研究结果显示,红花玉兰扦插生根可分3 个阶段:前2 个阶段要求低活性的IAAO 和POD,有利于维持体内较高活性的IAA 促进根的诱导和萌发;第三阶段则相反,高活性的IAAO 和POD 降解高活性的IAA,促进根的生长。本试验中清水处理组(CK)的PPO活性远高于生长调节剂处理组,较高活性PPO 催化醌形成,促使插穗基部褐化,这也可以解释清水处理组(CK)中全部插穗出现褐化,而生长调节剂处理组仅个别插穗出现褐化这一现象。
本研究结果显示,插条在愈伤组织形成阶段IAAO、POD 活性缓慢上升,PPO 活性呈先升高后降低的变化,但酶活性远低于清水处理组(CK)组,在28 d 左右,也就是生根后,其IAAO、POD 活性迅速升高,并达到高峰。Wiesman 等[29]认为,在根诱导期,较低的IAAO 活性有利于不定根的发育,从而促进不定根的生长;说明IAAO 能氧化IAA,通过调节IAA 活性来影响生根。IAAO 活性在前期较低,可能是因为插穗本身体内含有IAA,所以要外施生长调节剂促进插穗吸收,POD 活性在前期升高缓慢,可能与插穗在逆境中生长和愈伤组织的形成有关;PPO 在不定根形成时,活性上升,有可能产生高浓度的IAA-酚酸复合物来促进生根。本试验中酶活性变 化 与 前 人 结 论[30,31]一 致,与Gyana 等[32]、Klerk等[33]、Caboni[34]的结论不同,说明红花玉兰插穗生根需要较高活性的IAA。
3.2 生长调节剂与生根解剖结构的关系
根的发生分为4 个阶段:细胞的去分化、诱导阶段、根原基发生、根生长[31]。Caboni 等[34]认为,在生根初始阶段,较高的生长调节剂水平有利于根原基的形成。张娟等[35]认为,不定根发源于插穗内一些分生组织的细胞群,即根原始体。根原始体进一步分化成根原基,进而发育成不定根。在不定根形成过程中常伴随着愈伤组织的发生,它可以防止病菌入侵,保护伤口不致腐烂,营养物质不致流失,为插条生根创造良好条件。在多数情况下愈伤组织的形成和不定根的发生是同时发生,但却是独立进行的[36],这与本试验观察的结果一致。Sato 等[37]认为POD影响了生根过程,González等[38]和Caspar等[39]认为PPO 在根形成过程起关键作用,它通过控制根再分化过程中前体木质素的合成来影响生根。Ilczuk等[9]认为POX、PPO、IAAO 的作用可能在于调节生长调节剂水平,这对促进生根非常必要。
4 小结
红花玉兰不定根产生方式有皮部生根和愈伤组织生根两种,扦插前的红花玉兰插穗内无潜伏根原基存在,不定根由扦插后形成的诱生根原基发育而成,其中皮部产生的不定根起源于木质部和韧皮部之间维管形成层的薄壁细胞,愈伤产生的不定根是由愈伤组织自己形成的木质部外侧一些近圆形的薄壁细胞团特化而成。木兰科植物普遍具有难生根的特性,从目前结果看,红花玉兰也属于难生根的类型。低活性PPO、POD、内生高活性IAAO 有利于生根,需要额外补施生长调节剂以促进根。目前,关于红花玉兰扦插生根的研究较少,今后对于植物的扦插生根机理的研究需要更多的从生理生化、形态解剖、基因方面开展更深入的研究。
