细胞因子及炎症指标在发热伴血小板减少综合征与脓毒症合并血小板减少症鉴别诊断中的意义
2021-11-12贺文涛郑美娟李爱民
贺文涛, 郑美娟,李爱民
1.长江大学第二临床医学院 荆州市中心医院儿科,湖北 荆州 434020 2.安徽医科大学第一附属医院检验科,安徽 合肥 230022
发热伴血小板减少综合征 (sever fever with thrombocytopenia syndrome,SFTS)是一种由新型布尼亚病毒(severe fever with thrombocytopenia syndrome bunyavirus,SFTSV)感染引起的人畜共患急性传染性疾病。SFTS以发热、血小板和白细胞减少为主要临床表现,多数病例有乏力、消化道症状、肌肉酸痛和淋巴结肿大等临床症状, SFTS临床表现无特异性,易误诊。我国SFTSV感染平均病死率为 5.3%,其中重症病例病死率可高达25%。SFTSV为单股负链RNA病毒,属于布尼亚病毒科白蛉病毒属。SFTSV感染的病理生理学机制尚未完全清楚,相关研究表明适应性免疫功能损伤、促炎因子的增加及炎症瀑布效应的产生可能是其发病机制之一[1]。
近年来,脓毒症的发生率与死亡率仍在逐步上升,相关报道表明,脓毒症的病死率高达30%~70%,已经超过心肌梗死,成为重症监护病房(ICU)内非心脏病人死亡的主要原因[2]。脓毒症合并血小板减少症在临床上比较常见,临床表现以全身炎症反应综合征(systemic inflammatory responsesyndrome, SIRS)和血小板减少为主,其发生率高达19%~63%。相关研究表明,脓毒症合并血小板减少症发病机制复杂,细胞免疫受损和炎性细胞因子的异常诱导在其发生、发展过程中发挥重要作用,细菌感染为脓毒症发生的主要原因[3]。
目前,SFTS仍以SFTSV核酸阳性为主要确诊依据。但SFTSV核酸检测结果须由疾病预防与控制中心检测确认,且存在一定假阴性和漏诊率。脓毒症的诊断多依赖于传统的培养方法,一般需要2d才能检测出病原体形态、菌属等结果,且阳性率不高[4]。相似的临床表现和高病死率,导致SFTS与脓毒症合并血小板减少症在发病早期不易进行区别,从而延误治疗。该研究通过回顾性分析SFTS 确诊病例34例、脓毒症合并血小板减少症39 例发病初期的白细胞介素-6 (IL-6)、肿瘤坏死因子α(TNF-α)、C-反应蛋白(CRP)、降钙素原(PCT)、白细胞计数(WBC)、淋巴细胞计数(LYMPH)、中性粒细胞计数(NEUT)、中性粒细胞与淋巴细胞比值(NLR)、血小板计数(PLT)、红细胞分布宽度(RDW)、纤维蛋白原(FIB)和D二聚体(D-D)指标水平,以期提高对SFTS和脓毒症合并血小板减少症的认识水平,为SFTS和脓毒症合并血小板减少症早期鉴别诊断和治疗提供实验室依据。
1 资料与方法
1.1 一般资料
研究病例来自于2019年7月1日至2020年4月26日在安徽医科大学第一附属医院确诊的SFTS34例及2020年3月1日至2020年5月11日安徽医科大学第一附属医院收治的脓毒症合并血小板减少症患者39例,将2组分别命名为A组(SFTS组,34例)、B组(脓毒症合并血小板减少症组,39例)。纳入标准:A组根据《发热伴血小板减少综合征防治指南(2010版)》[5],具备以下病原学证据之一:①患者血清 SFTSV 核酸检测阳性;②血清免疫学检测阳性;③患者血清病毒分离培养阳性。B组符合美国重症医学会(SCCM)和欧洲危重病医学会(ESICM)发布的《2016拯救脓毒症运动:严重脓毒症和脓毒症休克管理治疗指南》[6]诊断标准,且入院24h内PLT≤100×109/L。排除标准:①1周之内使用过抗血小板药物的患者;②患有血液病、肝硬化、脾亢、自身免疫性疾病和外伤出血等影响PLT计数疾病的患者;③入院24h内死亡的患者。
A组患者年龄30~72 岁,平均50.79±11.72岁,其中男性17例,女性17例;B组患者年龄32~72岁,平均53.67±12.45岁,其中男性17例,女性22例。脓毒症合并血小板减少症39例患者感染情况:肺炎24例,腹腔感染6例,泌尿系感染4例,胃肠道感染4例,血源性感染1例。2组患者入院后均进行病情严重程度APACHEⅡ评分,A组8.5±3.6分,B组9.1±3.7分。2组研究对象年龄、性别、APACHEⅡ评分等基本资料比较,差异无统计学意义(P<0.05),有可比性。
1.2 检测方法
C8000全自动生化分析系统购自美国雅培公司;STAGO全自动血凝仪购自法国思塔高公司;XN9000全自动血液分析仪购自日本希森美康公司;mini VIDAS荧光免疫分析仪购自美国梅里埃公司;C6000全自动免疫分析仪购自美国罗氏公司。
所有患者入院当天或入院后1d内抽血,均采用XN9000 全自动血液分析仪进行血常规检测;采用STAGO全自动血凝仪检测FIB和D-D,采用C8000全自动生化分析系统检测CRP,采用mini VIDAS荧光免疫分析仪检测PCT;采用C6000全自动免疫分析仪检测IL-6、TNF-α。
1.3 统计学分析
应用 SPSS17.0统计软件进行数据分析,符合正态分布的计量资料采用均数±标准差表示,非正态分布的计量资料采用M(P25~P75)表示,对于符合正态分布的变量,采用两独立样本t检验;非正态分布的变量,2组之间采用 Mann-Whitney U 检验,P<0.05表示差异有统计学意义。绘制受试者工作特征曲线(ROC曲线),计算ROC 曲线下面积(AUC),以 AUC 评价诊断效能。
2 结果
2.1 2组患者WBC、NEUT、PLT、FIB水平比较
2组患者WBC、NEUT、PLT、FIB比较均有统计学差异(P<0.05),见表1和图1。A组WBC、NEUT明显低于B组(P<0.05),且A组WBC、NEUT低于正常范围者分别占73.53%(25/34)、64.71% (22/34), B组WBC、NEUT高于正常范围者分别占74.36%(29/39)、84.62%(33/39);A组PLT明显低于B组(P<0.05),且2组PLT均低于正常范围;B组FIB明显高于A组(P<0.05), 且A组FIB处于正常范围者占85.29%(29/34),B组FIB高于正常范围者占76.92%(30/39)。

表1 2组患者WBC、NEUT、PLT、FIB比较
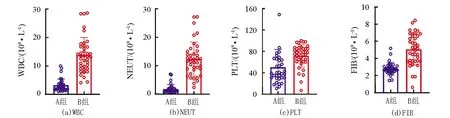
图1 2组之间WBC、NEUT、PLT、FIB对比Fig.1 Comparison of WBC, NEUT, PLT and FIB between the two groups of patients
2.2 2组患者IL-6、TNF-α、CRP、PCT、LYMPH、NLR、RDW、D-D水平比较
2组患者中PCT、CRP、RDW、NLR的比较均有统计学差异(P<0.05),见表2和图2。B组PCT明显高于A组(P<0.05),A组PCT处于正常范围者占76.47%(26/34),仅个别病例轻度升高,B组PCT明显高于正常范围者占97.44%(38/39),且升高明显[5.15(0.97~19.51)ng/Lvs0.14(0.05~0.51)ng/L];B组CRP明显高于A组(P<0.05),2组患者CRP均明显升高,且B组CRP升高幅度更高[78.80(37.10~126.75)mg/Lvs3.30(0.70~17.10)mg/L];B组NLR、RDW均高于A组,差异有统计学意义(均P<0.05)。 2组患者IL-6、TNF-α、D-D水平较正常范围均明显升高,但2组之间比较,差异均无统计学意义(P>0.05);2组患者LYMPH比较,差异无统计学意义(P>0.05)。
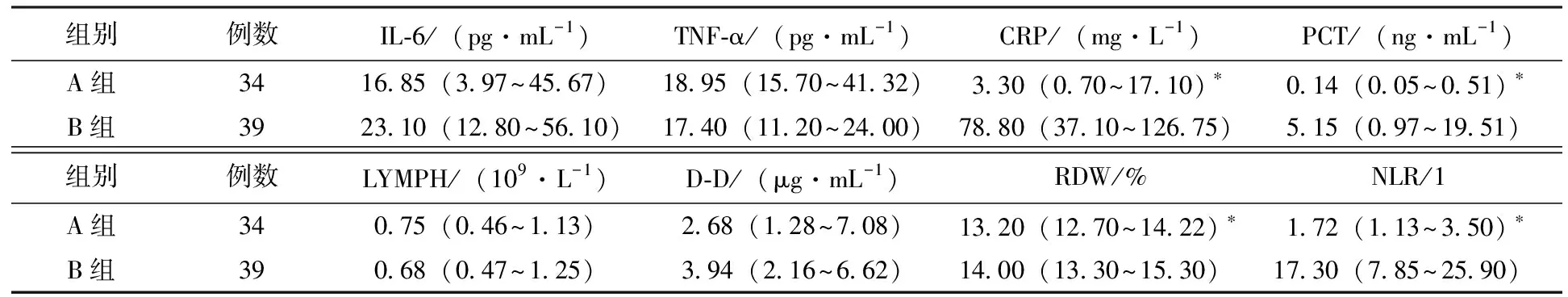
表2 2组患者IL-6、TNF-α、CRP、PCT、LYMPH、D-D、RDW、NLR比较

图2 2组之间CRP、PCT、RDW、NLR对比Fig.2 Comparison of CRP, PCT, RDW and NLR between the two groups of patients
2.3 2组差异具有统计学意义的实验室指标诊断效能的评价
ROC曲线分析显示(见表3和图3),WBC、NEUT、PLT、PCT、CRP、FIB、RDW、NLR检测预测SFTS患者的AUC依次为0.972、0.982、0.769、0.900、0.911、0.884、0.663、0.955,其中WBC、NEUT、PCT、CRP、NLR的AUC>0.9,具有较高的诊断效能。
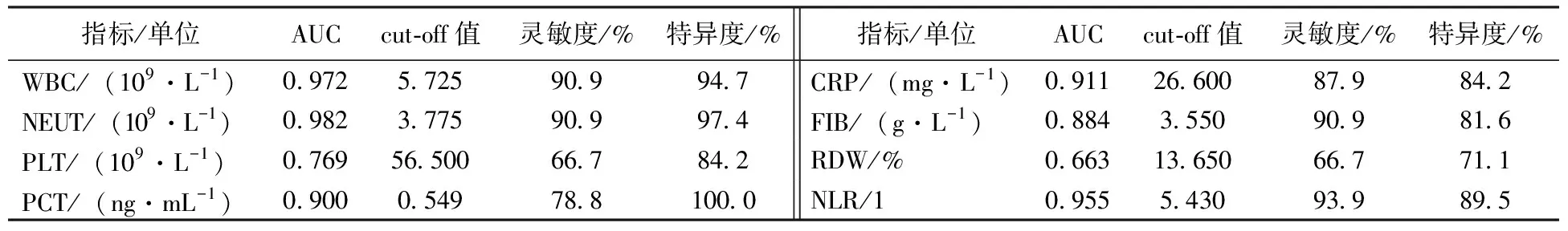
表3 WBC、NEUT、PLT、PCT、CRP、FIB、RDW、NLR用于预测SFTS患者的ROC曲线参数
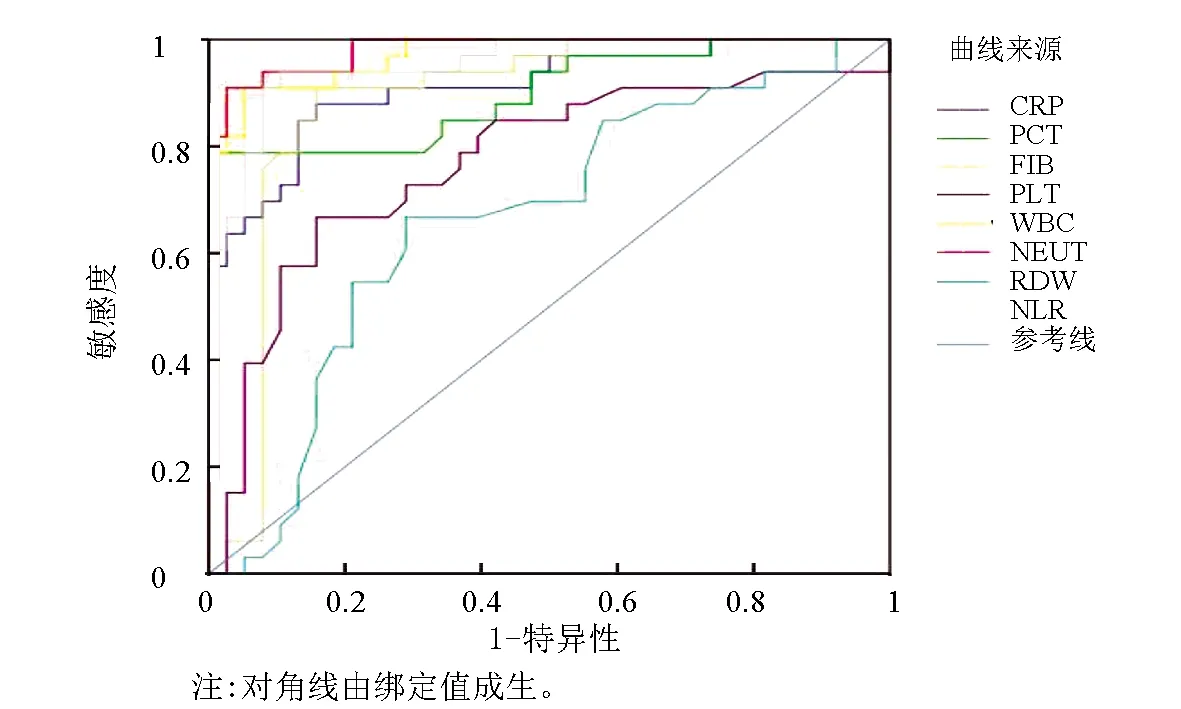
图3 WBC、NEUT、PLT、PCT、CRP、FIB、RDW、NLR检测 用于预测SFTS患者的ROC曲线Fig.3 Application of WBC, NEUT, PLT, PCT, CRP, FIB, RDW and NLR detection in predicting the ROC curve of SFTS patients
3 讨论
自2009年在河南某患者标本中发现我国首例新型布尼亚病毒以来,由新型布尼亚病毒感染引起的SFTS已在我国多个省份散发流行,发病率逐年上升,主要集中在4~11月,高峰期在5~7月[7]。目前研究普遍认为SFTSV主要通过蜱进行媒介传播,亦有报道SFTSV可通过体液、血液和气溶胶进行接触传播[8]。该研究SFTS 34例患者中,均出现发热、血小板和白细胞减少的临床症状,辅助检查提示合并心脏、肝脏、胰腺、消化道等多器官受损,临床表现与其他研究[1]一致。由于SFTS的发病机制尚未明确,临床表现缺乏特异性,较难与其他发热伴血小板减少的疾病相鉴别,从而延误患者治疗,导致病死率升高。研究通过对SFTS患者和脓毒症合并血小板减少症患者发病早期的细胞因子、血常规、相关炎症指标等实验室指标对比分析,以期在核酸检测阳性和病原体培养报阳之前,对两者的早期诊断和鉴别诊断提供实验室依据。
该研究的结果显示,脓毒症合并血小板减少症组患者PCT水平较正常范围明显升高,SFTS组患者PCT水平绝大多数处于正常范围,或轻度升高,2组之间比较,差异有统计学意义(P<0.05),PCT对SFTS患者具有较高的诊断价值(AUC>0.9)。相关研究[9, 10]表明,正常情况下PCT由甲状腺C细胞产生,在血浆中维持较低水平(<0.5ng/mL),当机体遭受细菌感染,细菌内毒素会刺激肝脏、肾脏、肺等器官的分泌细胞合成释放大量PCT,从而造成PCT水平的迅速升高;同时,由病毒引发的SIRS亦会使PCT水平升高,只是PCT升高水平不及细菌感染,因此临床上常用PCT作为细菌与病毒感染的鉴别指标,这与研究结果一致。脓毒症合并血小板减少症组CRP、FIB明显高于SFTS组(P<0.05)。CRP、FIB作为急性时相反应蛋白,在感染、组织损伤等多种疾病中都会升高,在脓毒血症中,CRP迅速升高,阳性率99%,但CRP对病毒感染缺乏敏感性,在病毒感染中大都处于正常水平[10]。FIB在炎症反应中升高慢,且不能很好区分细菌和病毒感染,不被看作鉴别细菌病毒感染的指标。研究中CRP(AUC>0.9)对SFTS的诊断效能优于FIB(AUC<0.9),与相关研究[10]一致。SFTS组PLT明显低于脓毒症合并血小板减少症组(P<0.05),且2组PLT均低于正常范围。有研究表明,SFTSV通过黏附在血小板上, 促进了巨噬细胞对血小板的吞噬作用,从而导致血小板数目大量减少[11];脓毒症合并血小板减少症主要是由于感染的过程中细菌和其他有害物质对血小板的破坏[12]。虽然两者血小板减少程度有差异,但是用PLT诊断SFTS效能不佳(AUC<0.9)。SFTS组WBC、NEUT、NLR、RDW明显低于脓毒症合并血小板减少症组(P<0.05),SFTS组WBC、NEUT绝大多数低于正常范围,而脓毒症合并血小板减少症组WBC、NEUT普遍高于正常范围,且WBC、NEUT、NLR对SFTS患者具有较高诊断价值(AUC>0.9)。WBC、NEUT增高是诊断细菌感染的经典方法,当细菌侵入机体时,储存池、边缘池NEUT大量释放到外周血中,NEUT作为固有免疫细胞,吞噬病原体的同时,释放大量炎症介质。SFTS患者外周血中WBC、NEUT、NLR水平降低的原因尚不明确,可能与SFTSV感染引发骨髓抑制以及过度的免疫应答、噬血现象等因素有关[13]。2组的RDW虽有差异,但是诊断效能不佳(AUC<0.9),可能因为2组病例都是在发病初期采血,而RDW发生变化需要疾病进展到一定程度。虽然2组IL-6、TNF-α、D-D水平差异不具有统计学意义(P>0.05),但2组IL-6、TNF-α、D-D水平均高于正常范围。相关研究[14, 15]认为,在严重的病原体感染过程中,存在炎症的过度反应和“细胞因子风暴”,IL-6、TNF-α 等细胞因子大量释放,产生过度的炎症反应,造成机体细胞损伤,同时大量细胞因子还可破坏血管内皮细胞,造成异常凝血,导致D-D升高。
综上所述,在SFTS与脓毒症合并血小板减少症发病初期,患者血液中PCT、CRP、WBC、NEUT、PLT、NLR、RDW、FIB水平存在差异,且WBC、NEUT、PCT、CRP、NLR对两者具有较高的诊断价值。但是,研究也存在不足之处,一方面入选病例数偏少,另一方面未对病例严重程度分层,希望在接下来的研究中,扩大样本量,进行分层分析研究,争取获得一个通用的诊断模型。
