基于逆向空间偏移拉曼光谱技术的多层混浊样品深层分析研究
2021-11-11李贺平赵天煜梁卓文
余 凡,李贺平,赵天煜,梁卓文,赵 航,王 爽*
1.西北大学光子学与光子技术研究所,陕西,西安 710069 2.中国人民解放军空军军医大学西京医院骨科,陕西 西安 710032
引 言
拉曼光谱分析技术可在分子水平上研究物质结构与生化组成信息,因具有出色的灵敏性、特异性以及技术相容性,已成为物质在线检测分析的重要工具。近年来,基于新型光谱激发和检测手段的拉曼光谱检测分析仪器极大拓展了相关技术在不同领域的应用深度和广度。然而,常规背散射式拉曼光谱检测手段极易受到样品表面荧光背景信号的干扰,无法实现样品深层光谱信息的检测与分析[1]。透射式光谱采集手段虽然可以克服样品表面所产生的荧光干扰,但是仍无法解析实验采集的内层混合拉曼光谱信息[2]。此外,基于光克尔效应(optical Kerr effect)的超快光谱检测手段可有效抑制样品表面的荧光背景,准确检测样品深层光谱信息,然而这一技术中所使用的高功率脉冲激光超过了活体生物组织所能承受的最大激光照明安全极限[3],从而限制了其在生物医学领域的广泛应用。因此,开发一种新型拉曼光谱检测技术,使其能够减少样品表面的荧光背景干扰、提高光谱探测深度和信噪比、改善其在多种研究领域(特别是生物医学研究)中的适用性,仍然是一项极具挑战性的工作。
空间偏移拉曼光谱(spatially offset Raman spectroscopy,SORS)作为一种新型拉曼光谱检测手段,能够有效抑制表层成分拉曼光谱和荧光背景干扰,在结合适当数据处理方法的条件下,特别适用于覆盖有不/半透明或高荧光背景材料的物质深层光谱信息提取[4]。SORS技术由Matousek等首先提出[5],当激光入射到被测组织表面并透射到组织内部时,直行光子将被侧向散射(瑞利散射与拉曼散射)或激发出宽带荧光,其中一部分散射光子经过多次散射后到达组织深层,并与深层组织成分发生各向同性的拉曼散射,组织内部不同深度处产生的拉曼散射光子溢出组织表面后,在与激发光照射位置距离Δs处被探测接收[6-7]。探测深度取决于激光激发区和信号收集区之间的距离,即空间偏移量(Δs)的大小。已经证明,SORS可用于研究多层漫散射样品中的子层物质构成信息,其探测深度通常为20 μm到5 mm,这超过了共聚焦拉曼光谱的探测深度极限[8]。此外,SORS利用满足活体光学检测功率要求的连续激光作为激发光源,能够无损、快速、定量化分析活体生物组织中的物质成分和结构信息,具有较为明显的临床应用优势[9]。
基于反向光谱激发与探测方式,逆向SORS技术采用半径可变的环形激发光束实现光谱激发,并在环形光束中心采集拉曼散射信号[7]。相比于常规SORS探测,通过使用半径可控的环形激发光束(Δs连续变化)并合理设计系统光学结构,逆向SORS光谱探测装置更便于集成、封装与使用。鉴于此,我们搭建了一套集成化逆向SORS光谱分析装置[10],并在不同空间偏移量条件下,实现了双/三层组织模型内深层拉曼光谱信息的检测与分析。通过本项研究工作,我们不但建立并验证了该集成化逆向SORS光谱分析装置的光谱检测能力,而且为该装置在经皮无损探测方面的应用研究奠定了实验基础。
1 实验部分
1.1 装置
图1(a)为集成化逆向SORS光谱分析装置示意图。该装置采用785 nm半导体激光器(MDL-III-785-lock,长春新产业,中国)作为激发光源,并通过光纤耦合与光束准直器(F260APC-780,Thorlabs,美国)实现均匀点光斑(直径约为3 mm)准直输出。采用785 nm带通滤波片(LD01-785/10-25,Semrock,美国)消除激光边带光谱分量或杂散光的影响后,采用5°锥透镜(AX255-B,Thorlabs,美国)将准直点光斑转换为环形激发光束,并将其都放置于同一个伸缩管中,保证它们沿入射光光轴方向的稳定移动。本装置的主要特点在于,通过将锥透镜移入/移出激发光路以切换逆向SORS和背散射式拉曼光谱两种不同的光谱检测模式。当锥透镜沿垂直方向[图1(a)的CD方向]插入光路,并沿着光轴的水平方向[图1(a)的AB方向]移动时,该装置为精确控制激发光束半径尺寸(Δs连续变化)可在样品表面形成同心光环的逆向SORS光谱检测模式;当锥透镜沿垂直方向[图1(a)的DC方向]移出时,该装置为背散射式拉曼光谱检测模式,可从样品表面提供零空间偏移的参考光谱,从而将环形照明光束变为样品表面上的点照明。点状/环形激发光束被二向色镜(Di03-R785-t1-25×36,Semrock,美国)投射于样品表面后,样品表面和内部溢出的漫散射拉曼光子,经近红外匹配消色差双胶合透镜对(MAP105050-B,Thorlabs, 美国)收集后,通过陷波滤波片(NF785-33,Semrock,美国)和长通滤波片(LP02-785RU-25,Semrock, 美国)组,由直径为100 μm光纤(QMMJ-3A3A-IRVIS-100/140-3AS-3, OZ Optics, 加拿大)传输至光谱仪。采集到的光谱信号,由光谱仪(UHTS300, WITec GmbH, Ulm, 德国)和背感光深度制冷电子倍增型相机(CCD, Du401ABR-DD-352, Andor Technology, Belfast, 英国)记录并分析。实验中,每次测量的积分时间为10 s,样品表面激发光功率约为150 mW。
1.2 激发光束半径计算方法
当半径为r0的准直激光束照射时,锥透镜将准直光束转换成环形光束照射到样品表面[7]。通过沿光轴方向[图1(a)所示AB方向]移动锥透镜,改变锥透镜到二向色镜之间的距离,精确控制激发光束的半径大小(Δs)。在几何近似下,圆环的宽度等于光束半径r0,与锥透镜到二向色镜的距离无关[7]。偏离的环形光束的角度由β=(n-1)α给出,其中α是图1(b)中锥透镜的底角,n是锥透镜的折射率。由于装置系统中使用了边长为50.8 mm方形笼形立方体(C4W,Thorlabs, 美国)和长度为7.6 mm透镜套管(SM1L03,Thorlabs,美国),因此,二向色镜的中心到样品位置的最大距离为33 mm[图1(b)中的MN,MN′为MN的共轭平面,MN=MN′]。如图1(b)所示,D是锥透镜的尖端到二向色镜中心的距离。假设α的角度较小,则光束在距离锥透镜D0处分离成环形光束[7]
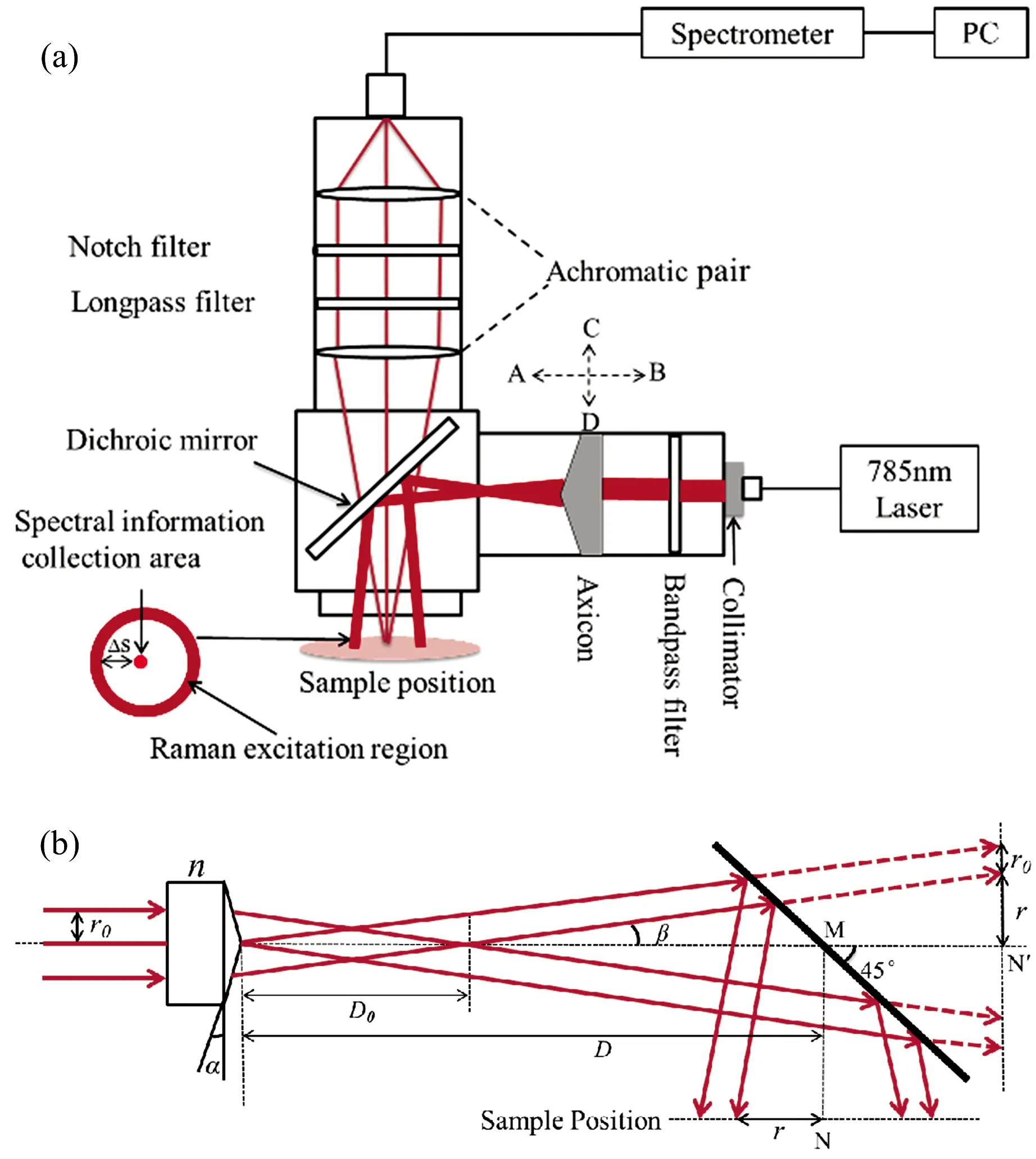
图1 (a)集成化逆向空间偏移拉曼光谱实验装置示意图;(b)锥透镜形成半径可控的环形激光束原理示意图
(1)
环半径(r)可根据公式计算
r=(D+MN′-D0)tan[(n-1)α]
=(D+33 mm)tan[(n-1)α]-r0
(2)
因此,D是锥透镜的尖端到二向色镜中心的距离,即环半径的函数
(3)
1.3 样品模型
为了验证集成化逆向SORS光谱分析装置的应用潜力,分别采用双层/三层生物组织模型用于实验光谱检测。实验中,分别将对乙酰氨基酚(石药集团,中国石家庄)贴于厚度为3和4 mm的羊肩胛骨上,制成双层生物组织模型;在厚度分别为3和6 mm硅橡胶和对乙酰氨基酚粉末上放置一层2 mm厚的猪皮,制成三层生物组织模型。羊肩胛骨和猪皮均在当地肉店购买,实验前用缓冲盐水冲洗干净附着的血液和杂质,并且使用商用切片机精确控制猪皮厚度,采用热压机制备厚度均匀的硅橡胶。
1.4 数据处理
每次实验之前,使用NIST可追踪校准灯(LS-1,Ocean Optics,美国)校准系统的光谱响应,采用硅片的521 cm-1特征峰校准系统检测波长。测量的光谱数据包括样品的拉曼散射和瑞利散射信号、表面的漫反射以及自体荧光、环境噪声等因素引起的背景噪声。使用WITec Project 4(WITec GmbH,德国)软件,对测量得到的原始光谱依次采用5阶多项式拟合和10点Savizky-Golay(S-G)平滑等方法,获得较为纯净的拉曼光谱。
2 结果与讨论
采用如图2(a)所示的双层组织模型,以0,4,4.5,5,5.5,6和6.5 mm的Δs条件,验证逆向SORS光谱分析装置检测能力。首先,在8个不同水平位置测量得到双层模型平均光谱[如图2(b)和(c)所示],并对每组光谱300~1650 cm-1波数范围的曲线下面积归一化。图2(b)和图2(c)的顶部和底部分别表示由共聚焦显微拉曼光谱仪(Alpha 500,WITec GmbH,Germany)单独测量所得到的羊肩胛骨和对乙酰氨基酚的标准参考拉曼光谱。
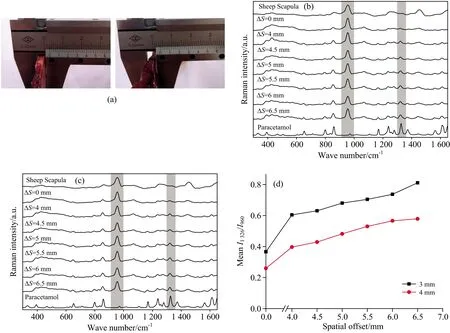
图2 (a)厚度为3和4 mm的羊肩胛骨样品图片;(b)羊肩胛骨厚度d=3 mm;(c)d=4 mm的双层生物组织模型在不同空间偏移量下获得的平均拉曼光谱,在顶部和底部分别显示单独测量的羊肩胛骨和对乙酰氨基酚的参考拉曼光谱;(d)对乙酰氨基酚特征峰(1 326 cm-1)和羊肩胛骨特征峰(960 cm-1)相对拉曼强度比和空间偏移量的变化关系
实验结果表明,羊肩胛骨的拉曼特征光谱中最强的拉曼峰是960 cm-1(phosphateν1mode),而1 070 cm-1(carbonateν1mode)和1 450 cm-1(—CH2bending of proteins)拉曼峰不太明显[11-12]。对乙酰氨基酚在857 cm-1(para-substituted benzene ring respiratory vibration)[13],1 238 cm-1(para-substituted benzene ring vibration)[13]、1 326 cm-1(amide CN stretching)和1 614 cm-1(C—C aromatic stretching peaks)处的拉曼峰比较明显[14]。如图2(b)所示,当Δs由0 mm增加至6.5 mm时,对乙酰氨基酚1 326 cm-1拉曼特征峰贡献逐渐增加,而羊肩胛骨960 cm-1拉曼特征峰贡献呈同步下降趋势。如图2(c)所示,当羊肩胛骨厚度增加到4 mm时,随着Δs不断增加,也可以观察到与图2(b)类似的结果。对比图2(b)和图2(c)可以发现,在相同Δs条件下,当双层模型中的羊肩胛骨厚度变大时,混合光谱中来自于羊肩胛骨的光谱贡献更高,而来自第二层对乙酰氨基酚的光谱贡献较低。
图2(d)是双层组织模型在不同羊肩胛骨厚度条件下,获得的对乙酰氨基酚1 326 cm-1和羊肩胛骨960 cm-1特征峰强度比(R),描述了对乙酰氨基酚和羊肩胛骨特征峰的相对拉曼强度比和空间偏移值的变化关系。结果显示,不同厚度所对应的R=I1 326/I960值均随着Δs的增大而增大。并且,当空间偏移值大于6 mm时,羊肩胛骨厚度为3 mm对应的相对拉曼强度呈加剧增长趋势,而羊肩胛骨厚度为4 mm对应的相对拉曼强度的增长趋势变得平缓。此外,在同一空间偏移条件(同一Δs数值)下I1 326/I960的值随第一层物质(羊肩胛骨)厚度增大而减小。这是由于随着环形光束的半径增大(即较大Δs数值),其激发的深层物质拉曼光子需要更长的光程才能到达接收焦点,深层拉曼光子信号损失程度比表面拉曼光子损失程度更大,导致相对拉曼强度增长变缓。对于给定的Δs,顶层样品厚度增加会导致来自顶层的拉曼光子贡献更高,从而减少第二层样品的拉曼光谱贡献。以上这些实验结果表明,我们所搭建的集成化逆向SORS系统可以通过4 mm或更大厚度的坚硬生物组织(例如羊肩胛骨)表面,无损探测其内部及其下层物质的生物化学信息。
图3(a)所示的三层组织模型用于验证该系统无损检测皮下组织状态的可行性。实验中,我们将厚度约为2 mm的猪皮置于顶部,3或6 mm的硅橡胶用作样品第二层,2 mm厚的对乙酰氨基酚粉末作为第三层。图3(b)所示为实验测得的猪皮、硅橡胶和对乙酰氨基酚的参考光谱;图3(c)和图3(d)是三层模型,在不同Δs条件下,实验采集得到的样品平均拉曼光谱。从图3(b)可以看出,猪皮拉曼特征峰主要分布于853 cm-1(Ring breathing mode of tyrosine and C—C stretch of proline ring)[15],935 cm-1(C—C stretching mode of proline and valine and protein backbone)[15],1 450 cm-1(—CH2bending of proteins)[12]等位置处。硅橡胶的拉曼特征峰主要包括490 cm-1(Si—O—Si stretch),711 cm-1(Si—C sym.stretch),790 cm-1(CH3asym.rocking, Si—C asym.stretch),863 cm-1(CH3asym.rocking),1 266 cm-1(CH3sym.bending)和1 412 cm-1(CH3asym.bending)[16]。对比图3(c)和(d)可看出,对于不同厚度硅橡胶的三层模型,随着空间偏移量的增大,猪皮1 450 cm-1拉曼峰的贡献逐渐减小,而硅橡胶490 cm-1拉曼峰和对乙酰氨基酚1 326 cm-1拉曼峰的贡献均逐渐增大。
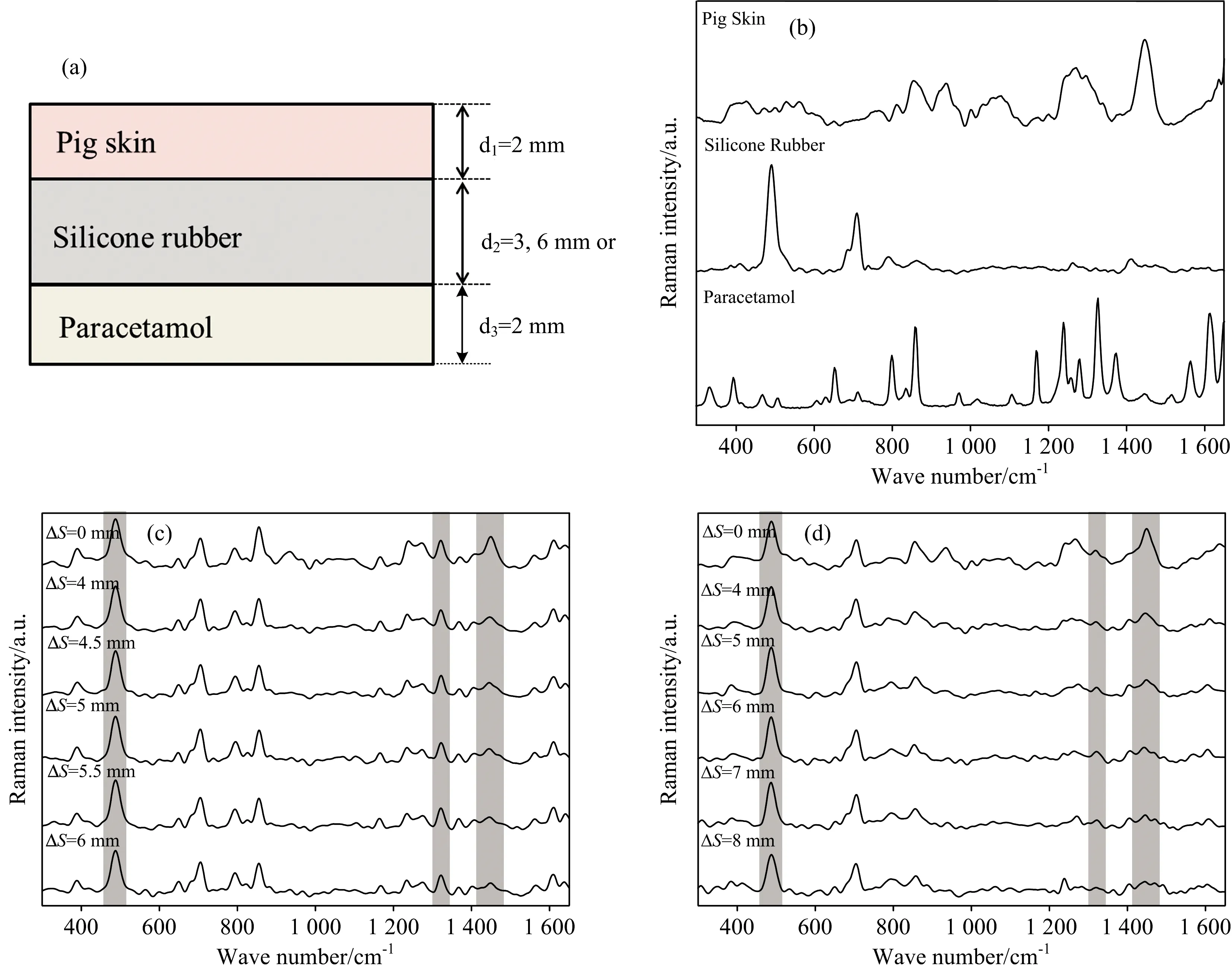
图3 (a)三层组织模型示意图;(b)猪皮、硅橡胶和对乙酰氨基酚的拉曼特征光谱;(c)3 mm硅橡胶和(d)6 mm硅橡胶组成三层组织模型在不同空间偏移量下测量的SORS光谱
图4(a)是三层样品模型在不同厚度硅橡胶条件下,硅橡胶(490 cm-1)和猪皮特征峰(1 450 cm-1)的相对强度比R=I490/I1 450。与之类似,图4(b)是对乙酰氨基酚(1 326 cm-1)和猪皮(1 450 cm-1)的相对拉曼强度比R=I1 326/I1 450。可以看出,对于硅橡胶厚度为3和6 mm的三层样品模型,I490/I1 450和I1 326/I1 450的比值随着Δs的增大而增大。然而,对于不同的硅橡胶厚度,当Δs≥4 mm时,I490/I1 450迅速增加;当Δs>5 mm时,I490/I1 450的增长趋势趋于平缓[如图4(a)所示]。通过比较图4(a)和(b)可以看出,当硅橡胶的厚度一定时,I1 326/I1 450相比于I490/I1 450来说增长趋势相对稳定。原因在于,底层物质(对乙酰氨基酚)在三层组织模型中的深度更大,从而需要更大的Δs检测条件才能收集到其拉曼散射光子信息。
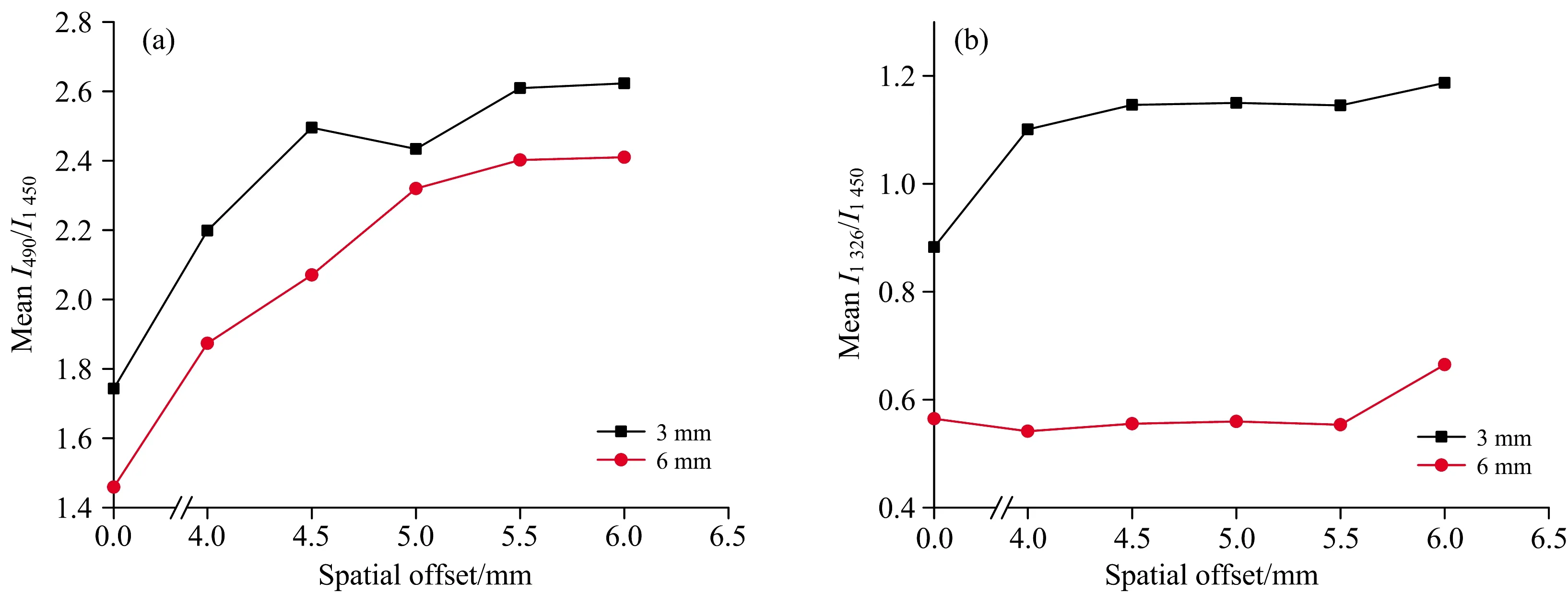
图4 (a)硅橡胶(490 cm-1)和猪皮(1 450 cm-1)的相对拉曼强度比和Δs的变化关系;(b)对乙酰氨基酚(1 326 cm-1)与猪皮(1 450 cm-1)的相对拉曼强度比和Δs的变化关系;硅橡胶厚度分别为3和6 mm
在搭建集成化逆向SORS光谱分析装置的基础上,我们通过采用双层和三层生物组织模型,实验验证了该套实验装置可探测8 mm深度位置生物模型内的拉曼散射信息。此外,随着Δs的增加,获取的SORS光谱中较深层的拉曼信号贡献也会增加,这更有利于深层物质组成信息的分析。在后续的工作中,我们在已知有关样品光学特性的条件下,需要进一步通过蒙特卡洛模拟等方法,分析给定空间偏移量条件下拉曼信号探测的近似深度。此外,虽然现有的结果验证了集成化逆向SORS光谱分析装置在经皮无损探测方面的应用潜力,但仍需要通过设计使用采集效率更高的光纤束结构与光谱收集方式提高系统的信噪比,从而进一步提高该系统的应用性能。
3 结 论
通过搭建集成化逆向SORS光谱分析装置,实现了多层组织模型深层光谱信息的快速、无损检测与分析。此外,结合集成化实验装置结构,根据几何光学理论和投影测量原理,量化表述了空间偏移量(Δs)与锥透镜空间位置之间的关系,为精确控制光谱检测条件提供了保障。具体实验过程中,分别采用羊肩胛骨/对乙酰氨基酚组成的双层模型和猪皮/硅橡胶/对乙酰氨基酚组成的三层模型,验证了该集成装置的探测能力。结果表明,根据深层与表层物质的相对拉曼强度比值关系,可以判断该系统具有从8 mm深度生物模型下获得光谱信息的检测能力,在突破了传统拉曼光谱技术的探测深度的条件下,有利于在体组织经皮无损深层光谱检测与分析。在这一研究工作基础上,仍需要进一步优化光学设计,使用采集效率更高的光纤束结构与光谱收集方式,提高该集成系统的信噪比,优化其在低浓度和弱拉曼散射材料光谱检测方面的适用性。
