多发胃肠间质瘤合并Ⅰ型神经纤维瘤病一例
2021-11-11徐红燕董千铜陈赛贞
徐红燕,吴 波,董千铜,陈赛贞
1台州市中心医院(台州学院附属医院)药剂科,浙江台州 318000
2温州医科大学附属第一医院胃肠外科,浙江温州 325000
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是来源于胃肠道间叶组织的肿瘤,发病率约为每年(10~15例)/百万人,具有多向分化的潜能,可出现在胃肠道任何部位,多发生于胃(60%~70%)和小肠(20%~30%),多个部位的多发肿瘤相对少见[1]。Ⅰ型神经纤维瘤病(neurofibromatosis type Ⅰ,NF-Ⅰ)是一种常染色体显性遗传病,约50%的患者有家族史,发病率约为1/3000,以异常皮肤色素沉着(咖啡牛奶斑)、多发皮肤结节及受累组织器官损害为特征性表现[2]。大多数病例为单个部位GIST合并NF-Ⅰ,多发GIST较为少见。温州医科大学附属第一医院胃肠外科于2019年5月5日至2019年6月13日收治了1例胃、十二指肠、空肠多个部位GIST合并NF-Ⅰ的患者,现报道如下。
临床资料
患者,女,69岁,因胸闷5 d,黑便1 d入院。患者入院5 d前出现无明显诱因活动后胸闷,不能耐受一层楼梯,休息可缓解,伴头晕恶心,无胸痛、呕吐、腹痛腹胀,未予重视。入院1 d前解黑便1次,量多,无恶心呕吐,无腹胀腹痛,于我院门诊急查胃镜示上消化道出血,给予对症处理后,收住入院。既往低血压10余年,慢性胃炎5年余,两次腹部多发神经纤维瘤手术。患者祖母、母亲、弟弟均有类似全身皮肤散在肿物病史。
体格检查体温37.0 ℃,脉搏67次/min,呼吸20次/min,血压132/66 mmHg(1 mmHg=0.133 kPa)。神志清,精神差,贫血貌。脸部、躯干和四肢皮肤可见多发大小不等结节状肿物,其中背部最大结节可达1.3 cm×2.0 cm,质软,无触痛、渗液或流脓,心肺听诊正常。腹壁柔软,无压痛,无反跳痛,未触及肿块。肠鸣音正常,4~6次/min,未闻及血管杂音。
辅助检查血常规:白细胞2.61×109/L,血小板207×109/L,血红蛋白57 g/L。胃镜:十二指肠降部见一大小约1.5 cm×1.5 cm黏膜下隆起,中央糜烂伴血痂(图1),诊断:慢性非萎缩性胃炎,十二指肠间质瘤伴出血可能。全腹部(上腹、下腹)增强CT:上腹十二指肠球部-降部旁、胰腺体尾部周围见多发软组织密度结节,边界尚清,大者约27 mm×27 mm大小,增强后动脉期见显著强化,延迟强化稍减退;腹壁皮下见多发稍高密度小结节,大者直径约4 mm;诊断:上腹多发占位性病变伴腹壁皮下多发小结节,神经纤维瘤病?肠道间质瘤?(图2)。
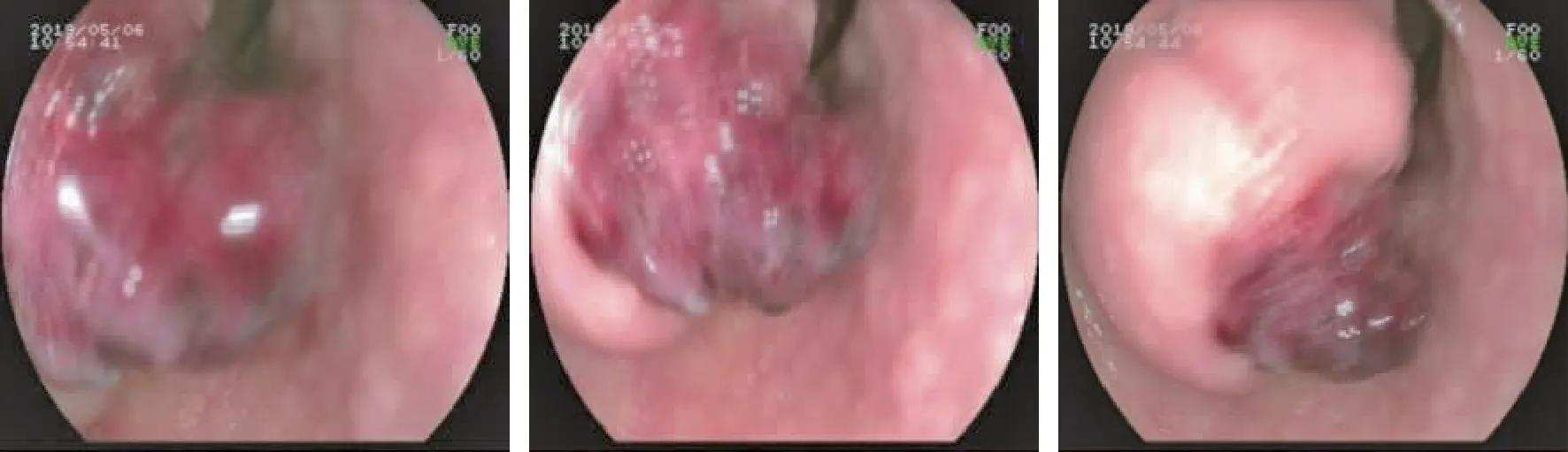
图1 患者十二指肠降部肿块胃镜表现Fig 1 Endoscopic appearance of descending duodenal mass
入院后诊断上消化道出血,十二指肠肿瘤,重度贫血,神经纤维瘤病。
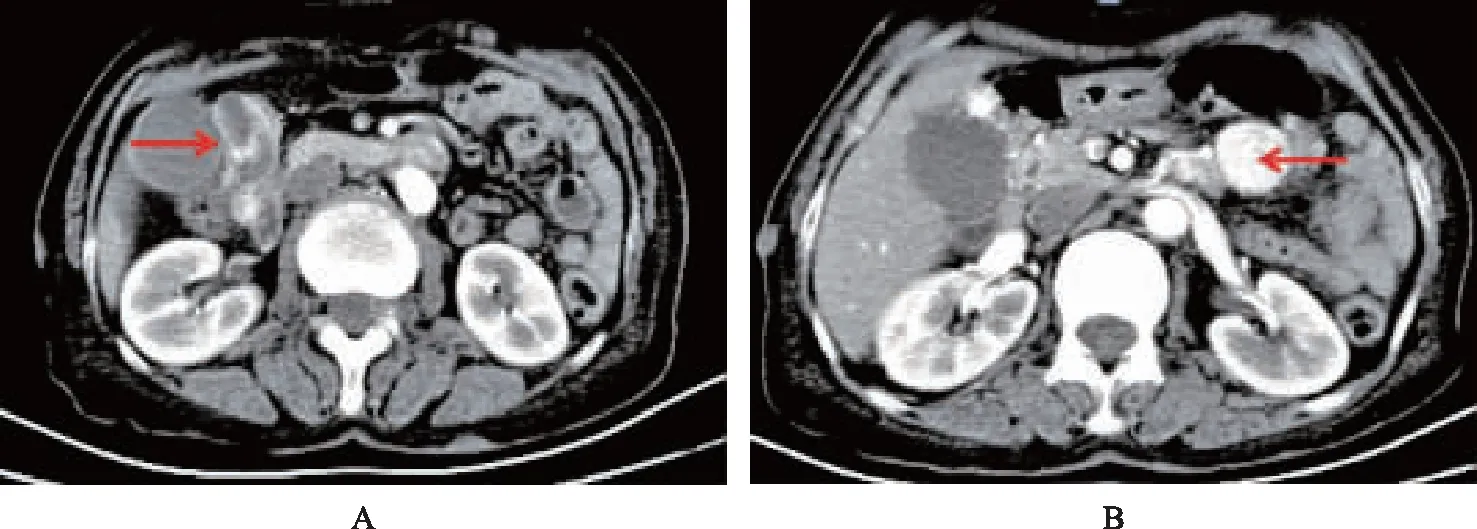
A.腹壁皮下多发小结节(箭头);B.十二指肠肿块(箭头)A.multiple subcutaneous nodules on the abdominal wall(arrow);B.duodenal mass(arrow)图2 上腹多发占位性病变伴腹壁皮下多发小结节CT表现Fig 2 Multiple space-occupying lesions in the upper abdomen accompanied by multiple small nodules under the abdominal wall
诊疗经过患者入院后给予禁食、输血、补液、制酸护胃、营养调理。全麻下行腹腔镜探查发现:十二指肠及空肠肠腔内见大量暗紫色血迹,胃体前壁、十二指肠降部、空肠近端见多发肿物,最大位于十二指肠降部,葫芦状,大小约3 cm×2 cm,累及全层,黏膜面见血管搏动,活动性出血。余肿瘤直径约1~3 cm不等,外生型,质软(图3)。术中冰冻提示:梭形细胞肿瘤,首先考虑间质细胞瘤。予行十二指肠病损切除+空肠病损切除+空肠-空肠端侧吻合+胃病损切除术。术后将胃肿物、十二指肠肿块、空肠肿物均送病理。病理结果提示:胃肿物2个,十二指肠肿块3个,空肠肿物6个,共11个,小者直径0.3 cm,大者大小2.5 cm×2.2 cm×2.0 cm,首先考虑间质细胞瘤。结合免疫组织化学检查结果:CD117(+),CD34(+),Desmin(-),Dog- 1(+),HE(已切),Ki- 67(<1%+),S- 100(-)SMA(-),符合间质瘤诊断,核分裂像<5/50 HPH(图4)。鉴于患者家庭经济情况,十二指肠和空肠基因同源性,只送检了空肠肿物基因检测,结果为C-Kit基因、PDGFR基因均无突变,对伊马替尼和舒尼替尼敏感性较低。

图3 患者十二指肠肿块大体形态Fig 3 Duodenal mass of the patient

图4 胃肿物(A)和十二指肠肿块(B)HE染色结果(×200)Fig 4 HE staining of gastric mass(A)and duodenal mass(B)(×200)
讨 论
GIST是胃肠道常见的间叶源性肿瘤,最常见的原发部位是胃和小肠。C-Kit基因或血小板源性生长因子受体α多肽(platelet-derived growth factor receptor-alpha,PDGFRα)基因突变是GIST重要的生物学特征[3]。有10%~15%的GIST不存在C-Kit、PDGFRα基因突变,即为野生型。Carney三联征[4]、Carney-Stratakis综合征[5]和NF-Ⅰ[6]是3个已知的与野生型GIST密不可分的相关综合征。NF-Ⅰ相关野生型GIST中,位于染色体17q11.2的NF-Ⅰ基因发生突变,可能是除了C-Kit与PDGFRα基因突变外,另一个导致GIST发生的重要机制[7]。
本例患者30余年前开始出现全身皮肤多发肿物,临床表现典型,且其祖母、母亲及弟弟均有类似疾病,根据1988年美国国家卫生研究会制订NF-Ⅰ的诊断标准[8],临床确诊NF-Ⅰ无疑。此患者术中胃肿物、十二指肠肿块、空肠肿物病理报告结合免疫组织化学检测结果CD34、CD117、Dog- 1均为阳性,S- 100蛋白阴性,符合GIST诊断。最终基因检测结果C-Kit基因第9、11、13和17外显子及PDGFRα第12和18外显子无突变,即为野生型GIST。符合NF-Ⅰ相关野生型GIST的特征:(1)主要发生于小肠;(2)可为多病灶GIST;(3)缺乏C-Kit基因或PDGFRα基因突变;(4)肿瘤直径多较小;(5)病程发展缓慢[9]。
临床上,术前明确GIST合并NF-Ⅰ患者的胃肠道出血和腹腔内多发肿块的性质存在困难,本例亦是如此。NF-Ⅰ疾病本身可累及消化系统,约10%~25%的NF-Ⅰ患者可有消化系统受累表现,如:出血、穿孔或肠梗阻等[10]。为了鉴别可能合并的消化道肿瘤类型,进行治疗策略的抉择,盆腔以及腹部增强CT检查是必要的,但无法完全鉴别是NF-Ⅰ还是GIST所引起。最终确诊需手术获取病理组织,进行免疫组织化学检测,再进一步行基因检测。手术对于可摘除肿物的GIST是最主要并可能治愈的治疗手段,治愈率可达60%[11]。伊马替尼为酪氨酸激酶抑制剂,是一种靶向治疗药物,为辅助治疗GIST提供了一种治疗选择,研究显示其疗效良好[12]。据报道,野生型GIST对伊马替尼治疗的反应率要显著低于突变型GIST,野生型GIST、C-Kit基因第9外显子突变GIST和C-Kit基因第11外显子突变GIST对于伊马替尼治疗的反应率分别为36.4%、47.8%和68.5%[13]。而进展期NF-Ⅰ相关的野生型GIST无法从伊马替尼治疗中获益[14]。虽有部分散发GIST对伊马替尼治疗有效,但因存在术后复发和耐药问题,野生型GIST合并NF-Ⅰ由于其病理学呈现低度恶性表现,总体预后较一般散发GIST良好[15]。相信随着更多科研成果和循证医学的发展,NF-Ⅰ患者胃肠道出血或腹腔肿物的诊断与治疗将得到更及时、准确的处理。
