舒尔经胶囊对原发性痛经模型大鼠下丘脑—垂体—卵巢轴功能的影响及机制研究*
2021-11-11陈贵芹
陈贵芹 董 黎 冯 燕 李 娜
河南省人民医院妇科,河南省郑州市 450000
原发性痛经(Primary dysmenorrhea,PD)又称为功能性痛经,指妇女在经期或行经前后,出现周期性下腹疼痛为主症,伴有其他不适,以致影响工作及生活[1-2]。PD是最常见的妇科疾病之一,据流行病学分析,PD发病率较高,且与不孕关系密切,严重影响妇女的生活质量和家庭幸福[3-4]。因此对PD的研究,已成为临床研究的热点之一。女性内分泌激素和月经生理周期与下丘脑—垂体—卵巢轴功能关系密切,而下丘脑—垂体—卵巢轴调节女性月经生理周期的作用,已被广泛研究[5]。非甾体抗炎药是临床治疗PD常用药物,但会引起患者胃肠道不适等不良反应,而中医治疗PD具有疗效好、毒副作用低等优点而被广大患者接受,然而中医药治疗PD的具体作用机制,也是大多学者探究的主要任务[6]。舒尔经胶囊(Shuerjing capsule,SC)由当归、牡丹皮、赤芍、柴胡、桃仁、陈皮、香附、牛膝、益母草、延胡索、白芍等中草药组成,有疏肝活血、调经止痛之功效,而被广泛应用于妇女经前期综合征、子宫肌瘤、宫腔粘连、气滞血瘀型痛经等妇科疾病[7-8]。然而SC治疗痛经的具体作用机制还不明确,这不利于SC的推广和被大部分国内外患者认可,故本研究建立大鼠PD模型,探究SC对PD大鼠下丘脑—垂体—卵巢轴功能的影响,以期阐明SC治疗PD的作用机制,为临床合理用药和中医药走向国际化,提供实验依据。
1 材料和方法
1.1 实验材料
1.1.1 动物:健康雌性SPF清洁级SD大鼠(6~7周龄,体重200~220g)购自广东省医学实验动物中心[SCXK(粤)2018-0002],饲养于本院动物饲养中心。饲养条件:自然光照,自由饮食,温度25℃,相对湿度50%。本研究经本院动物伦理委员会批准同意,批号为IACUC-01(20160917)。实验严格遵循3R原则。
1.1.2 主要试剂及仪器:舒尔经胶囊(批号:2019030201,购自海南博大制药厂,规格:0.5g/粒);布洛芬片(批号:2019020303,购自河北恒利集团制药股份有限公司,规格:0.1g/片);己烯雌酚注射液(批号:2018101302,购自上海通用药业股份有限公司,规格:2mg/支);卵泡刺激素(FSH)酶联免疫吸附(ELISA)试剂盒(货号:GD-E007278321,购自上海冠导生物工程有限公司);黄体生成素(LH)ELISA试剂盒(货号:JS15421,购自青岛捷世康生物科技有限公司);雌二醇(E2)、β-内啡肽(β-EP)ELISA试剂盒(货号:E-EL-R0348、E-EL-R0105,购自上海振誉生物科技有限公司);孕酮(P)、前列腺素E2(PGE2)ELISA试剂盒(货号:YE01938、YM-DS1604,购自上海远慕生物科技有限公司);前列腺素F2α(PGF2α)ELISA试剂盒(货号:Y102390,购自上海易汇生物科技有限公司);促性腺激素释放激素(GnRH)抗体、促性腺激素释放激素受体(GnRH-R)抗体、卵泡刺激素受体(FSHR) 抗体、促黄体生成素受体(LHR)抗体、雌激素受体(ER)抗体、孕激素受体(PR)抗体及β-EP抗体(货号分别为:ab189878、ab183079、ab137695、ab267899、ab75901、ab111691、ab167171,均购自美国abcam公司);BCA 蛋白定量试剂盒和胰蛋白酶(货号分别为P0768,P0231,均购自美国Pierce 公司)。蛋白电泳仪、半干转膜仪(型号1659001、Trans-Blot SD,美国Bio-Rad公司);凝胶成像仪(型号:GIS-500,Miulab公司)等。
1.2 方法
1.2.1 大鼠PD模型建立及分组给药:参照文献[9]构建大鼠PD模型,具体操作方法为:SD雌性大鼠随机分为正常组(Control),模型组(PD),舒尔经胶囊(SC)低(0.15g/kg)、中(0.21g/kg)、高(0.42g/kg)剂量组,布洛芬阳性对照组(阳性组,20mg/kg),每组10只。除Control组鼠注射生理盐水外,其余各组大鼠均于皮下注射己烯雌酚注射液,连续 10d,首日和第10天每只大鼠皮下注射 0.5mg己烯雌酚,其他时间每只大鼠每天皮下注射 0.2mg己烯雌酚建立大鼠PD模型。各组大鼠均于第10天注射己烯雌酚注射液后45min,经腹腔注射缩宫素2U/只,观察大鼠行为,若出现扭体反应(腹部肌肉收缩而内凹,臀部与一侧肢体内旋,躯干与后肢伸展)表明造模成功。各组大鼠于造模成功后开始灌胃给药,SC按成人—大鼠等效剂量换算成大鼠剂量0.15g/kg、0.21g/kg、0.42g/kg(相当于成人等效剂量的1/2、1倍、2倍),阳性对照组药物参照文献[10]进行设置,SC及阳性药物用生理盐水分别设置为0.015g/ml、0.021g/ml、0.042g/ml及2.000mg/ml的混悬液,各给药剂量组均按10ml/kg的体积灌胃给予相应剂量药物,Control组和PD组灌胃给予等剂量的生理盐水,各组均连续给药7d,2次/d。各组大鼠于末次给药45min后,Control组腹腔注射生理盐水0.2ml/只,其余各组大鼠腹腔注射缩宫素2U/只,观察30min 内扭体动物数、扭体次数、计算各组平均扭体次数。
1.2.2 各组大鼠子宫收缩抑制率和子宫指数:各组大鼠检测完扭体次数后,参照文献[10]用3%戊巴比妥钠麻醉,于下腹部正中行5cm切口,取出子宫,在左侧子宫角选3cm长一段,将子宫角的阴道端与卵巢端分别缝在塑料“丫”形支架上底的两端,在子宫两指点中固定一条棉线,自塑料管引出并连接至传感器,每组大鼠尾静脉注射缩宫素0.025U,记录大鼠子宫平滑肌的活动,检测结束称量子宫质量,并计算子宫收缩抑制率及子宫指数。子宫收缩抑制率(%)=(给予缩宫素后数值-给予缩宫素前数值)/给予缩宫素前数值×100%;子宫指数(%)=子宫湿质量/体质量×100%
1.2.3 各组血清FSH、LH、E2、P、PGE2、PGF2α及血浆β-EP含量检测:各组大鼠在检测完子宫收缩抑制率和子宫指数后,麻醉处死,迅速取大鼠颈动脉血6ml及下丘脑、垂体、卵巢和子宫组织,将组织迅速置于-80℃冰箱保存备用。血液取其中4ml置于不加抗凝剂的离心管中,静置,在3 000r/min、10min条件下离心分离后,取血清按放射免疫法试剂盒说明书检测生殖激素FSH、LH、E2、P含量,用ELISA试剂盒检测血清PGE2、PGF2α;剩余2ml血液迅速注入含有抑肽酶和乙二胺四乙酸(EDTA)的抗凝管中混匀,在3 000r/min、10min条件下离心分离后,取血浆,按放射免疫法试剂盒说明书检测血浆β-EP含量。
1.2.4 Western blot法检测下丘脑组织GnRH、垂体组织GnRH-R、卵巢组织FSHR和LHR、子宫内膜组织ER、PR及β-EP蛋白相对表达水平:取1.2.3中-80℃冰箱保存的下丘脑、垂体、卵巢、子宫内膜组织,于4℃冰箱中解冻后,分别用组织匀浆器匀浆,离心分离后取上清液,用蛋白提取试剂盒及BCA试剂盒提取蛋白并检测蛋白总浓度后,各取50μg蛋白上样,进行电泳和转膜反应,TBST溶液清洗后,加入5%脱脂牛奶室温封闭1h,TBST清洗3次后,加入一抗[GnRH、GnRH-R、FSHR、ER、PR、β-EP抗体稀释倍数为1∶1 000,β-actin(内参)稀释倍数1∶2 000],4℃孵育过夜,TBST清洗后加入HRP羊抗兔二抗(稀释倍数1∶2 000],室温孵育1h,TBST清洗3次后, 采用增强化学发光法显色,以凝胶成像仪观察条带并拍照,并以Image-J软件分析各组蛋白相对表达。
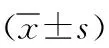
2 结果
2.1 各组大鼠扭体次数、子宫收缩抑制率、子宫指数检测 与Control组相比,PD组大鼠扭体次数、子宫指数均升高(P<0.05),子宫收缩抑制率降低(P<0.05);与PD组相比,SC低、中、高剂量组及阳性组扭体次数、子宫指数均降低(P<0.05),子宫收缩抑制率均升高(P<0.05),且SC各剂量组上述指标呈剂量依赖性;与SC高剂量组相比,阳性组上述指标差异无统计学意义(P>0.05),见表1。
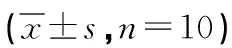
表1 各组大鼠扭体次数、子宫收缩抑制率、子宫指数比较
2.2 各组大鼠血清内分泌生殖激素FSH、LH、E2、P检测结果 与Control组相比,PD组大鼠血清FSH、LH、E2均升高(P<0.05),血清P含量降低(P<0.05);与PD组相比,SC低、中、高剂量组及阳性组大鼠血清FSH、LH、E2均降低(P<0.05),血清P含量均升高(P<0.05),SC各剂量组上述指标呈剂量依赖性;与SC高剂量组相比,阳性组上述指标差异无统计学意义(P>0.05),见表2。
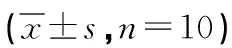
表2 各组大鼠FSH、LH、E2、P含量比较
2.3 各组大鼠血清PGE2、PGF2α及血浆β-EP含量检测结果 与Control组相比,PD组大鼠血清PGE2、PGF2α及血浆β-EP均升高(P<0.05);与PD组相比,SC低、中、高剂量组及阳性组大鼠血清PGE2、PGF2α均降低(P<0.05),血浆β-EP含量均升高(P<0.05),SC各剂量组上述指标呈剂量依赖性;与SC高剂量组相比,阳性组上述指标差异无统计学意义(P>0.05),见表3。
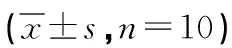
表3 各组大鼠PGE2、PGF2α、β-EP含量比较
2.4 各组大鼠下丘脑组织GnRH、垂体组织GnRH-R、卵巢组织FSHR和LHR蛋白表达结果 与Control组相比,PD组大鼠下丘脑组织GnRH、垂体组织GnRH-R、卵巢组织FSHR 和 LHR蛋白表达均升高(P<0.05)。与PD组相比,SC低、中、高剂量组及阳性组大鼠下丘脑组织GnRH、垂体组织GnRH-R、卵巢组织FSHR 和 LHR蛋白表达均降低(P<0.05),SC各剂量组上述指标呈剂量依赖性。与SC高剂量组相比,阳性组上述指标差异无统计学意义(P>0.05),见图1、表4。

图1 大鼠下丘脑组织GnRH、垂体组织GnRH-R、卵巢组织FSHR和LHR蛋白免疫印迹图
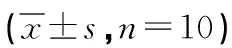
表4 各组大鼠组织GnRH、GnRH-R、FSHR、 LHR蛋白表达结果
2.5 各组大鼠子宫内膜组织ER、PR及β-EP蛋白表达结果 与Control组相比,PD组大鼠子宫内膜组织ER、β-EP表达均升高(P<0.05),PR蛋白表达降低(P<0.05)。与PD组相比,SC低、中、高剂量组及阳性组大鼠子宫内膜组织ER表达降低(P<0.05),PR及β-EP蛋白表达均升高(P<0.05),SC各剂量组上述指标呈剂量依赖性。与SC高剂量组相比,阳性组上述指标差异无统计学意义(P>0.05),见表5、图2。
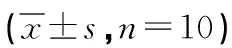
表5 各组大鼠子宫内膜组织ER、PR及β-EP蛋白表达结果

图2 大鼠子宫内膜组织ER、PR及β-EP蛋白表达免疫印迹图
3 讨论
PD虽无生殖器官病理损害,但其发病高、疼痛频繁,严重影响患者的工作和家庭[6]。PD发病机制复杂,西医认为,PGF2α、PGE2水平异常升高,可引起子宫平滑肌过强收缩和血管痉挛,而导致子宫缺血、缺氧和疼痛,故子宫内膜和血清中PGF2α、PGE2含量异常是造成痛经的决定因素[11-12],陈志辉[13]发现痛经患者出现血液PGF2α、PGE2升高等子宫收缩异常现象。子宫收缩异常,也可能引起生殖激素FSH、LH、E2、P分泌异常[14],Dai等[15]发现经前止痛方可通过调节人体FSH、LH、E2、P水平来改善PD患者疼痛症状。β-EP具有镇痛作用,与疼痛和子宫收缩有关[16],徐莉莉等[17]发现PD模型大鼠子宫组织PGF2α及垂体组织β-EP含量均高于正常组。本研究发现,与Control组相比,PD组大鼠血清PGF2α、PGE2、β-EP含量及内分泌生殖激素FSH、LH、E2含量均增高,P含量降低,而大鼠扭体次数和子宫指数也显著升高,子宫收缩抑制率降低,提示PD模型大鼠存在子宫收缩异常、生殖内分泌紊乱及疼痛等症状,表明造模成功。
目前,西医尚无理想的治疗PD方案,虽然非甾体抗炎类药和口服避孕药能在一定程度上缓解PD患者疼痛,但这些药物不良反应严重,而使临床应用受到限制,中医认为PD发病因素为寒凝、气滞、血瘀,且中医药在治疗PD方面有许多行之有效和独特的方法[6]。SC来源于我国著名中医药专家王绵之教授的临床验方,其在治疗PD方面有较好的疗效[7],李群等[18]发现舒尔经单一药物治疗原发性痛经, 安全有效, 不良反应少, 值得临床推广;张莉等[7]发现SC配合穴位埋线治疗气滞血瘀型PD疗效较好,且不良反应少。本研究发现,与PD组相比,SC低、中、高剂量组及阳性组大鼠血清PGF2α、PGE2、FSH、LH、E2含量降低、P及镇痛分子β-EP升高,大鼠扭体次数和子宫指数显著降低,子宫收缩抑制率升高,且SC各剂量组呈剂量依赖性,表明SC可改善PD模型大鼠子宫收缩异常、生殖内分泌紊乱及疼痛现象,对PD有较好的疗效。但SC治疗PD的具体作用机制还不甚明确,本研究对此进行继续研究,为SC的推广应用和走向国际化提供实验依据,具有一定的临床研究价值。近来研究发现,压力、情志、环境等应激作用可刺激下丘脑—垂体—卵巢轴功能,影响女性生殖激素分泌[19-20],而中医认为,情志失调,寒凝、气滞是导致PD发生的主要原因,故下丘脑—垂体—卵巢轴等功能失调也可能参与PD发病过程。垂体激素(Gn-RH、FSH和LH)和卵巢激素(E2和P)是导致痛经性风湿性神经内分泌功能障碍的主要原因之一[15],E2可引起下丘脑GnRH脉冲功能亢进的分泌,使垂体分泌过多的FSH和LH,而升高的LH又可刺激卵巢产生过量的E2和P,E2和P不仅可与子宫内膜ER和PR受体结合,影响子宫生理功能,还可进一步引起下丘脑GnRH脉冲功能持续亢进,从而引起恶性病理循环[21]。刘芳等[22]发现,针刺治疗PD后,大鼠下丘脑、垂体、卵巢组织中β-EP表达增高,下丘脑GnRH分泌及垂体、卵巢组织相关受体表达及痛经现象均减少,证明针刺可能通过增加下丘脑—垂体—卵巢轴中β-EP分泌,从而抑制GnRH、GnRH-R、FSH、LH、E2、ER产生的增加以及P、PR产生的减少,并抑制下丘脑—垂体—卵巢功能激活来实现治疗PD 的目的。本研究发现,与Control组相比,PD组大鼠下丘脑组织中GnRH、垂体组织中GnRH-R、卵巢组织中FSHR及LHR蛋白表达均增高、子宫内膜ER、β-EP增高,而子宫组织PR减少,提示血清E2及子宫组织ER升高,可能引起了下丘脑—垂体—卵巢功能亢进,使生殖内分泌激素紊乱,而子宫疼痛应激而产生镇痛物质β-EP,推测可能分泌的β-EP不足以抑制E2升高引起的下丘脑—垂体—卵巢功能激活。而与PD组相比,SC低、中、高剂量组及阳性组大鼠血清E2含量减少,子宫内膜组织β-EP增加,而下丘脑—垂体—卵巢轴组织及相关受体GnRH、GnRH-R、FSHR、LHR、ER表达也均降低,且上述指标呈剂量依赖性改善,推测SC药物作用可能增加β-EP表达并降低E2分泌,抑制了丘脑—垂体—卵巢功能亢进,改善激素分泌紊乱现象,从而改善大鼠疼痛现象。
综上所述,SC可抑制下丘脑—垂体—卵巢轴功能激活,改善PD大鼠生殖内分泌激素紊乱和疼痛现象,可能为临床治疗PD提供一定参考。但本研究还存在一定的不足,丘脑—垂体—卵巢轴功能调节内分泌生殖机制复杂,SC还可能通过其他途径影响下丘脑—垂体—卵巢轴功能,改善PD患者生殖内分泌激素紊乱和疼痛现象,这有待后续进一步验证和探究。
