匹诺塞林对缺糖缺氧/复糖复氧损伤SH-SY5Y 细胞内钙离子及Caspase-12 表达的影响
2021-11-11武彩霞马晓茜唐敏芳于宗琴李娅宁霍连广
武彩霞 马晓茜 唐敏芳 于宗琴 李娅宁 霍连广
匹诺塞林是中国医学科学院药物研究所研制的一种新型脑保护新药,属于黄酮类化合物,蜂胶中含量较高。已有多项研究资料证明,匹诺塞林有抗氧化、抗炎、抗凋亡、血管舒张等多方面药理作用[1-6],能减轻脑缺血再灌注损伤[7],但其作用靶点仍然不清楚。为进一步探讨匹诺塞林脑保护的作用机制,为寻找其作用靶点提供启示,本文用缺糖缺氧/复糖复氧损伤SHSY5Y 细胞模拟脑缺血再灌注损伤模型,观察匹诺塞林对细胞内钙离子[Ca2+]i 变化及Caspase-12 表达的影响。现报告如下。
1 材料与方法
1.1 药品与试剂 匹诺塞林冻干粉,批号 201804;SH-SY5Y 细胞株,中国医学科学院基础研究所提供;DMEM/F12 培养基,标准胎牛血清,Gibco 公司产品;胰蛋白酶、Sigma 公司产品;钙离子荧光探针Furo 4-AM,Invitrogin 公司产品;Caspase-12(SC-5627)一抗,美国Santa Cruz Biotechnology 公司产品,Dylight651-conjugated 荧光二抗:美国CST 公司产品。
1.2 主要仪器与设备 细胞孵育箱,日本三洋公司;高内涵细胞成像仪,英国Thermo Fisher 公司;超净纯水仪,美国Beckman 公司。
1.3 实验方法
1.3.1 SH-SY5Y 细胞培养 SH-SY5Y 细胞在含有10%胎牛血清的DMEM/F12 基质中培养,每2~3 天换液1 次。细胞呈对数增长时,加0.25%胰蛋白酶消化,200 μl/孔(5000 个/孔)接种在96 孔培养板中,培养24 h 后,更换无糖EBSS 平衡盐溶液(154 NaCl,5.6 KCl,5.0 HEPES,3.6 NaHCO3,2.3 CaCl2,pH 7.4;单位mmol/L)[8],随机分为OGD/R 组及匹诺塞林低剂量组、中剂量组、高剂量组,OGD/R 组不加任何药物;匹诺塞林低剂量组、中剂量组、高剂量组调整终浓度分别为0.01、0.10、1.00 μM。三气培养箱中培养。培养条件:37℃,5%CO2,1%O2,94%N2;培养2 h 后,移除培养液,更换完全培养基,复糖复氧培养。培养条件:37℃,5%CO2,饱和湿度下培养12 h。对照组更换完全培养基,正常条件下培养。
1.3.2 匹诺塞林对细胞Caspase-12 表达的影响 根据细胞凋亡的研究结果(另文发表),高内涵成像分析内质网应激损伤的SH-SY5Y 细胞内Caspase-12 表达的变化。
上述细胞继续培养12 h 后,用预温的PBS 洗涤细胞3 次,37℃条件下,4%多聚甲醛100 μl 固定20 min。吸除固定液,PBS 再洗涤3 次,用0.5% Triton X-100/PBS 100 μl 室温条件下孵育10 min 后,PBS 再洗涤3 次;用含2%胎牛血清的PBS 37℃孵育60 min,吸除,加入一抗50 μl(1∶200 稀释)4 ℃孵育过夜;吸除一抗,PBS洗涤3 次后,加入Dylight651-conjugated 荧光二抗50 μl(1∶200 稀释)避光孵育2 h(37℃);吸除二抗,PBS 洗涤2 次,弃去上清,最后加入PBS 200 μl 于高内涵成像仪拍照分析。
1.3.3 匹诺塞林对细胞内钙离子的影响 预先用0.01%多聚赖氨酸包被96 孔板,按前述方法接种细胞。除去培养基,使用HBSS 溶液洗涤细胞3 次。每孔加入Fluo 4-AM 工作液(用HBSS 溶液稀释配制,浓度5 μM)50 μl,37℃孵育30min。用HBSS 溶液洗涤细胞3 次,每孔加入100 μl HBSS 溶液,高内涵成像仪拍照分析。
1.4 统计学方法 采用统计学软件SPSS18.0 进行统计分析。计量资料以均数±标准差()表示,采用单因素方差分析(one-wayanalysis of variance,ANOVA)进行多组间数据比较。结合Student-Newman-Keuls 检验,P<0.05 表示差异具有统计学意义。
2 结果
2.1 匹诺塞林对细胞内Caspase-12 表达的影响 与对照组比较,OGD/R 组细胞内Caspase-12 表达显著增加,差异具有统计学意义(P<0.05);与OGD/R 组比较,匹诺塞林低剂量组、中剂量组、高剂量组细胞内Caspase-12 表达均降低,其中匹诺塞林中剂量组、高剂量组细胞内Caspase-12 表达均低于OGD/R 组,差异具有统计学意义(P<0.01)。见图1。
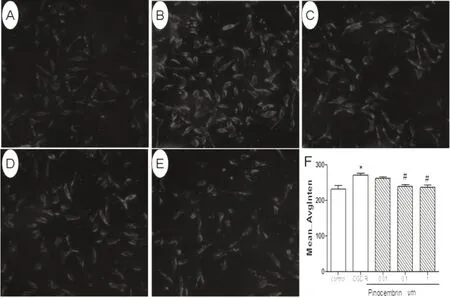
图1 匹诺塞林对OGD/R 损伤SH-SY5Y 细胞内Caspase-12 表达的影响
2.2 匹诺塞林对OGD/R 损伤SH-SY5Y 细胞内钙离子的影响与对照组比较,OGD/R 组细胞内[Ca2+]i 显著增加,差异具有统计学意义(P<0.01);与OGD/R 组比较,匹诺塞林低剂量组、中剂量组、高剂量组细胞内[Ca2+]i均下降,差异具有统计学意义(P<0.05 或0.01)。见图2。
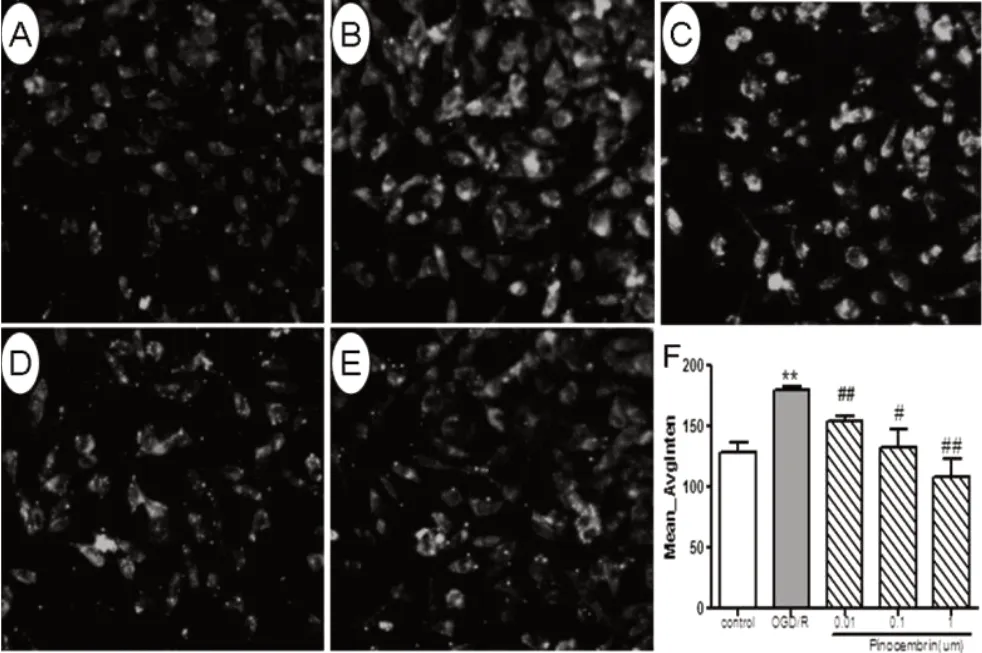
图2 匹诺塞林对OGD/R 损伤SH-SY5Y 细胞内[Ca2+]i 的影响
3 讨论
SH-SY5Y 细胞株来源于人类胚胎中脑,其细胞形态、生理生化功能与正常神经元相似[9]。通过缺糖缺氧后快速恢复氧糖供应损伤SH-SY5Y 神经细胞,可在细胞水平模拟临床脑缺血再灌注损伤,进行细胞机制和药物研究[10-12]。在本实验中,采用OGD/R 损伤的SH-SY5Y 神经细胞模型,证实匹诺塞林可以减轻OGD/R 造成的[Ca2+]i 升高及Caspase-12 表达增加。
关于匹诺塞林,已有大量资料证实其可以减轻脑缺血再灌注损伤[7]。关于脑缺血再灌注损伤的病理机制非常复杂,近些年来,脑缺血再灌注时内质网应激发生启动的细胞凋亡通路引起广泛关注[13,14]。内质网应激引起的细胞凋亡主要有三条途径:Caspase-12 的激活、CHOP/GADD153 转录激活及c-jun 氨基末端激酶(JNK)诱导凋亡[15]。本实验室已经证实,OGD/R 损伤SH-SY5Y 神经细胞,可引起内质网应激发生,细胞凋亡增加,匹诺塞林可以减少CHOP/GADD153 表达,减少细胞凋亡(该研究结果另文发表),本研究继续探讨对Caspase-12 的影响。
Caspase-12 是内质网外膜上介导细胞凋亡的一种特异性蛋白酶,其表达水平的高低直接反映内质网应激水平。通常Caspase-12 主要以无活性的前体形式存在,在内质网应激发生时活化[16],活化的Caspase-12从内质网进入到细胞浆中作用于Caspase-9,激活Caspase-3 引起细胞凋亡[17,18]。匹诺塞林能下调OGD/R损伤的SH-SY5Y 细胞Caspase-12 的表达,这可能是也是其抗凋亡,减轻脑缺血再灌注损伤的机制之一。
研究表明,细胞内Ca2+可能是主动调控细胞凋亡的重要因素,细胞内Ca2+浓度升高参与了细胞凋亡早期的信号转导和细胞凋亡的执行阶段。内质网储存细胞内80%~90%Ca2+,脑缺血再灌注时,引发细胞凋亡的多种刺激因素均可使Ca2+从内质网中释放,造成细胞内Ca2+显著增加[19],继而引起线粒体通透孔的开放,导致线粒体肿胀、线粒体内Ca2+超载,最终导致线粒体外膜破裂;同时释放的Ca2+还可以激活钙调神经磷酸酶、钙蛋白酶、死亡相关蛋白酶和其相关的线粒体分裂融合蛋白,促使细胞色素C 释放,最终导致细胞凋亡。因此细胞凋亡的线粒体相关信号途径与内质网结构功能及[Ca2+]i 密切相关[20,21]。
由上可知,内质网内Ca2+的耗竭是内质网应激诱导细胞凋亡发生的主要原因,相反,阻止内质网的Ca2+外流可以促进细胞生存[22]。还有学者认为,Caspase-12的活化也与细胞Ca2+平衡失调有关[17]。在本实验中,匹诺塞林降低细胞内[Ca2+]i,联系本实验室前期的研究结果——匹诺塞林能保护线粒体的结构和功能[23-25],推测匹诺赛林可能在脑缺血再灌注的内质网应激发生时,对维持内质网正常结构和功能有帮助,而这可能是其线粒体保护作用的上游事件。此外,匹诺塞林下调Caspase-12 表达,也可能与其降低细胞内[Ca2+]i 有关。但是,对于OGD/R 损伤SH-SY5Y 细胞后,匹诺塞林降低细胞内钙的具体机制是什么,还需要更加深入的探讨。
