基于医疗大数据的临床试验创新系统设计与实践
2021-11-11吴燕秋WUYanqiu杨云鹤YANGYunhe王天兵WANGTianbing
□ 吴燕秋 WU Yan-qiu 杨云鹤 YANG Yun-he 王天兵 WANG Tian-bing
临床试验研究按发起人区分,包括研究者(医生/科研人员)发起的临床试验(Investigator-Initiated Clinical Trial, 简称“IIT”)和医药企业发起的药物临床试验(Industry-Sponsored Clinical Trial, 简称“IST”)两种。目前医院临床试验项目的开展存在诸多困难和挑战,主要包括:(1)方案设计复杂。临床试验的复杂性日益增加,它需要有特定的患者群体参与,同时对安全性的重视度也在提升。但传统临床试验通过文献回顾获取患者的疾病及临床诊疗的片面信息,常常由于方案设计不佳而无法满足主要终点。(2)受试者招募难。传统的招募方法包括医生在治疗过程中发现病源并推荐项目研究者谈知情或院内(网站)放置招募广告等,但这些方式通常导致患者入组周期长,可控性低,且依赖大量线下团队进行管理,消耗临床人力。(3)数据收集及转换效率低。当前的临床试验数据整理依赖人工,效率低下且质控问题突出;数据结构化程度低,需要花费大量时间和人力进一步处理才可进行分析、使用。(4)研究成本高[1-2]。临床试验方案实施的复杂性、严格的质控程序和数据收集与分析困难等问题导致临床试验耗时耗力,使得研究成本不断攀升。
随着真实世界研究的兴起和发展,医疗大数据在药物临床试验中发挥了越来越重要的作用,可以为发现药物新靶点、开发新药、扩展新的药物适应症提供丰富的能源矿藏和真实证据,而人工智能技术则为新的药物临床研究和应用方法的探索提供了强大的发动机。多年来,我院的临床业务信息系统沉淀了海量临床数据,其中包括患者的临床用药数据,蕴含着大量患者用药治疗经验和创新性的疾病诊疗方法。为深化大数据在临床试验中的应用,我院积极探索基于医疗大数据的临床试验创新系统(Intelligent Clinical Trial Innovation System,简称ICTIS系统)的建设,使用大数据助力试验方案设计、项目管理、受试者管理和数据质量控制等[3],取得初步成效,现将设计和实践经验介绍如下。
设计指导原则和总体规划
1.设计指导原则。FDA于2018年发布《电子健康数据在临床试验中的应用指南》[4](Use of Electronic Health Record Data in Clinical Investigations Guidance for Industry),建议促进在临床试验数据录入系统(EDC)中采用电子健康记录(EHR)数据。FDA认为“直接从电子健康记录(EHRs)访问研究数据,在临床研究过程中可以提高数据质量、降低成本、保持完整性以及在保留稽查轨迹的同时提升效率”。相关指南的发布表明,FDA将致力于使其新药评审流程更加现代化,推进电子化技术在临床研究中的应用将会成为未来工作的重点[5-6]。
随着我国于2017年加入ICH(国际人用药品注册技术协调会),国家药品监督管理局对临床试验数据的质量重视与关注程度也逐步提升。2020年,国家药品监督管理局等部门先后出台了多个文件,见表1,规范了电子信息技术、大数据在临床试验中的应用,提出合理、有效地利用医嘱系统(HIS)、电子病历系统(EMR)等临床源数据开展药物临床试验,促进临床试验质量管理。

表1 我国发布的药物临床试验政策文件及相关内容
2.总体规划。2019年,我院将医院主要临床业务信息系统如医嘱系统(HIS)、电子病历系统(EMR)、实验室信息管理系统(LIS)、移动护理信息系统、影像归档和通讯系统(PACS)、手术麻醉信息系统、重症监护信息系统(ICU)等的数据以患者为中心整合后进行数据清洗、加工和解析,建立了全院级的科研大数据平台,可实现全院临床数据的科研查询,患者就诊、用药、手术、化验检查等病例全景视图展示及患者数据项导出等功能。截止目前,该平台共计累积了我院自2004年以来的1342万余名患者的5000万余次就诊数据。2020年,根据我院临床试验项目的实际情况和需求,我院积极探索ICTIS系统的建设,设计并确定了系统的总体规划,见图1。该系统基于我院现有的科研大数据平台搭建,包含大数据平台的科研数据查询、患者全景视图展示等功能,此外,还由临床试验项目管理、受试者管理和数据管理等三大模块组成,主要功能包括:方案可行性调研与模拟、受试者推荐与招募、访视提醒、违禁用药提醒、AE/SAE智能报警、智能数据录入和中心化监查等。
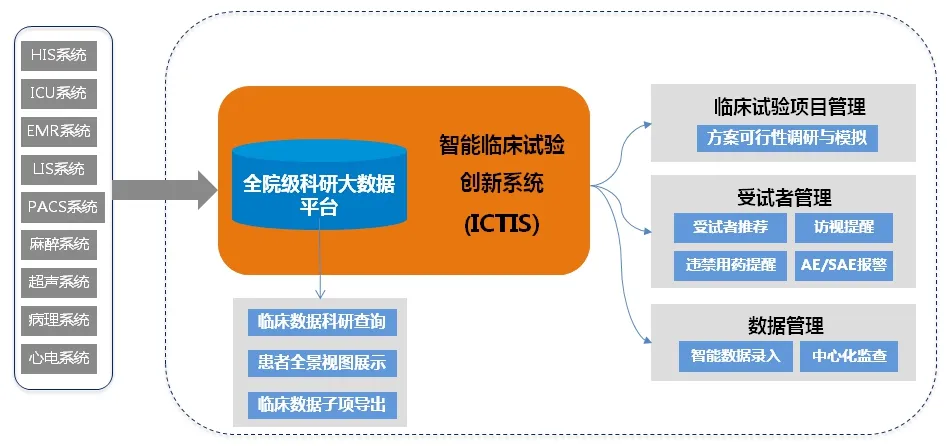
图1 基于医疗大数据的临床试验创新系统总体规划
系统模块及功能设计
经过充分调研[7-8],结合我院科研大数据平台相关功能,将ICTIS系统设计为临床试验项目管理、受试者管理、数据管理等三个模块。
1.临床试验项目管理。主要针对方案可行性的调研与模拟。根据研究方案的纳入、排除条件,研究者可在科研大数据平台中进行多条件组合检索,确定是否有足够患者符合方案;同时,可通过检索出来的院内患者人数,预测未来1-2年的潜在匹配人数,预估试验项目的进展;此外,可动态调整纳入、排除条件的参数,分析纳入、排除条件的改变对方案带来的影响,以进一步优化试验设计和纳入、排除条件。
2.受试者管理
2.1受试者智能推荐。根据研究者在科研大数据平台中的检索结果,ICTIS系统会对符合条件的患者进行智能背景分析,如职业、居住地、院内就诊频次等,并计算权重(即推荐指数);根据计算出的权重,从高到低对患者排序(指数高:配合度较高/指数低:入组后可能脱落),从而完成智能推荐,为研究者提供可能性最高的推荐名单。
受试者签署知情同意书后,ICTIS系统会根据参与临床试验的受试者的不同状态对系统内全部患者进行自动标记,对已入组和未入组且符合纳入、排除条件的患者进行身份识别,见图2,避免出现重复入组的情况;同时,将筛选失败的患者自动标记为普通患者,使其可参加其它项目的数据筛选,从而帮助研究团队进行受试者管理。
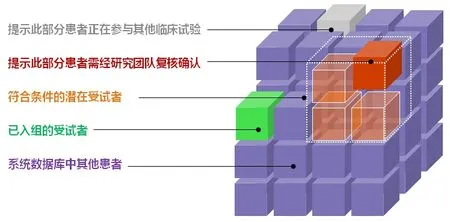
图2 系统根据不同临床试验状态对院内患者进行分组标记
2.2访视提醒。ICTIS系统会实时跟踪受试者的访视状态,并在界面中设置弹窗提醒,让研究者提前联系并提醒患者进行访视。
2.3 AE/SAE智能报警。根据《ICH国际医学用语词典(MedDRA)》和《常见不良反应事件评价标准(CTCAE)》等标准术语集,ICTIS系统对科研大数据平台中的就诊、用药、检查、化验等患者全部数据的各种潜在不良反应进行数据归一化处理。在确定受试者后,可将受试者全部历史数据导入ICTIS系统的临床试验项目库中,且会对受试者的历史诊疗数据及临床试验期间的数据进行自动、智能识别,一旦出现药物不良反应和方案违背等信号,系统就会发出实时报警;研究者还可一键溯源至受试者原始就诊数据,通过特定链接跳转至科研大数据平台的全景视图展示模块查看患者历史就诊病例详细信息,从而对ICTIS系统的智能判定结果进行二次人工判断,见图3,进一步确保受试者安全和临床试验的质量[9]。
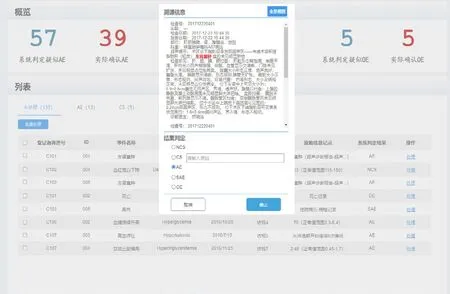
图3 AE/SAE智能判定界面
2.4违禁用药提醒。ICTIS系统对科研大数据平台中的医学术语和药物名称进行规范化、标准化编码处理,并进行自动分类和归类,再将违禁药物码和全部药物的编码进行匹配。由于ICTIS系统会实时记录受试者在临床试验过程中的用药信息,一旦发现受试者出现违禁用药时,系统就会给研究者和机构管理人员发出弹窗提醒。
3.临床试验数据管理
3.1数据智能录入。根据临床试验项目方案的CRF表,ICTIS系统会对临床试验项目库中的患者历史诊疗数据进一步完成字段映射、深度结构化和相关逻辑计算,生成面向临床试验研究的结构化数据库;同时,按照方案计划,制定数据增量规则,完成数据智能导入,实现CRF自动填充及智能质控。此外,自动填充的数据可以一键溯源至原始数据,保留完整的核查轨迹,保证研究数据的真实、准确、完整、可靠,并保证在整个研究过程中系统始终处于验证有效的状态[10]。
3.2中心化监查。ICTIS系统对患者隐私数据进行了较完善的脱敏,机构管理人员可对临床协调员/监察员(CRC/CRA)开放权限,并设置他们访问的患者范围和时间期限。CRC/CRA可通过医院VPN远程登陆ICTIS系统(部署在医院内网中),对正在实施的临床试验项目进行评估,既可降低到现场核查的频率,不耽误临床试验进度;特殊情况下(如新冠肺炎疫情期间)可减少交叉感染的风险。
初步实践及效果分析
1.真实案例应用。本文以真实案例“SHR-1210联合甲磺酸阿帕替尼治疗软组织肉瘤的II期临床研究”为例,按照试验方案的入排标准,首先在我院科研大数据平台中筛选出了符合该项目招募条件的患者共计351人,见图4,然后将351名患者的全部诊疗数据一键导入到ICTIS系统的临床试验项目库中。
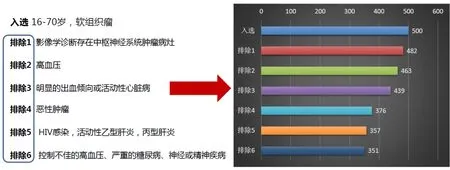
图4 真实案例中符合招募条件的受试者人数条形图
2.提升效率。根据纳入、排除条件迅速筛选出符合临床试验要求的患者,显著提升临床试验效率。此外,研究者还可在ICTIS系统中对招募的受试者人群进行宏观特征分析,也可点击查看每个患者的历次就诊病例信息,从而有助于研究团队重点招募。
3.提高质量。对临床试验项目库中的全部数据按照CRF模板进行统一清洗和结构化处理,从而直接展示在CRF界面中,不但省时省力,还可保证数据质量,避免了人工录入过程中出现的错录、漏录。此外,每个元数据都可一键溯源至原始数据,不仅减轻了数据监查的部分工作,且可从源头保证项目数据质量[11]。
讨论
本文紧跟时代要求,将我院多年来沉淀的海量医疗大数据充分整合、利用,建立了基于医疗大数据的临床试验创新系统,为临床试验各个环节赋能,有效提升临床试验效率和质量,保障受试者安全,降低研究成本,实现了我院药物临床试验全过程智能化管理,为我院开展智能创新临床试验创造了有利条件[12]。
近年来,随着临床研究逐步呈现网络化的趋势,临床研究机构也开始由单独运作走向区域整合,下一步将联合其他机构建立临床研究数据联盟,通过建立统一数据规范和数据质量标准,形成一个对等、安全、开放的临床试验数据网络联盟,以期使用更丰富的医疗大数据促进开展更高效的多中心临床试验。
