泡菜中乳酸菌的分离鉴定及抗性筛选
2021-11-10曾维友周於强
曾维友,周於强,池 浩
(1.重庆市江津区农业技术推广中心,重庆 402260;2.重庆市江津区乡村发展服务中心,重庆 402260)
乳酸菌广泛存在于人们生活中,在发酵食品中大量存在[1]。乳酸菌不仅对食品感官特性具有重要作用,还具有调节肠道菌群、增强免疫力、促进营养吸收等益生功能[2-4]。大量研究发现,发酵食品中存在的乳酸菌可以促进生物体对营养物质的吸收[5-6]、降低体内胆固醇[7],以及通过增加非特异性(细胞功能、自然杀伤细胞活性)和特异性(细胞因子产生、抗体产生、淋巴细胞增殖、迟发型超敏反应)宿主免疫应答提高机体免疫力等[8-9]。日本Yakult公司研发的干酪乳杆菌Shirota(代田株)也是世界知名的益生菌之一,应用该菌株的养乐多乳酸菌饮料每年销售100亿瓶以上[10]。丹麦科汉森公司开发的动物双歧杆菌(Bifidobacterium animalis)BB-12,该菌株畅销10多个国家,被广泛用于婴幼儿乳品[11]。因此,乳酸菌作为益生菌资源在全球都引起广泛关注,并具有重要的商业价值。
我国是发酵食品大国,乳酸菌资源丰富[3]。泡菜是以乳酸菌为优势菌群生产的一种发酵食品,因其独特的风味以及开胃健脾、降低胆固醇等作用,深受广大顾客的青睐[12-13]。目前,我国有数百家泡菜生产企业,200多个泡菜系列,800多个泡菜品种,年产值突破200亿元[14]。泡菜中乳酸菌多样性丰富,包括植物乳杆菌(Lactobacillus plantarum)、发酵乳杆菌(Lactobacillus fermentium)、干酪乳杆菌(Lactobacillus casei)、布氏乳杆菌(Lactobacillus buchneri)等,对其乳酸菌进行研究具有重要的价值[14]。但是我国对乳酸菌资源的开发起步较晚,核心菌种对国外的依赖度>90%。近年来,自主知识产权种质资源建设越来越得到相关研究人员的关注。中国光明乳业股份有限公司的植物乳杆菌ST-Ⅲ就是由江南大学陈卫院士团队从江南农家泡菜中分离,具有耐酸、耐胆盐、降胆固醇和血脂等作用,被应用于光明畅优等系列发酵乳和发酵乳饮料[15]。
为充分开发传统泡菜中乳酸菌种质资源,建立特色菌种资源库,本研究从重庆市泡菜水中分离乳酸菌,采用形态观察及分子生物学技术对分离菌株进行16S rDNA鉴定,并研究分离菌株的体外人工胃液、胆盐耐受性,从而筛选出传统泡菜中优良的乳酸菌,为保健型泡菜及益生菌产品的开发和应用提供潜在益生菌菌种资源。
1 材料与方法
1.1 材料与试剂
市售泡菜水样品:购自重庆市各地市场自然发酵样本,共11份。MRS肉汤培养基、MRS琼脂培养基、琼脂、琼脂糖、胃蛋白酶(酶活≥250 U/mg)、牛胆盐(均为生化试剂):北京索莱宝科技有限公司;盐酸、巯基乙酸钠(均为分析纯):成都市科龙化工试剂厂;核糖核酸(ribonucleic acid,RNA)酶(酶活≥60 U/mg)、2×Taq聚合酶链式反应(polymerase chain reaction,PCR)Master Mix、Ⅱ型核酸染色剂、6×脱氧核糖核酸(deoxyribonucleic acid,DNA)loadingbuffer、100bpDNA ladder(均为分析纯)、细菌基因组DNA提取试剂盒:天根生化科技(北京)有限公司;正向引物27F(5'-AGAGTTTGATCCTGGCTCA-3')、反向引物1495R(5'-CTACGGCTACCTTGTTACGA-3'):生工生物工程(上海)股份有限公司。
1.2 仪器与设备
14A04123型立式双人双面无菌操作台:苏州安泰空气技术有限公司;GHP-9080型隔水式恒温培养箱:常州中捷实验仪器有限公司;YXQ-LS-75SⅡ-01-00型立式压力蒸汽灭菌器:上海博迅生物仪器股份有限公司;minispin高速离心机:德国艾本德公司;DYS-108型生物显微镜:上海点应光学仪器有限公司;S1000型梯度PCR仪:美国Bio-Rad公司;JY-SPFT小型水平电泳槽:北京君意电泳设备有限公司;Gene Genius凝胶成像系统:英国SynGene公司;PHS-3E pH计:上海仪电科学仪器股份有限公司;SYNERGYH1酶标仪:基因有限公司。
1.3 方法
1.3.1 菌株的分离纯化
取1 mL泡菜水于装有9 mL无菌生理盐水(浓度为0.9%)的试管中,充分混匀后再吸取1 mL于装有9 mL生理盐水的试管中,依次梯度稀释至10-5。分别吸取样液100 μL涂布于MRS琼脂培养基中,于37 ℃条件下恒温培养48 h,每个梯度做两个平行。从平板上选取形态、大小、颜色不同的菌落,反复划线分离纯化后置于37 ℃的恒温培养箱中连续培养48 h,重复上述操作直到出现纯菌落为止。最后将获得的菌株进行编号、保存。
1.3.2 菌株的鉴定
形态观察:观察分离菌株的菌落形态,并按照革兰氏染色法进行染色,然后调节双目显微镜于100倍的油镜下观察其形态[12]。
分子生物学鉴定:按照细菌基因组DNA提取试剂盒中的使用说明书提取总DNA[16],以其为模板,27F和1495R为引物对菌株的16S rDNA基因序列进行PCR扩增。PCR扩增体系[12]:10 μmol/L引物27F和1495R各1 μL、2×TaqPCR Master Mix 12.5 μL、DNA模版1 μL、双蒸水(ddH2O)9.5 μL。PCR扩增参数:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共30个循环;72 ℃下再延伸5 min。PCR扩增产物采用1%琼脂糖凝胶电泳检测后,送华大科技有限公司进行测序。将测序结果提交至美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank数据中,采用局部序列比对基本检索工具(basic local alignment search tool,BLAST)程序进行同源性比对分析[13]。从GeneBank数据库中选取与所得乳酸菌16S rDNA基因序列同源性大于98%的乳酸菌以及Genome中的标准菌株作为参考的序列,然后使用MEGA5.05软件中的邻近(neighbor-joining,NJ)法构建系统发育树[17]。
1.3.3 乳酸菌人工胃液耐受性实验
总之,“情感同构”是新时期增强“概论”课教学实效性不可忽视的重要路径之一。通过师生之间、生生之间、教学对象与教学内容之间的情感同构,打破传统的教育理念和教学模式,让理论走进学生的大脑,走进学生的生活,走进学生的实践,让学生在实践中认识社会并深化对理论的认识,是增进“概论”课教学实效性的重要途径。
将配制好的0.2%的NaCl溶液和0.35%的胃蛋白酶(1∶10 000)用玻璃棒充分混匀后,用1 mol/L的HCl调整溶液的pH值为3.0,于无菌操作台里采用0.22 μm滤头过滤后备用[18]。取5 mL已活化好的菌株培养液加到已灭菌的10 mL离心管中,4 ℃条件下4 000 r/min离心10 min,收集菌体,向离心管中加入5 mL 0.9%的无菌生理盐水混匀制成菌悬液,然后取1 mL菌悬液与9 mL pH 3.0的人工胃液混合摇匀,于37 ℃、100 r/min的条件下培养3 h,并分别在0 h和3 h取10 μL样液,用MRS琼脂培养基倾注后于37 ℃条件下培养48 h。最后用平板计数法计算活菌数,并计算存活率,其计算公式如下[16]:
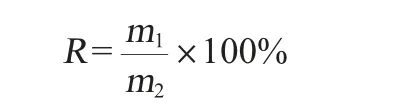
式中:R为胃液中的存活率,%;m1为3 h的活菌数,CFU/mL;m2为0 h的活菌数,CFU/mL。
1.3.4 乳酸菌胆盐耐受性实验
选取人工胃液耐受实验中存活率>60%的菌株进行胆盐耐受性实验。取100 μL活化好的菌液分别接种于含0、0.05%、0.10%、0.20%、0.30%牛胆盐的0.2%的巯基乙酸钠-MRS培养基中,于37 ℃、100 r/min条件下连续培养24 h,以未接种菌液的0.2%的巯基乙酸钠-MRS培养基为对照。分别吸取200 μL于事先做好标记的对应酶标板孔中,通过酶标仪测定OD600nm值,然后计算菌株的生长效率,其计算公式如下[19]:

式中:R为生长效率,%;m1为含胆盐培养基的OD600nm值;m2为空白培养基的OD600nm值。
1.3.5 数据处理
每个试验重复3次,用Excel 2010处理实验数据,结果以“平均值±标准差”来表示。
2 结果与分析
2.1 菌株的形态学观察
从11份泡菜水样本中共分离纯化得到71株菌,经革兰氏染色反应以及双目显微镜仔细观察后,均为阳性反应且形态较均一,因此,初步判断为革兰氏阳性细菌。其中代表菌株S39的菌落及细胞形态见图1。由图1可知,菌株S39的菌落呈圆形,表面低凸或凸起状,较为整洁光滑,呈乳白色或微黄白色;细胞形态呈杆状、长度较短,排列方式为单个、线状或簇状。

图1 菌株S39的菌落(a)及细胞(b)形态Fig.1 Colonial (a) and cell (b) morphology of strain S39
2.2 菌株的分子生物学鉴定
基于16S rDNA基因序列71株菌株的系统发育树见图2。
由图2可知,菌株S1~S4、S6、S9等32株菌株均与消化乳杆菌(Lactobacillus alimentarius)聚在同一个分支上,同源性达99%,亲缘关系最近,因此鉴定这些菌株为消化乳杆菌(Lactobacillus alimentarius)。菌株S11、S13、S25等27株菌株均与植物乳杆菌(Lactobacillus plantarum)处于同一分支上,亲缘关系最近,因此鉴定这些菌株为植物乳杆菌(Lactobacillus plantarum)。菌株S44、S29与棒状乳杆菌(Lactobacillus coryniformis)聚于同一分支,亲缘关系最近,因此,鉴定这两株菌为棒状乳杆菌(Lactobacillus coryniformis)。菌株S19、S22~S24、S27等9株菌株与有害片球菌(Pediococcus damnosus)处于同一分支上,同源性为99%,亲缘关系最近,因此,鉴定这些菌株为有害片球菌(Pediococcus damnosus)。菌株S71与发酵乳杆菌(Lactobacillus fermentium)处于同一小分支,亲缘关系最近,因此,鉴定该菌株为发酵乳杆菌(Lactobacillus fermentium)。综上,71株菌株中32株被鉴定为消化乳杆菌、27株被鉴定为植物乳杆菌、9株被鉴定为有害片球菌、2株被鉴定为棒状乳杆菌、1株被鉴定为发酵乳杆菌。在国家食品药品监督部门发布的《可用于食品的菌种名单》中,以上菌种只有植物乳杆菌与发酵乳杆菌在其中,因此,选用植物乳杆菌和发酵乳杆菌用于后续的筛选实验。
2.3 优良乳酸菌的筛选
2.3.1 乳酸菌人工胃液耐受实验结果
发酵蔬菜中的乳酸菌对人体有益,而乳酸菌发挥有益作用的前提是可以在人体胃肠道中生存并大量繁殖,而胃肠道微生物数量及种类众多,机体为了少受有害微生物的侵害,胃酸和胆盐便成为了一道天然的防御屏障,其中影响最大的即是胃液中的强酸环境,绝大多数菌群通过消化道都会失去活性,只有那些耐受性较高的乳酸菌能够抵抗这样的内环境生存下来[20]。由于人体中胃液的pH值通常在3.0左右[21],且食物在胃内停留的时间大致为1~2 h,因此模拟人体胃液实验以pH值3.0和作用时间3 h为筛选依据[15]。乳酸菌对人工胃液的耐受性见表1。
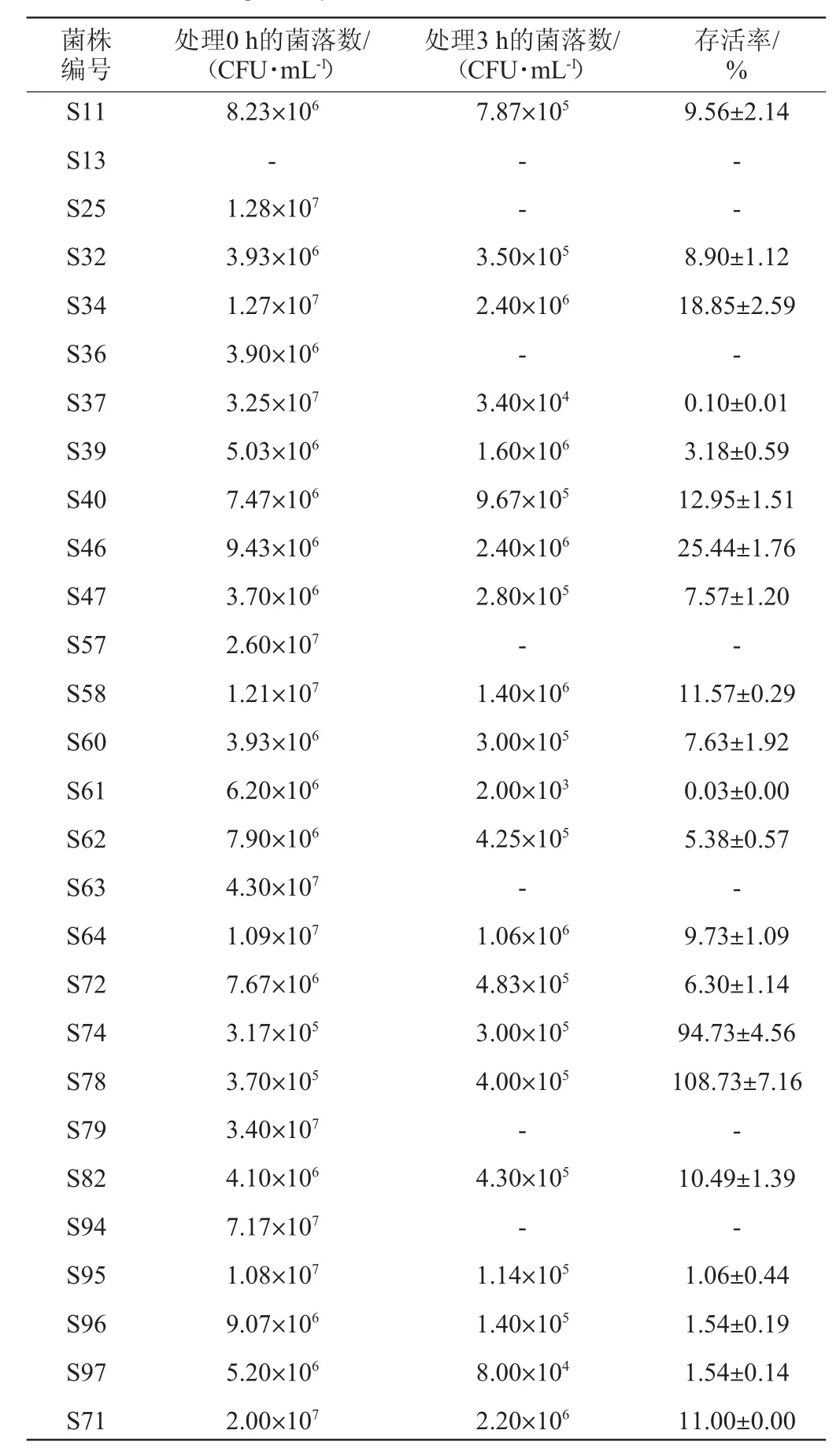
表1 乳酸菌对人工胃液耐受性的测定结果Table 1 Determination results of tolerance of lactic acid bacteria to artificial gastric juice
由表1可知,28株不同的乳酸菌中有7株不能在模拟胃液的环境下生长,其中菌株S13与人工胃液作用0 h的后不能生长,说明该株菌对人工胃液的耐受能力特别弱,基本不能在胃内环境中生长。其余21株均可生长,但耐受能力不同,存活率在0.03%~108.73%之间,说明乳酸菌抗人工胃液的能力因菌株的不同而有显著的差异。几乎所有乳酸菌在人工胃液环境中暴露3h后活菌数都有所下降,存活率>60%的仅占所有菌株的7.14%,其中菌株S74在人工胃液环境下暴露3 h后的存活率为94.73%,菌株S78的存活率高达108.73%,说明这两株乳酸菌与其他菌株相比,对人工胃液耐受性较高,更适合在人工胃液中生长。
2.3.2 乳酸菌胆盐耐受实验结果
胆盐是胆汁酸与甘氨酸或牛磺酸通过酰胺化作用形成的N-酰基酰胺化合物。当胆盐达到一定浓度后便具有抗菌能力,其主要来自于肝脏,可以通过疏水作用将细菌的细胞膜脂膜溶解,从而使细胞膜破裂并造成膜蛋白解离[16]。除此之外,在人体小肠内,胆盐形成的高渗透压条件也能够对菌体细胞构成威胁。因此微生物在肠道内发挥代谢活性的首要条件应该为具备一定的胆盐耐受性[22]。胆盐在十二指肠中的含量一般为0.03%~0.3%[21],因此本实验设计胆盐含量为0~0.3%。通过测定存活率或生长迟滞期来评价菌株的抗胆盐能力比测定生长效率的实验更繁琐耗,所以本实验采用了乳酸菌在胆盐环境中的生长效率来评价菌株的抗胆盐能力。乳酸菌对不同浓度胆盐的耐受性见表2。
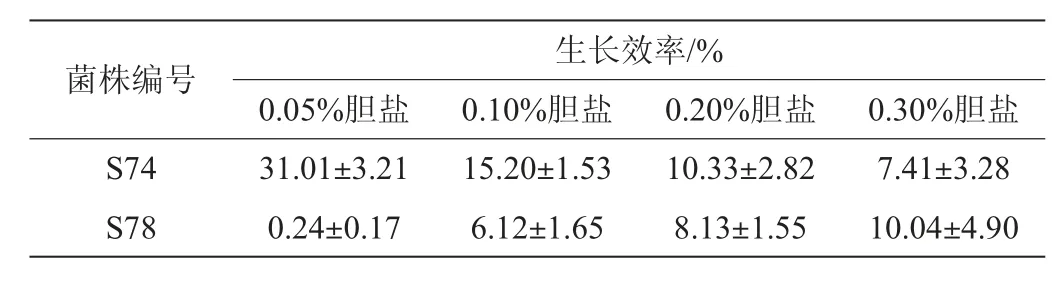
表2 乳酸菌对胆盐耐受性的测定结果Table 2 Determination results of tolerance of lactic acid bacteria to bile salt
由表2可知,植物乳杆菌S74与S78均能在含量为0~0.3%的胆盐生长,胆盐含量逐渐增加后菌株S74的生长效率随之下降,原因类似前文所述,高浓度胆盐容易改变细胞膜通透性并离解膜内蛋白质,从而使得细胞内的物质流出,导致细胞死亡[23];而菌株S78的生长效率却随着胆盐含量的增加而上升,且当胆盐含量为0.30%时生长效率可达到10.04%。冯金晓等[24]学者通过模拟胃肠道实验分析了从传统泡菜中分离的8株菌,发现其中存活率最高的菌株仅为2.0%左右;玛丽娜·库尔曼等[25]将分离自传统酵素中菌株进行体外抗胆盐实验,结果显示当胆盐含量为0.1%时,菌株已经被胁迫得不能继续生长。与以上学者的实验结果相比,菌株S78有较高的抗胆盐能力。
3 结论
本研究从重庆市市售泡菜水中共分离纯化得到71株乳酸菌,经形态观察及分子生物学鉴定,32株为消化乳杆菌、27株为植物乳杆菌、9株为有害片球菌、2株为棒状乳杆菌、1株为发酵乳杆菌。其中27株植物乳杆菌和1株发酵乳杆菌为食品可用菌株,对其进行人工胃液和胆盐耐受实验,结果表明植物乳杆菌S74与S78在pH3.0的人工胃液处理后存活率高达(94.73±4.56)%与(108.73±7.16)%,且菌株S78在胆盐中也能良好生长,生长效率为(10.04±4.90)%,优于菌株S74,因此植物乳杆菌S78在功能性泡菜及益生菌制剂方面具有一定的开发潜力。
