2016—2019年长江口海域季节性低氧对大型底栖动物群落的影响
2021-11-10贾海波柴小平
贾海波,柴小平,黄 备
(浙江省海洋生态环境监测中心,浙江 舟山 316004)
0 引言
溶解氧是海洋生物维持生命的基础,当海水中的溶解氧降到2 mg/L以下时,鱼类开始转移栖息地,一些耐氧能力较强的底栖动物行为变得异常[1-3]。低氧会造成一些物种的消失,同时有利于耐受低氧环境物种的生存,进而改变群落组成[4]。自20世纪60年代以来,世界范围内近海低氧面积呈指数增长,爆发频率和持续时间日益增长,已逐步发展为全球性的重大生态环境问题,引起了学界的高度关注[5-7]。
大型底栖动物是指能被0.05 mm网筛截留的底栖动物,大部分活动能力较弱或营固着生活,生活范围有限,与游泳和浮游生物相比,对不利环境的逃避相对迟缓,对海洋环境较敏感,受环境压力的影响深刻[8]。低氧对大型底栖动物群落的生态效应,在国外已开展了许多研究:在巴基斯坦海域的低氧区, 物种多样性显著下降, 多毛类成为该区域的优势类群, 软体动物和棘皮动物种类显著下降甚至消失, 丰度也显著降低[9];墨西哥湾北部海域低氧发生后,大型底栖动物群落的丰度和物种多样性均大幅降低,耐低氧种则丰度剧增[10]。
国内学者关于低氧对大型底栖动物群落生态效应的研究相对起步较晚。袁伟 等[11]发现,低氧使长江口大型底栖动物群落结构发生改变,低氧区内大型底栖动物物种数减少、物种多样性降低。杨陆飞 等[12]研究表明,烟台牟平海洋牧场在低氧发生后,大型底栖动物的物种组成和优势种发生改变,低氧耐受种显著增加。王延明 等[13]、王春生[14]在不同海域调查研究也得出了相似的结论。
长江冲淡水营养物质的持续输送,加上长江口外羽状锋和上升流的耦合作用、特殊的海底地形等多重因素,使得长江口外成为我国最严重的低氧海域之一。该区域低氧现象一般形成于春末夏初的浙江外侧海域,之后逐渐向北扩展移动,在秋季又逐渐向南部退缩直至消失[15]。夏季是长江口外低氧区的强盛期,研究表明其面积可达13 700 km2,溶解氧最低值达到1 mg/L[16]。
本文依据2016—2019年夏季对长江口海域4个航次的生态环境调查数据,分析了长江口海域季节性低氧对大型底栖动物群落数量及结构产生的影响,其成果可为长江口海域的生态环境质量评价与预警提供科学支持。
1 材料与方法
1.1 样品采集和处理
2016—2019年7、8月对长江口及其邻近海域进行了4个航次的调查,调查船为“浙海环监”号。共设8个站位,调查区域及站位设置见图1。采用0.1 m2静力式采泥器QNC4-1采集沉积物样品,每站成功采集2次,并用0.5 mm网筛现场分选后用5%甲醛固定,带回实验室进行种类鉴定、个体计数和湿重称量。样品保存、分类、计数及称重均按《海洋监测规范》[17]的有关规定执行。调查涉及的生态环境指标有叶绿素a(Chl-a)、底层溶解氧(DO)、活性磷酸盐(DIP)、无机氮(DIN)和化学需氧量(COD)。

图1 长江口海域调查站位分布Fig.1 Location of sampling stations in Yangtze Estuary
1.2 优势度的计算
物种优势度指数的计算公式为
Y=nifi/N
(1)
式中:ni为第i种的个体数,fi为第i种在各站位中出现的频率,N为样品中的总个体数。定义Y>0.02 的种为优势种[18]。
1.3 数据处理
由SPSS 22.0软件进行统计,应用Pearson相关系数对大型底栖动物的生物量、丰度等与环境因子之间的相关性进行双变量相关分析(Bivariate);应用方差分析检验数据差异的显著性,显著性水平为α=0.05。
使用PRIMER 5.0软件进行群落结构分析,大型底栖动物丰度数据经log(x+1)转换后计算Bray-Curtis相似性系数,构建相似性矩阵,进行多维尺度排序(Multidimensional scaling ordination, MDS)分析[19-21]。通过相似性百分比分析(SIMPER)计算主要物种对于不同程度低氧区群落结构的相似性贡献率[19-21]。
使用典范对应分析(Canonical Correspondence Analysis, CCA)对长江口海域大型底栖动物群落结构与环境因子的关系进行统计分析。CCA是一种非线性多元直接梯度分析方法,要求两个数据矩阵:一个是物种数据矩阵,本文选择出现频度大于10%的物种;一个是环境数据矩阵。物种数据矩阵和环境数据矩阵经过log(x+1)转换后,应用Canoco 4.5软件进行分析[22-24]。
2 结果与分析
2.1 调查海域夏季环境因子状况
调查海域夏季环境因子见表1。DIN均值在 0.678~1.660 mg/L之间波动,远岸的2、5、8号站位含量相对较低,近岸的3号和6号站位含量相对较高。DIP均值在0.008~0.039 mg/L之间波动,分布趋势与DIN相似。COD均值在1.84~2.74 mg/L之间波动,2、4、8号站位COD相对较低,5号站位COD相对较高;Chl-a在1.86~14.90 mg/m3之间波动,分布趋势总体与DIN、DIP相反,2、5、8号站位相对较高,3号和6号站位相对较低。环境因子的高低与陆源输入及生物活动密切相关,调查海域的近岸侧受长江径流输入影响较大,而夏季调查海域的远岸侧生物活动相对频繁。
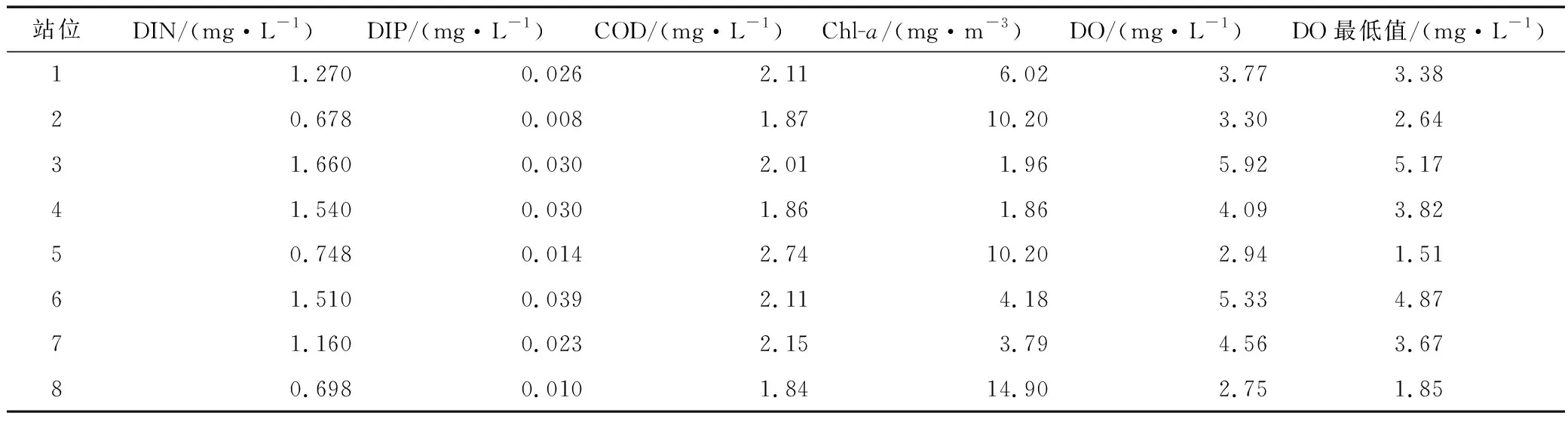
表1 长江口海域夏季环境因子均值及DO最低值Tab.1 The average content of environment factors and minimum DO in Yangtze Estuary during summer
调查海域夏季底层DO均值为2.75~5.92 mg/L,远岸的5号和8号站位均值低于 3.0 mg/L,近岸的3号和6号站位均值高于5.0 mg/L。DO最低值在1.51~5.17 mg/L之间波动,其中5号和8号站位的DO最小值低于2.0 mg/L,均出现在2017年。
关于低氧的临界阈值目前仍存在争议,本文参照TAYLOR et al[25]的划分标准,将低氧程度划分为如下3个等级:非低氧:>4.0 mg/L;中度低氧:2.0~4.0 mg/L;重度低氧:<2.0 mg/L[25]。2016—2019年夏季长江口海域底层溶解氧的分布如图2所示,其中近岸海域各年均表现为非低氧状态,该区域由于河水-冲淡水界面水体的强烈混合,表、底层溶解氧交换充分,同时长江悬浮泥沙的输入和海底沉积物的再悬浮致使水体悬浮物含量高,造成透明度小,光成为浮游植物群落增长的主要限制因子,因而尽管营养盐很丰富,但初级生产力均很低[26],死亡有机体对底层溶解氧的消耗较少。远岸海域以中度低氧状态为主,但不同年份之间有一定的波动,其中2017年调查海域东南部表现为重度低氧状态,2018年调查海域东北部表现为非低氧状态。远岸海域光的可利用率大大增加,而营养盐仍可满足浮游植物快速增长的需要,Chl-a和初级生产力均较高[26],死亡有机体对底层溶解氧的消耗较高;同时水体在夏季存在明显的层化现象,垂直稳定度大,因而表层溶解氧不能及时输送至底层。

图2 2016—2019年夏季长江口海域底层溶解氧的分布图(单位:mg/L)Fig.2 The distribution of bottom-water DO in Yangtze Estuary during summer from 2016 to 2019(Unit:mg/L)
2.2 物种组成
2016—2019年长江口海域夏季4个航次共采集到大型底栖动物53种,其中:多毛类31种,占总种类数的58.5%,为主要优势类群;软体动物8种,占15.1%;甲壳动物7种,占13.2%;棘皮动物3种,占5.7%;其它种类4种,占7.5%。调查海域大型底栖动物种类数较少,种类组成较为单一。
定理 2 如上记号,则有(V,αV,θ,δ)是(T,α,δ)的表示,且不依赖于σ的选取。进而,等价交换扩张给出相同的表示。
其中,重度低氧区采集到大型底栖动物19种,在中度低氧区为29种,在非低氧区为13种。多毛类的种类组成比例在重度低氧区为73.68%;在中度低氧区为65.52%;而在非低氧区,多毛类的种类组成比例下降为46.15%。软体动物、甲壳动物和棘皮动物的种类组成比例与多毛类相反,在非低氧区的种类组成比例大于低氧区(图3)。

图3 2016—2019年夏季长江口海域不同程度低氧区域大型底栖动物的种类组成Fig.3 The species composition of macrobenthos with different levels of hypoxic zones in Yangtze Estuary during summer from 2016 to 2019
方差分析表明,低氧区(包括中度和重度低氧)与非低氧区之间的多毛类种类比例存在显著差异(p<0.05);而软体动物、甲壳动物和棘皮动物种类比例的差异则均未达到显著水平(p>0.05)。
大型底栖动物群落优势种组成在不同低氧程度之间也存在一定的差异。重度低氧区的优势种有5种,分别为中蚓虫(Mediomastussp., 0.48)、索沙蚕(Lumbrinereissp., 0.13)、丝鳃虫(Cirratuluscirratus, 0.04)、寡节甘吻沙蚕(Glycindegurjanovae, 0.03)和彩虹明樱蛤(Moerellairidescens, 0.03)。中度低氧区的优势种有4种,分别为中蚓虫(0.24)、索沙蚕(0.08)、双形拟单指虫(Cossurelladimorpha, 0.03)和长吻吻沙蚕(Glycerachirori, 0.02)。非低氧区的优势种有3种,分别为中蚓虫(0.05)、织纹螺(Nassariussp., 0.04)和滩栖阳遂足(Amphiuravadicola, 0.02)。低氧区的优势种均为多毛类,而软体动物和棘皮动物的优势种则在非低氧区占有更高的比例。杨陆飞 等[12]研究表明,烟台牟平海洋牧场低氧区的主要优势种为短叶索沙蚕(Lumbrinereislatreilli),与本研究结果基本一致。
2.3 丰度和生物量组成
2016—2019年夏季长江口海域不同程度的低氧区之间的大型底栖动物丰度和生物量组成呈现出明显的差异。低氧区(包括中度和重度低氧)的丰度和生物量较高,而非低氧区较低。这主要是由于低氧区多毛类等机会种的丰度和生物量剧增所致,杨陆飞 等[12]、王延明 等[13],也得出相似的结论。
多毛类的丰度比例在不同低氧程度之间的变化趋势为:重度低氧区(89.42%)>中度低氧区(81.20%)>非低氧区(46.44%)(图4)。多毛类的生物量比例在中度低氧区最高,为40.91%;其次为重度低氧区(39.09%);而在非低氧区,多毛类的生物量比例仅为8.34%(图5)。

图4 2016—2019年夏季长江口海域不同程度低氧区域大型底栖动物丰度组成比较Fig.4 The abundance composition of macrobenthos with different levels of hypoxic zone in Yangtze Estuary during summer from 2016 to 2019

图5 2016—2019年夏季长江口海域不同程度低氧区域大型底栖动物生物量组成比较Fig.5 The biomass composition of macrobenthos with different levels of hypoxic zone in Yangtze Estuary during summer from 2016 to 2019
软体动物、甲壳动物和棘皮动物的丰度比例变化则与多毛类相反,其在非低氧区的丰度比例显著高于重度和中度低氧区。软体动物的生物量比例在中度低氧区最低,在非低氧区最高。甲壳动物的生物量比例在重度低氧区最低,在中度低氧区最高。棘皮动物的生物量比例在重度低氧区最高,在中度低氧区最低。
方差分析表明,低氧区与非低氧区之间的多毛类丰度比例存在显著差异(p<0.05);多毛类生物量比例差异未达到显著水平(p>0.05)。软体动物、甲壳动物和棘皮动物的丰度和生物量比例在低氧区与非低氧区之间的差异均未达到显著水平(p>0.05)。
总体来看,低氧区各类群的数量组成比例与非低氧区显著不同。在低氧区,多毛类有着更高的丰度和生物量比例。而在非低氧区,多毛类的比例大幅降低,软体动物、甲壳动物和棘皮动物的比例则明显上升。
3 低氧的生态效应
3.1 群落结构的变化
应用PRIMER 5.0软件进行多维尺度分析(MDS)表明:中度低氧区和重度低氧区大型底栖动物的物种组成差异不显著;而低氧区与非低氧区之间,大型底栖动物的物种组成差异明显(图6)。One-way ANOSIM检验表明,低氧区与非低氧区之间的差异极为显著(R=0.452,p=0.001)。
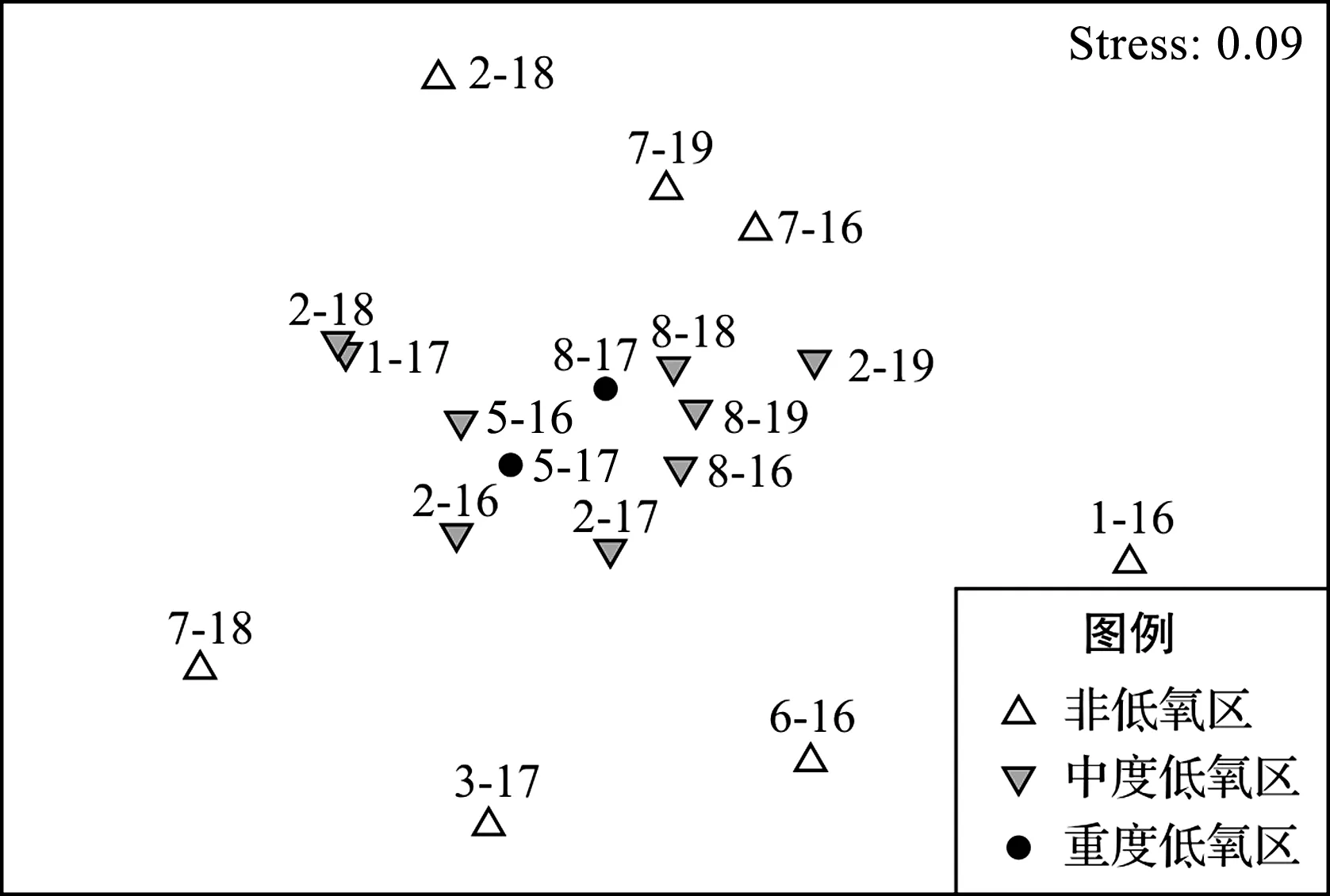
图6 2016—2019年夏季长江口海域大型底栖动物多维尺度分析Fig.6 MDS analysis of macrobenthos in Yangtze Estuary during summer from 2016 to 2019(“2-18”表示2018年的2号站位,以此类推。)(“2-18”represents for the 2# sampling station in 2018,the others are likewise.)
应用PRIMER 5.0软件进行相似性百分比(SIMPER)分析表明:重度低氧区的物种相似度最高,达32.01%;其次为中度低氧区,为30.33%;非低氧区的物种相似度最低,为4.66%。中度低氧区与重度低氧区、中度低氧区与非低氧区、重度低氧区与非低氧区的差异率分别为64.30%、89.71%和90.03%。差异率的主要贡献物种为中蚓虫和索沙蚕。
底栖动物对于低氧最早出现的反应通常是行为上或生理上的。随着缺氧的持续或严重程度的增加,底栖动物的死亡率将上升。这可能是低氧造成的直接致死,也可能是间接原因所造成,例如由于栖息深度变浅,造成底栖动物更易被捕食[27]。后续影响可能是底栖动物的物种数量、生物量和密度急剧减少,以及少量优势物种的增加[28-29]。
综上所述,低氧区与非低氧区之间大型底栖动物的种类数量、丰度、生物量和群落结构均存在显著差异。长江口海域夏季底层低氧已对大型底栖动物的群落结构产生一定程度的影响。
3.2 典范对应分析
海洋底栖生物群落受多种因素的影响, 包括温度、溶解氧(DO)、水深、盐度、沉积物特性等, 其中DO含量是影响底栖生物群落结构和组成的重要因素[30-31]。
本研究选取底层DO、DIP、DIN、COD和Chl-a几项环境因子,应用CANOCO 4.5软件对长江口海域2016—2019年夏季大型底栖动物各主要类群的丰度与环境因子数据进行了典范对应分析(CCA,图7)。

图7 2016—2019年夏季长江口海域大型底栖动物丰度与环境因子的典范对应分析Fig.7 CCA analysis of macrobenthos abundance and environmental variables in Yangtze Estuary during summer from 2016 to 2019
Chl-a代表海域的初级生产力。河口生态系统中,食物的获取是底栖动物生物量的主要限制因素[32]。DIP、DIN和COD代表水体富营养化程度。水体富营养化会显著影响底栖动物的群落结构及分布。过多的有机物质会对底栖动物造成物理性的伤害(如窒息),也会导致水体中的DO含量降低[30]。
图7中2个物种排序轴近似垂直,相关系数为 0.074 5,2个环境排序轴的相关系数为0。说明排序轴与环境因子间线性结合的程度较好地反映了物种与环境之间的关系,排序的结果是可靠的[22]。底层DO与第一排序轴呈现最大正相关,其次分别为DIN、DIP、COD和Chl-a,表明与选取的其它环境因子相比,底层DO对大型底栖动物类群的分布产生了较大的影响。甲壳动物和棘皮动物位于排序图的右侧,表明甲壳动物和棘皮动物与底层DO呈现一定正相关,对低氧的耐受能力较弱。而软体动物和多毛类位于排序图的左侧,与底层DO呈现一定的负相关,表明对底层低氧具有更强的耐受性。
通常情况下,大型底栖动物耐受低氧的能力一般为鱼类<甲壳类<棘皮动物<环节动物<双壳类动物[30]。相关研究表明, 水体低氧时, 底栖鱼类会游到近水面呼吸, 甲壳类则会向更浅的水域移动, 移居到沉积物表面或者降低挖掘深度, 多毛类动物是低氧海域的主要物种[33-34]。
本研究中,多毛类的种类组成比例、优势种组成、丰度比例和生物量比例等均呈现出低氧区>非低氧区的变化趋势,表明在低氧环境中,多毛类尤其是个体较小、生活周期短的中蚓虫、索沙蚕等更占优势。大量繁殖、生长迅速、短世代和鳃结构复杂的小个体底栖动物(多毛类)机会种通常是低氧环境的优势类群[30-31,33]。相比个体较大的物种,在低氧环境下,表体比更大、扩散作用更强的小个体类群通常更占优势[35]。
根据大型底栖动物演替的Pearson-Rosenberg模型可知,随着富营养化和低氧加重,首先甲壳动物十足目以及生活在沉积物表层、对环境敏感的棘皮动物蛇尾纲,被一些生活周期短的过渡型物种所代替,进而多毛类的一些机会种成为优势物种。最后,在极端情况下,底层海水完全缺氧,大型底栖动物几乎完全消失[36]。
4 小结
综上所述,夏季长江口海域低氧区与非低氧区之间大型底栖动物的种类数量、丰度、生物量和群落结构均存在显著差异。多毛类表现出对低氧较强的耐受能力,为低氧区的主要优势类群。甲壳动物则对低氧更加敏感。长江口海域夏季底层低氧已对大型底栖动物的群落结构产生一定程度的影响,应予以重视。
