不同相对分子质量的黑根霉胞外多糖的生物活性
2021-11-10马群飞HumaFarooqueHashmi张鹏英陈靠山
李 璋,许 晅,孟 迎,马群飞,Huma Farooque Hashmi,张鹏英,陈靠山,
山东大学1生命科学学院,2国家糖工程技术研究中心,山东 青岛266237
本实验室前期从黑根霉(Rhizopus nigricans)的发酵液中分离得到胞外多糖,对其生物活性和结构表征进行了深入研究[1,2]。黑根霉胞外多糖可以诱导HCT-116、CT26、BGC-823等多种肿瘤细胞凋亡[3],增强正常小鼠和免疫低下小鼠的免疫活性[4],抑制氧化偶氮甲烷/葡聚糖硫酸钠(AOM/DSS)诱导的小鼠结肠癌[5],抑制甲基硝基亚硝基胍(MNNG)诱导的小鼠慢性萎缩性胃炎[6]。
目前,黑根霉胞外多糖的研究集中在其药理活性,Song等[5]通过胃癌、结肠癌、肝癌等多种肿瘤模型研究了黑根霉胞外多糖的抗肿瘤活性,并对其发挥抗肿瘤活性的分子机制进行了深入研究,但是相对分子质量对黑根霉胞外多糖生物活性的影响尚无文献报道。分子结构是多糖发挥其生物活性的基础,研究不同结构的黑根霉胞外多糖对提高其生物活性至关重要。多糖的相对分子质量是影响其生物活性的重要参数,高相对分子质量多糖的分子体积较大,不利于跨膜进入生物体内发挥生物学活性[7];低相对分子质量多糖更容易结合活性位点,但无法形成复杂的空间结构[8]。因此,通过研究不同相对分子质量黑根霉胞外多糖的生物活性可以找出活性较好的相对分子质量范围,对将来进一步研究黑根霉胞外多糖的构效关系和药理活性的开发具有重大意义。
分离不同相对分子质量多糖的方法有物理法、化学法和酶解法,均存在工艺复杂、实验周期长等缺点,分级醇沉法工艺简单且实验周期较短,因此本研究采用分级醇沉法分离不同相对分子质量的多糖。多糖随着相对分子质量的增大,极性逐渐减小,结合水分子的能力减弱,利用不同浓度的乙醇改变溶液的极性,可以使不同相对分子质量的多糖组分得到沉淀[7]。本研究通过分级醇沉从黑根霉的发酵液中得到不同相对分子质量的多糖,通过测定不同相对分子质量多糖对DPPH自由基、ABTS自由基和羟自由基的清除活性来寻找具有高抗氧化活性组分对应的相对分子质量范围,测定其对MFC和A549细胞增殖的抑制活性和诱导凋亡活性来寻找具有显著抗肿瘤活性的多糖组分所对应的相对分子质量范围,检测其对RAW 264.7细胞增殖和一氧化氮释放量的影响来筛选具有显著免疫调节活性的多糖组分。本研究为黑根霉胞外多糖的药效学研究提供了理论依据,为进一步将黑根霉胞外多糖开发为抗肿瘤药物提供数据支持。
1 材料和方法
1.1 材料与试剂
黑根霉菌种保存于山东大学微生物技术国家重点实验室,MFC细胞、A549细胞和RAW 264.7细胞(中国科学院细胞库),实验用水为去离子水,三氯甲烷、正丁醇、无水乙醇(国药集团化学试剂有限公司),D301-R大孔吸附树脂(北京索莱宝科技有限公司),葡聚糖标准品(色谱纯)(Sigma-Aldrich),抗坏血酸、1,1-二苯基-2-苦肼基(DPPH自由基)、透析袋(上海源叶生物科技有限公司),胎牛血清、高糖型DMEM培养基(Gibco),ABTS自由基测试试剂盒、羟自由基测试试剂盒(南京建成生物研究所),CCK-8、一氧化氮检测试剂盒、Annexin VFITC细胞凋亡试剂盒(碧云天生物技术有限公司)。
1.2 方法
1.2.1 黑根霉的培养与发酵 黑根霉(Rhizopus
nigricans)接种于马铃薯葡萄糖琼脂(PDA)培养基中,置于28 ℃培养箱中培养24 h后,进行二次活化,继续培养24 h。挑取边缘菌丝接入装有500 mL马铃薯葡萄糖液体培养基的1000 mL锥形瓶中,在28 ℃、120 r/min的摇床中培养5 d进行发酵。摇瓶发酵后的发酵产物与马铃薯葡萄糖液体培养基以1∶20的比例装入100 L发酵罐,总体积不超过70 L,发酵时间为3 d。设定发酵温度28±1 ℃,通气量50 m3/h,搅拌转速设定为150 r/min,罐压维持0.03~0.05 Mpa。
1.2.2 黑根霉胞外多糖的制备 8层纱布过滤后收集发酵液,将发酵液置于旋转蒸发仪中减压浓缩至原体积的1/3,使用木瓜蛋白酶联合Sevage(氯仿:正丁醇=3∶1)脱蛋白,减压浓缩去除有机试剂后,上清液经D301-R大孔吸附树脂进行脱色,收集洗脱液并减压浓缩至适当体积。分次加入一定体积无水乙醇使乙醇终浓度分别为60%、70%和80%,并分别在4 ℃冰箱静置过夜,收集3种乙醇浓度下的沉淀,复溶后8000 r/min离心20 min后收集沉淀,加蒸馏水充分溶解,旋转蒸发仪浓缩至100 mL[9]。将溶液分别置于截留相对分子质量为1000 D的透析袋中在4 ℃冰箱中透析48 h,冷冻干燥3 d得到RPS-1、RPS-2和RPS-3。
1.2.3 黑根霉胞外多糖相对分子质量的测定 高效凝胶过滤色谱(HPSEC)检测多糖的相对分子质量和多分散指数。色谱条件如下:色谱柱:TSKgel G3000PWXL,以超纯水为流动相,流动相流速为0.6 mL/min,柱温控制在30 ℃,每次进样量为20 μL,检测器为示差折光检测器(RID)。以已知相对分子质量的葡聚糖标准品[重均相对分子质量(Mw)分别为1000,2500,5000,7500,10 000,50 000 D]作lgMw-RT 校正曲线:y=-0.224x+13.402,R2=0.9922。精密称取样品和标准品,样品配制成5 mg/mL溶液,12 000 r/min离心10 min,上清液用0.22μm的微孔滤膜过滤,然后将样品转置于1.8 mL进样小瓶中。
1.2.4 不同相对分子质量黑根霉胞外多糖对DPPH自由基清除能力的测定 本实验参考Zhang[10]的方法并进行改进,精密称定10 mg DPPH置于100 mL容量瓶中,用75%乙醇定容至100 mL刻度线后避光保存备用。取不同质量浓度的黑根霉胞外多糖溶液250 μL于试管中,分别加入DPPH溶液1.25 mL。振荡混匀后避光放置30 min,在515 nm波长处测定吸光值。以Vc为阳性对照,以等体积超纯水代替多糖样品溶液测定空白对照组吸光值,以等体积75%乙醇代替DPPH溶液测定样品本底吸光度值(A)。DPPH自由基清除率(%)=1-[(As-A0)/Ac]×100,As为样品组吸光值,A0为样品本底吸光值,Ac为空白对照组吸光值。
1.2.5 不同相对分子质量黑根霉胞外多糖对ABTS自由基的清除能力测定 2.45 mmol/L过硫酸钾溶液与
7 mmol/L ABTS溶液,按1∶1比例混合,室温避光静置反应16 h,无水乙醇稀释ABTS储备液使其在734 nm处的吸光值为0.7±0.05,作为ABTS工作液。取1 mL样品和6 mL ABTS工作溶液,室温条件下充分混合反应6 min[11],于734 nm 波长下测吸光度,记为As。1 mL蒸馏水代替样品溶液测得的吸光值为Ac,6 mL蒸馏水代替ABTS工作液,其吸光值记为A0。Vc作阳性对照。ABTS自由基清除率(%)=1-[(As-A0)/Ac]×100。
1.2.6 不同相对分子质量黑根霉胞外多糖对羟基自由基的清除能力测定 本实验采用南京建成生物研究所的羟基自由基检测试剂盒测定黑根霉胞外多糖对羟基自由基的清除活力,样品溶液配制同1.3.5。以等体积超纯水代替样品溶液测定空白对照组吸光值,以等体积超纯水代替工作液测定样品本底吸光值。羟基自由基清除率(%)=1-[(As-A0)/Ac]×100%,As为样品组吸光值,A0样品本底吸光值,Ac为空白对照组吸光值。
1.2.7 黑根霉胞外多糖对小鼠前胃癌MFC细胞和人非小细胞肺癌A549细胞增殖的影响 取对数生长期MFC细胞和A549细胞接种于96孔板中,每孔6000个细胞,培养24 h后加药,每组设6个复孔。加药培养48 h后,弃去原培养基,每孔加入100 μL培养基和10 μL CCK-8试剂,2 h后在450 nm波长处测定吸光值,数据以均数±标准差表示。细胞存活率=(A实验组-A空白组)/(A对照组-A空白组)×100%。
1.2.8 黑根霉胞外多糖对小鼠巨噬细胞RAW 264.7增殖的影响 取对数生长期RAW 264.7细胞接种于96孔板中,每孔3000个细胞,在二氧化碳培养箱中培养2 h,在显微镜下观察细胞贴壁后加药,每组设6个复孔。加药培养24 h后,弃去原培养基,每孔加入100 μL培养基和10 μL CCK-8试剂,2 h后测定吸光值A450nm,数据以均数±标准差表示。细胞存活率=(A实验组-A空白组)/(A对照组-A空白组)×100%。
1.2.9 黑根霉胞外多糖对小鼠巨噬细胞RAW 264.7一氧化氮释放量的影响 取对数生长期RAW 264.7细胞,5000/孔接种于96孔板中,在二氧化碳培养箱中培养2 h,在显微镜下观察细胞贴壁后加药,将细胞分为对照组、脂多糖(LPS)组(1 μg/mL)和RPS-1、RPS-2、RPS-3给药组(0.8 mg/mL),每组设6个复孔,加药后放置在5%二氧化碳培养箱中孵育24 h。根据NO检测试剂盒说明书对细胞上清液中的NO含量进行检测,另取一块96孔板,小心吸取细胞上清液50 μL置于其中,每孔依次加入Griess I试剂和GriessⅡ试剂50 μL并混匀。室温放置15 min后,在540 nm波长处测定吸光值,根据标准曲线计算NO含量[12]。
1.2.10 黑根霉胞外多糖对人非小细胞肺癌细胞A549凋亡的影响 取对数生长期A549细胞接种于6孔培养板中,24 h后吸弃培养基,其中3个孔各加2 mL完全培养基作为对照组,其余3个孔作为给药组。给药组每孔各加入2 mL 300 μg/mL的RPS-1、RPS-2和RPS-3。24 h后使用不含EDTA胰酶消化,用PBS洗涤后在给药组中加入5µL Annexin V-FITC和10µL碘化丙啶(PI)染色液[13]。将对照组细胞等分为4份,分为空白管、Annexin V-FITC单染管、PI单染管和Annexin V-FITC/PI双染管。室温避光孵育20 min,过细胞筛后立即用流式细胞仪检测,使用FlowJo软件分析早期凋亡率和晚期凋亡率。
1.2.11 统计学方法 数值资料均以均数±标准差表示,采用GraphPad Prism 7.0软件进行统计学分析。采用单因素方差分析或双因素方差分析(ANOVA)比较各组间的统计学差异。P<0.05为差异有统计学意义。
2 结果
2.1 黑根霉胞外多糖相对分子质量测定
利用高效凝胶过滤色谱(HPSEC)检测RPS-1、RPS-2和RPS-3的相对分子质量和相对分子质量分布(图1),RPS-1、RPS-2 和RPS-3 的保留时间分别为8.750、8.762 和8.437 min,重均相对分子质量分别为43693、85471和14197 Da。RPS-2 在10.90 min 处存在杂峰,15.25 min处为溶剂峰。由峰面积大小可知,RPS-2含量相对较低。RPS-1、RPS-2和RPS-3的多分散指数分别为1.30、1.34和1.29。

图1 不同相对分子质量黑根霉胞外多糖HPSEC色谱图Fig.1 High pressure size exclusion chromatography of polysaccharides with different molecular masses from Rhizopus nigricans.
2.2 不同相对分子质量黑根霉胞外多糖对DPPH自由基的清除能力
黑根霉胞外多糖对DPPH自由基具有一定的清除活性。RPS-1、RPS-2和RPS-3在4.0 mg/mL时对DPPH自由基清除率分别为48.36%、29.55%和24.24%,并且在实验浓度范围内DPPH自由基清除率呈现一定的剂量依赖性。在给药浓度为1.0~4.0 mg/mL时,RPS-1对DPPH自由基的清除活性显著高于RPS-2和RPS-3(P<0.05)(图2A)。
2.3 不同相对分子质量黑根霉胞外多糖对ABTS自由基的清除能力
3种不同相对分子质量多糖具有较好的ABTS自由基清除活性,当给药浓度为0.125~1.0 mg/mL时,RPS-3对ABTS自由基的清除活性显著高于RPS-1和RPS-2(P<0.05),当给药浓度为2.0 mg/mL和4.0 mg/mL时,RPS-1对ABTS自由基的清除活性显著高于RPS-2和RPS-3(P<0.05)。RPS-1、RPS-2和RPS-3在4.0 mg/ml时对DPPH 自由基清除率分别为67.14%、54.70%和62.48%(图2B)。
2.4 不同相对分子质量黑根霉胞外多糖对羟基自由基的清除能力
RPS-1、RPS-2和RPS-3具有较好的羟自由基清除能力。在实验浓度范围内,RPS-3对羟自由基的清除活性显著高于RPS-1和RPS-2(P<0.01),且RPS-1和RPS-3对羟基自由基清除率呈现一定的剂量依赖性。RPS-1、RPS-2和RPS-3在4.0 mg/mL时对羟基自由基的清除率为89.94%、24.99%和97.26%。当给药浓度高于1.0 mg/mL时,RPS-3对羟基自由基的清除能力高于阳性对照Vc(图2C)。

图2 不同相对分子质量黑根霉胞外多糖和维生素C 对DPPH、ABTS和羟自由基清除率Fig.2 Comparison of DPPH,ABTS,and hydroxyl radical scavenging capacity between polysaccharides with different molecular masses and vitamin C.A:DPPH radical scavenging capacity assay.B:ABTS radical scavenging capacity assay.C:Hydroxyl radical scavenging capacity assay.*P<0.05,**P<0.01.Data are presented as Mean±SD of three independent experiments.
2.5 不同相对分子质量黑根霉胞外多糖对肿瘤细胞增殖的影响
RPS-1、RPS-2和RPS-3在实验浓度范围内均能抑制小鼠前胃癌MFC细胞和人肺癌A549细胞增殖(图3)。在1.0 mg/mL时,RPS-1、RPS-2和RPS-3对MFC细胞增殖的抑制率分别为12.68%、32.22%和14.4%,对A549 细胞增殖的抑制率分别为20.35%、37.07%和15.75%,且RPS-2对MFC和A549细胞增殖的抑制率高于RPS-1和RPS-3(P>0.05)。
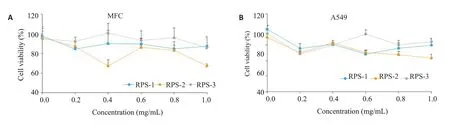
图3 不同相对分子质量黑根霉胞外多糖对MFC和A549细胞增殖的影响Fig.3 Effects of polysaccharides with different molecular masses on proliferation of MFC(A)and A549 cells(B).
2.6 不同相对分子质量黑根霉胞外多糖对巨噬细胞RAW 264.7增殖和一氧化氮含量的影响
3种不同相对分子质量的黑根霉胞外多糖均能促进小鼠巨噬细胞RAW 264.7 细胞增殖。当RPS-1、RPS-2和RPS-3为1.0 mg/mL时,RAW 264.7细胞的存活率分别为187.0%、199.6%和150.0%(图4A)。其中RPS-2促进RAW 264.7细胞增殖的活性显著高于RPS-1和RPS-3(P<0.05)。一氧化氮(NO)是一种重要的细胞内信号分子,巨噬细胞可以通过释放NO来发挥其对肿瘤细胞的细胞毒作用。实验结果表明,RPS-2处理后的RAW 264.7细胞释放的NO含量显著高于RPS-1和RPS-3(P<0.01)(图4B)。

图4 不同相对分子质量黑根霉胞外多糖对RAW 264.7细胞增殖和NO含量的影响Fig.4 Effects of the 3 polysaccharides on proliferation(A)and NO production(B)of RAW 264.7 cells.*P<0.05 vs control group,**P<0.01 vs control group,##P<0.01.
2.7 不同相对分子质量黑根霉胞外多糖诱导肺癌A549细胞凋亡
不同相对分子质量黑根霉胞外多糖均可以显著诱导A549肺癌细胞凋亡(P<0.01,5A),在RPS-1、RPS-2和RPS-3的浓度为0.4 mg/mL时,RPS-2处理后A549细胞的凋亡率显著高于RPS-1 和RPS-3(P<0.05,图5B)。

图5 不同相对分子质量黑根霉胞外多糖对A549细胞凋亡的影响Fig.5 Flow cytometric analysis of apoptosis rates of A549 cells treated with RPS-1,RPS-2 and RPS-3 (0.4 mg/mL).Data are presented as Mean±SD of 3 independent experiments.*P<0.05 vs control group,**P<0.01 vs control group,#P<0.05 and##P<0.01.
3 讨论
黑根霉胞外多糖的产量为196 mg/L,主要由葡萄糖、半乳糖、甘露糖和果糖组成,其摩尔比例为5.89∶3.64∶3.2∶1。黑根霉胞外多糖主要的糖苷键连接方式是→6)Glcp(1→,为吡喃型糖,既含有α型糖苷又含有β型糖苷[2]。黑根霉胞外多糖具有较好的抗肿瘤活性,可以诱导多种肿瘤细胞凋亡和自噬[14],增强正常小鼠和免疫低下小鼠的免疫功能,抑制小鼠胃癌、结肠癌的发生和发展,抑制小鼠肝癌的发展和肺转移[15]。
体内产生的过量氧自由基可以诱导DNA损伤,导致细胞膜降解,从而引起细胞的破坏和机体的损伤,是癌症、心血管疾病、糖尿病及风湿性关节炎等多种疾病的共同诱因,抗氧化剂可以用于上述疾病的预防和辅助治疗[16-17]。天然多糖具有较好的抗氧化活性,由于相对分子质量可以影响多糖的抗氧化活性,因此研究不同相对分子质量多糖的抗氧化活性对提高多糖抗氧化性能具有重要意义。本文研究了3种不同相对分子质量黑根霉胞外多糖的抗氧化活性,研究结果表明中等相对分子质量多糖RPS-1对DPPH和ABTS自由基的清除活性显著高于高相对分子质量多糖RPS-2(P<0.05),低相对分子质量多糖RPS-3对羟自由基的清除活性显著高于RPS-1和RPS-2(P<0.01),表明低、中相对分子质量多糖的抗氧化活性高于高相对分子质量多糖。Chen等[18]研究发现中等相对分子质量玉米须多糖对DPPH和羟自由基的清除活性和还原力高于高相对分子质量多糖;LI Wang等[19]研究表明低相对分子质量平菇多糖对羟自由基和超氧阴离子自由基的清除活性高于高相对分子质量多糖,均与本文的研究结果一致。黑根霉胞外多糖的相对分子质量较高,含有大量具有还原性的半缩醛羟基,可以提供活泼氢与·OH结合生成水,从而降低·OH对机体的损伤;多糖的碳原子因此成为碳自由基,并进一步氧化形成过氧自由基,最后分解成对机体无害的产物[20]。
诱导肿瘤细胞凋亡和免疫调节是多糖发挥抗肿瘤活性的重要途径,Chen等[21-22]研究发现玉竹多糖能够可以诱导人食管鳞状细胞癌(ESCC)细胞凋亡并且激活巨噬细胞。研究表明,多糖可以通过与肿瘤细胞的细胞膜上死亡受体结合,经过一系列信号转导将凋亡信号传递到细胞内,从而诱导肿瘤细胞凋亡[23-24]。同时,多糖可以与巨噬细胞表面的Toll样受体、甘露糖受体、补体受体3、清道夫受体等模式识别受体结合,从而引发细胞内信号级联反应来调节巨噬细胞的免疫功能[25-26]。多糖与其受体的结合依赖于多糖复杂的高级结构,而相对分子质量是影响多糖空间构象的重要因素,研究不同相对分子质量多糖的抗肿瘤活性和免疫活性具有重要意义[27]。本文研究了三种不同相对分子质量黑根霉胞外多糖对肿瘤细胞增殖、凋亡的影响和对巨噬细胞免疫活性的影响,发现高相对分子质量多糖RPS-2对MFC和A549细胞增殖的抑制活性高于RPS-1和RPS-3(P>0.05);RPS-2处理A549细胞24 h后,早期、晚期凋亡细胞的比例显著高于RPS-1和RPS-3(P<0.05)。RPS-2处理RAW 264.7细胞24 h后,细胞存活率和NO释放量均显著高于低、中相对分子质量多糖RPS-1和RPS-3(P<0.05)。李苹等[28]研究发现相对分子质量高于100 000的醋柴胡多糖对巨噬细胞的吞噬活性显著高于低相对分子质量醋柴胡多糖(3.5~50 000和50~100 000)(P<0.05),Kim等[29]研究发现相对分子质量在10 000~30 000的桦褐孔多糖对人结肠癌HT-29细胞增殖的抑制活性和诱导凋亡活性高于低相对分子质量桦褐孔多糖,均与本文的研究结果一致。高相对分子质量多糖具有较好的抗肿瘤活性和免疫调节活性可能是由于其复杂的空间构象,易与巨噬细胞和肿瘤细胞表面多种受体结合进而发挥生物活性。
综上所述,黑根霉胞外多糖的抗肿瘤活性和免疫调节活性与自身相对分子质量密切相关,低和中相对分子质量多糖具有较好抗氧化活性,高相对分子质量多糖具有较好的抗肿瘤活性和免疫调节活性。本文为将来进一步研究黑根霉胞外多糖的构效关系提供了数据支持,具体机制有待进一步研究。
