高三化学复习中关于复杂体系内反应的竞争与协同关系探讨
2021-11-10北京赵志远
北京 赵志远 王 哲
《普通高中化学课程标准(2017年版2020年修订)》(以下简称《课程标准》)倡导,以发展化学学科核心素养为主旨,重视开展“素养为本”的教学。核心素养培养需要让学生在真实情境中完成较复杂任务的过程时,提升解决问题的能力,训练“分析、评价、综合与创造”等高阶思维。思维有规则,有过程,追求思维品质提升,需要适切的素材,有导向性的问题,引导学生规范地经历逻辑思维的基本过程。为此教师需要筛选结构化的学习内容作为载体,通过目标和内容一体化的系列核心活动来实施,锻炼学生思维。聚焦问题,关注情境,讲究方法,思维才能真正形成。
化学知识规律性强,内容丰富,化学教育应帮助学生在基础知识的上层,从哲学层面,由上而下地理解和运用化学规律,搭建学习框架。生态圈中,有“物竞天择”,也有“互利共生”。同样,在分子、原子和离子构成的微观世界里,微粒间往往也存在竞争与协同机制。因此可以从这一视角,帮助学生构建分析复杂体系的思维模式。
一、复杂体系的分析思路
复杂体系指体系中具有多种可反应的微粒,并且微粒间具有多种反应的可能性,而且这些反应之间常常存在相互作用,比如“竞争”或“协同”。近几年的高考真题也日趋重视对从竞争与协同视角解释和预测复杂体系中的化学反应的考查。这类综合题旨在考查学生根据化学反应原理,运用已知信息,分析陌生情境的关键能力。那么考生应如何准确分析、判断物质或反应之间的关系?如何验证和理解反应发生的情况呢?
近年来,经过不断地思考与实践,笔者探索出分析复杂问题的一般思路与方法,形成如图1所示复杂体系分析的思维模型。
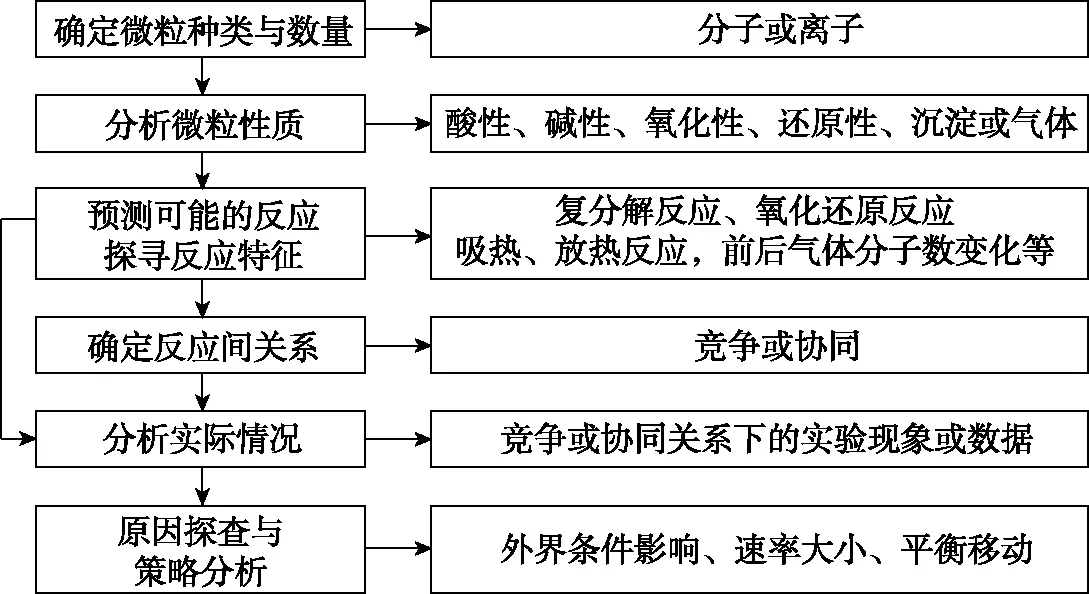
图1 复杂体系分析的思维模型
分析复杂体系的一般思路:明确微粒的种类和数量→分析各种微粒的性质(稳定性、氧化性、还原性或酸碱性、能否产生沉淀或生成配合物),预测可能发生的反应→分析反应特点(焓变,反应前后气体分子数变化),明确化学反应间的关系(竞争或协同)→依据证据(实验现象或数据、图像)判断实际反应情况→依据策略(平衡态根据勒夏特列原理分析,非平衡态根据速率变化分析)得出相关结论。整个过程需要学生将物质的性质与反应原理结合,从宏观和微观的视角分析反应体系。
二、复杂体系中化学反应的案例分析
(一)竞争关系
复杂化学反应体系有很多种,综合题目中常见的体系主要有三类:气相化学体系、水溶液体系和电化学体系。在教学过程中,我们可以对这些不同的体系,可以采用相同的分析思路,引领学生一步步构建自己的思维模型。下面我们借助不同环境体系的案例对微粒或反应间的竞争关系进行讨论。
1.气相化学体系
气相化学反应在工业生产和环境保护方面有重要作用。气相化学体系较为复杂,除了预期的主反应外,常伴随一些副反应,副反应或与主反应竞争原料,或消耗主产物,而主副反应的发生受外界条件的影响程度不同。因此,我们需要分析外界条件改变时主副反应变化的差异,调控反应体系,找到合适的反应条件,提高原料的转化率和主产物的选择性。
【案例1】CO2的资源化利用
目的:CO2加氢合成二甲醚
存在反应:


恒压时,CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图2所示。
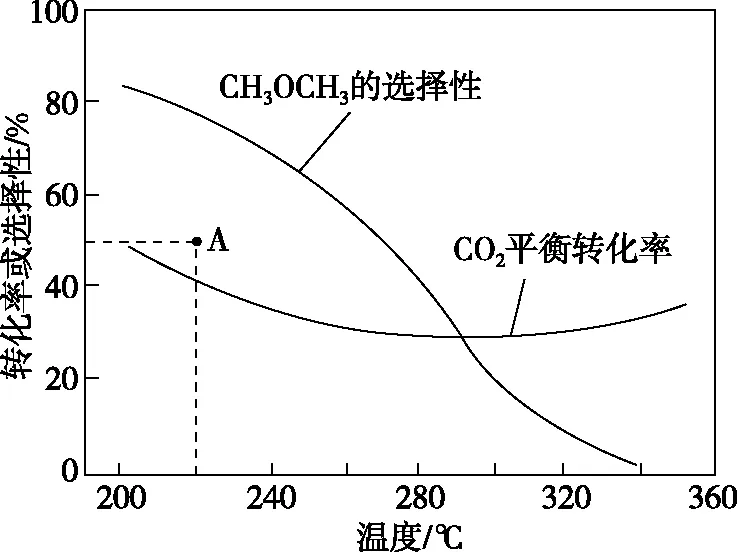
图2
220℃时,在催化剂作用下CO2与H2反应一段时间后测得CH3OCH3的选择性为48%(图2中A点),试提出提高CH3OCH3选择性的措施。
本例中,由于已经给出了存在的化学反应,所以前两步“微粒的种类、数量”和“性质”分析可以忽略,详细的分析过程如图3所示。教师带领学生分析本例的过程中,有三个关键点:(一)判断主副反应,确定二者的竞争关系,分析二者差异;(二)判断出主反应未达到平衡状态,证据为A点选择性未达到该温度下平衡状态的选择性;(三)非平衡态下,从速率变化角度出发,寻找相应提高主反应选择性的措施,例如加压、换用有利于主反应的催化剂、延长反应时间等。除此之外,教师还可引导学生分析,假如体系处于平衡状态,应如何提高二甲醚的选择性。

图3 气相体系“二氧化碳资源化利用”的分析思路
2.水溶液体系
水是最常见的分散剂,广泛用于生产、生活中。水溶液体系的复杂之处在于,除了溶质微粒间的反应,还有各微粒与水分子的反应。水溶液体系的竞争关系常见的有复分解反应中的离子间竞争、氧化还原反应中得失电子的竞争以及复分解与氧化还原反应的竞争(如表1所示)。这些具有竞争关系的反应体系,最终结果均取决于不同反应进行的趋势(ΔG和K)与速率(v)。对于原理和性质类探究性问题,学生可以通过对反应微粒和实验现象的分析,确认发生的反应,并解释其原因。对于物质制备类问题则要求在前者基础上找出最佳制备方案。

表1 水溶液体系的竞争反应



图4 水溶液体系“SO2与Ag+反应”的分析思路
3.电化学体系
原电池或电解池工作时,电极上,氧化性不同的微粒竞争得电子,还原性不同的微粒竞争失电子。竞争结果本质上取决于微粒的氧化性或还原性强弱,并受微粒浓度和溶液pH的影响。由于电化学装置独特,发生化学反应的位置固定,这种竞争也会受到电压、电极材料和离子扩散速率等外界因素的影响,从而可能增加电化学中竞争关系的复杂程度。

电化学体系可以将分析思路进行如图5所示的一定的简化,在微粒性质部分,只需要找出具有氧化性或还原性的微粒即可。电流一定时,单位时间内的电路中通过的电量一定,如果有其他微粒竞争放电,那主要物质的反应量减小。这种竞争既包括放电速率的竞争,也包括放电能力的竞争,二者都会受浓度影响。

图5 电化学体系“LiCoO2与H+放电竞争”的分析思路
以上是化学反应之间竞争关系的几种常见体系和分析方法,分析思路基本相同,也各有特色。这类题目最重要的分析要点有两个,第一是确认化学反应以及反应之间的关系,第二是找准答题角度,判断体系是否处于平衡态,再从平衡移动或速率变化角度分析,剥离到具体影响因素。
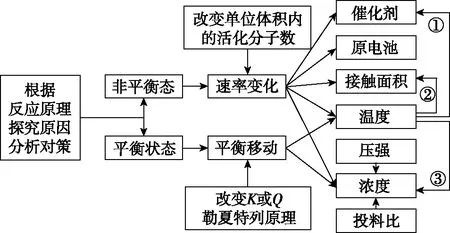
注:①温度变化可以影响催化剂活性
(二)协同关系
化学反应之间除了竞争,也会互相促进,包括耦合作用、连续反应、辅助催化等。在教学中,总结这一类的反应的关联和协同,帮助学生们分析这些有趣的关联,引导学生尝试运用这些协同关系分析问题,体会化学在人类生产生活中的重要作用。
1.耦合作用型
反应体系存在两个及以上反应,设这两个反应为Ⅰ和Ⅱ,其中反应Ⅰ至少有一个产物是反应Ⅱ的反应物,若反应Ⅰ单独存在时不能自发进行,而Ⅱ可以自发进行,从而带动Ⅰ发生,则这种关系叫做耦合作用,反应Ⅱ即耦合反应。在一定温度下某个热力学不可行的反应,通过耦合叠加另一个化学反应,使原反应ΔG<0。借助下列表达式表示耦合作用的相关反应。




再如,2020年北京学业质量等级测试17题,回收旧CPU中的贵金属时,浓硝酸不能将Au溶解,但加入NaCl后,用Cl-配位的辅助作用即可溶解Au。工业上的氰化提金法也与此类似。


为了使CuS沉淀变成可溶性的Cu2+,因为Ksp(CuS)=10-36太小,只加强酸几乎无法实现,但可利用-2价S的还原性,加浓硝酸将S元素氧化,从而将Cu2+拖拽到水溶液中。
这些都是利用四种平衡协同作用的典型案例。另外离子之间的双水解、含氧酸根的氧化性随pH减小而增强等现象,也可以用耦合作用解释。借助耦合反应中的协同作用,我们可以完成某些难以实现的反应。
2.连续反应型
有时一个反应本身效率不高,需要其他物质来进行辅助。
【案例4】表2是相同时间内分别电解三份500 mL相同浓度的K2Cr2O7溶液的实验结果。由于重铬酸根离子带负电荷,不易扩散至阴极,所以直接电解时还原效率并不高,铁元素的参与可有效提升还原效率。
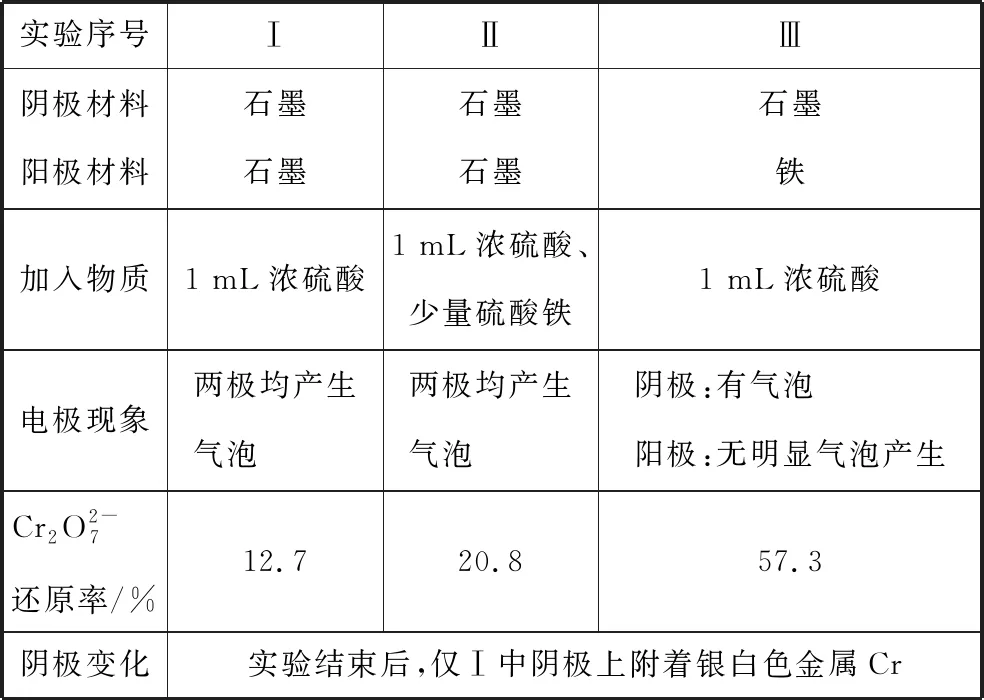
表2 电解三份同浓度K2Cr2O7溶液的实验结果
实验Ⅲ中铁在阳极失电子,Fe3+在阴极得电子,阴阳极产物均为Fe2+可以促进重铬酸根离子的还原。这相当于在用电解的方式氧化Fe和还原Fe3+,而重铬酸根离子的还原恰好利用了其电解产物Fe2+。铁元素的价态变化促进了重铬酸根离子的还原,同样是一种协同作战的策略。
3.辅助催化型
有些物质本身不能够起到催化作用,但可以辅助催化剂工作,这里定义为“辅助催化”型。
【案例5】I-对水溶液中SO2歧化反应的催化作用:


在这个体系中,I-是SO2歧化反应的催化剂,H+单独存在时不具有催化作用,但H+参与了催化反应的反应①,因此氢离子浓度增大可以加快I-催化歧化反应的速率。
包含竞争与协同关系的案例虽然形式上各不相同,但核心都涉及化学反应原理。如果把它们精心打磨,串在一起,就会凸显出形形色色的化学反应体系背后的核心规律。
三、总结与反思
教学过程中,教师可以利用典型案例,带领学生讨论和预判其中可能发生的化学反应,通过实验现象分析实际发生的反应及反应发生的原因,或者分析反应步骤和条件的甄选角度,再辅以专题训练,从而使学生建立起从反应之间竞争和协同关系方面看待复杂反应体系的思维视角,并加深对反应原理思维模型的认识层次,体会科学中“透过现象看本质”的美妙感觉。
当教师给化学知识赋予了思想性和故事性,那么学生在体验化学魅力的同时,也能多一份“微观粒子的微生”体验。

