基于证据推理与模型认知素养下的化学探究性学习
——以“新情境下的化学方程式书写”为例
2021-11-10云南李海春
云南 李海春
证据推理与模型认知是化学学科的五大核心素养之一,亦是重要的化学学科思维方法。所谓模型认知是指“知道可以通过分析、推理等方法认识研究对象的本质特征、构成要素及其相互关系,建立认知模型,并能运用模型解释化学现象,揭示现象的本质和规律”。其关键是分析实际问题,抓住其本质,联想已有的知识,建立表达式,并应用其性质找到解决问题的途径。新情境下的化学反应方程式考查学生接受、吸收、整合化学信息的能力以及根据新信息结合已有知识分析问题和解决问题的应变能力。培养能力,重在培养学生分析和解决化学问题的能力。
高考试题中涉及新情境下化学(离子)方程式类试题,出现的频率高,分值多。该类试题所给予的信息是教材中没有的知识,特点是信息新颖,新旧相承,需要加强对元素化合物性质的理解与掌握,使学生能够快速、准确地获取实质性内容及相关信息,并与已知化学方程式知识整合,在分析解答的基础上提高学生应用新信息的能力,激发其思维的广度和深度,全面提升学科核心素养。
一、高考试题中新情境下的化学(离子)反应方程式书写步骤
步骤一:根据化合价确定反应是否为氧化还原反应;
步骤二:若不是氧化还原反应,根据复分解反应的规律判断产物;若为氧化还原反应,分析出氧化剂、还原剂、氧化产物、还原产物,根据得失电子守恒配平原子个数;
步骤三:根据电荷守恒和质量守恒配平化学计量数;
1.书写非氧化还原反应类化学方程式的模型

【例1】(2021·全国乙卷·26节选)磁选后的炼铁高钛炉渣,主要成分有TiO2、SiO2、Al2O3、MgO、CaO以及少量的Fe2O3。为节约和充分利用资源,通过图1工艺流程回收钛、铝、镁等。

图1
回答下列问题:
(1)“焙烧”中,TiO2、SiO2几乎不发生反应,Al2O3、MgO、CaO、Fe2O3转化为相应的硫酸盐,写出Al2O3转化为NH4Al(SO4)2的化学方程式_______________。
(5)“酸溶”后,将溶液适当稀释并加热,TiO2+水解析出TiO2·xH2O沉淀,该反应的离子方程式是_________________。



2.书写氧化还原反应类化学方程式的模型
(1)书写步骤
第一步:依据信息,找到参与氧化还原的物质,构建“氧化剂+还原剂→氧化产物+还原产物”模型。
第二步:运用得失电子守恒快速配平有元素化合价发生变化的物质前的化学计量数。
第三步:利用质量守恒定律并结合介质的酸碱性,碱性条件下,补充OH-,不能出现H+(或能与OH-反应的微粒);同样酸性条件下,补充H+,不能出现OH-(或能与H+反应的微粒)。

(2)书写原则
①电子守恒的原则。氧化还原反应中,氧化剂得电子的数目等于还原剂失电子的数目。
②电荷守恒的原则。离子反应中,阳离子所带的正电荷总数等于阴离子所带的负电荷总数。
③原子守恒的原则。反应前后,原子的种类和个数保持不变。
④共存性原则。生成物中,能发生复分解反应、氧化还原反应、络合反应、强烈双水解的物质要继续发生反应,直至生成物遵循共存的原则。
【例2】(2021·全国甲卷·26节选)碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1)I2的一种制备方法如图2所示:
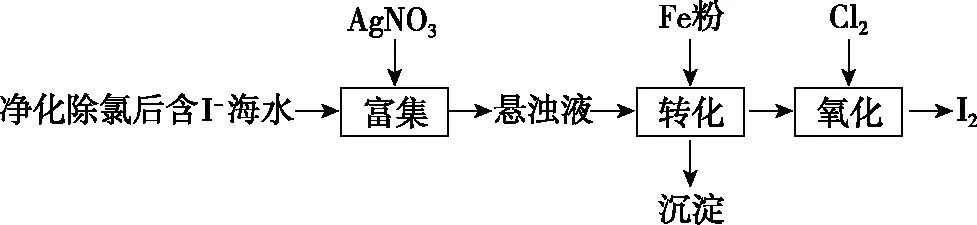
图2
①加入Fe粉进行转化反应的离子方程式为_______________________________,生成的沉淀与硝酸反应,生成________后可循环使用。
②通入Cl2的过程中,若氧化产物只有一种,反应的化学方程式为______________________________;若反应物用量比n(Cl2)/n(FeI2)=1.5时,氧化产物为________;当n(Cl2)/n(FeI2)>1.5,单质碘的收率会降低,原因是_______________________________。
(2)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2,上述制备I2的总反应的离子方程式为____________________。





【例3】(2020·全国卷Ⅰ·26节选)钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4。采用图3所示工艺流程可由黏土钒矿制备NH4VO3。
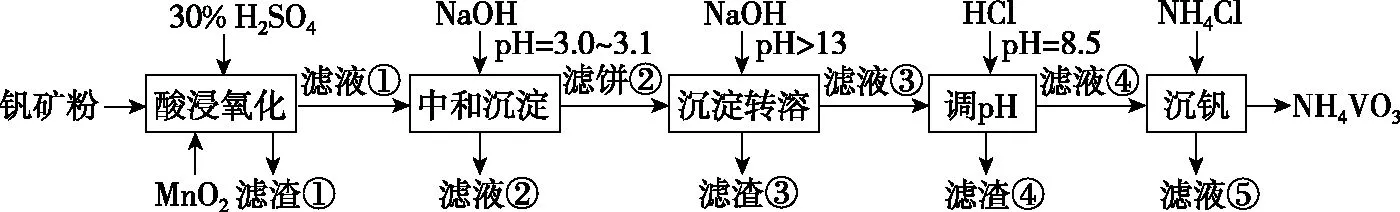
图3
回答下列问题:

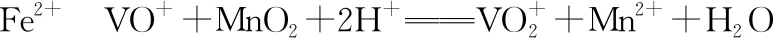
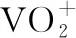
3.书写电极反应式类的模型
(1)电极反应式的建模:
负(阴)极:还原剂失电子→发生氧化反应(一般通式:M-ne-→Mn+)
正(阳)极:氧化剂得电子→发生还原反应(一般通式:N+me-→Nm-)
(2)书写规则:
①三大守恒规律:电荷守恒、电子守恒、质量守恒
②正负极得失电子相等(负失正得)
③两式相加后电子必须抵消
(3)书写注意点:
①电极反应是一种离子反应,遵循书写离子反应式的一切规则(如拆、平、守恒等)。

③氧气(氧原子得电子生成O2-)溶液中不存在O2-,在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中它与H2O结合成OH-。
④两极反应相加得到总反应,总反应减去负极反应得到正极反应、总反应减去正极反应得到负极反应。
⑤若正负极的产物会同所处的电解质溶液反应的话,则必须考虑产物同电解质溶液的反应。即电极反应的产物必须能稳定地存在与电解质溶液中。
【例4】(2021·浙江6月选考·22)某全固态薄膜锂离子电池截面结构如图4所示,电极A为非晶硅薄膜,充电时Li+得电子成为Li嵌入该薄膜材料中;电极B为LiCoO2薄膜;集流体起导电作用。下列说法不正确的是

图4
( )
A.充电时,集流体A与外接电源的负极相连
B.放电时,外电路通过amol电子时,LiPON薄膜电解质损失amol Li+

【答案】B


