Ag-PA/PVDF复合膜制备及其催化性能
2021-11-10马永迪翟笑影史圆圆
陈 熙,马永迪,翟笑影,史 鑫,王 帅,史圆圆
(1.天津工业大学 材料科学与工程学院,天津 300387;2.天津工业大学 省部共建分离膜与膜过程国家重点实验室,天津 300387)
造纸、纺织、农药和制药等工业废水中含有硝基芳香族等有毒物质,对人类和水生生物的健康造成了严重的威胁[1-2]。其中,4-硝基苯酚能溶于水,而且在水中极其稳定,难以自然降解,将其去除具有重要的意义[3]。目前,吸附[4-5]、微生物降解[6]、化学氧化[7]、光催化降解[8-9]和化学还原[3,10]等方法常被用于处理水中的4-硝基苯酚。在这些方法中,化学还原4-硝基苯酚具有操作方便、效率高、成本低等优点[10]。
催化剂作为化学还原4-硝基苯酚的关键,近年来得到了广泛的研究[11]。其中,银纳米粒子被证明是一种催化性能优异的催化剂[12]。但银纳米粒子粒径小,表面能大,使用时易团聚而导致活性大大降低,并且难以回收再利用[13]。因此,银纳米粒子常常被固定在碳纳米管[14]或多孔微球[15]等载体上,以便更好地发挥催化性能。这些载体使催化剂在反应中得到了良好的分散,但使用起来仍然不够方便,成本较高。将银纳米粒子固定到聚合物膜上,催化剂既得到了良好的分散,又在使用后不用再分离,大大节省了操作成本[15]。更重要的是,膜过滤和催化过程相结合有利于更高效地去除污染物[16]。
本文拟通过均苯三甲酰氯和间苯二胺的界面聚合反应,在聚偏氟乙烯/聚甲基丙烯酸(PVDF/PMAA)聚合物膜表面形成致密的聚酰胺(PA)表层,然后在表层上负载Ag纳米粒子催化剂,制备Ag-PA/PVDF复合膜,通过分离和催化还原高效去除4-硝基苯酚。
1 实验部分
1.1 实验试剂和仪器
试剂:聚偏氟乙烯(PVDF),相对分子质量为3.52×105,比利时SOLVAY公司产品;硼氢化钠(NaBH4)、N,N-二甲基甲酰胺(DMF)、α-甲基丙烯酸(MAA)、聚醚(F127),均为天津科密欧化学试剂有限公司产品;硝酸银(AgNO3),天津市风船化学试剂科技有限公司产品;偶氮二异丁腈(AIBN),天津市赢达稀贵化学试剂厂产品;乙腈、二甲基丙烯酸乙二醇酯(EGDMA),百灵威科技有限公司产品;4-硝基苯酚(C6H5NO3),天津市光复精细化工研究所产品;正己烷、均苯三甲酰氯(TMC),上海麦克林生化科技有限公司产品;间苯二胺(MPD),上海阿拉丁生物化学有限公司产品。以上试剂除AIBN需进一步提纯处理外,其余试剂均为分析纯,可直接使用。
仪器:TENSOR37型傅里叶红外光谱仪(FTIR),德国Bruker公司产品;S-4800型场发射扫描电子显微镜(FESEM),日本日立公司产品;K-Alpha型X射线光电子能谱(XPS),美国Thermo Fisher公司产品;JYSP-180型接触角测试仪,中国金圣鑫公司产品;715-ES型电感耦合等离子体发射光谱仪(ICP),美国Varian公司产品;TU-1810型紫外可见分光光度计,北京市普析通用仪器有限公司产品。
1.2 PMAA微球的制备
PMAA微球通过蒸馏-沉淀法制备得到[17]。将0.24 g AIBN、6.0 mL MMA、6.0 mL EGDMA和160.0 mL乙腈加入单口烧瓶中,然后磁力搅拌下升温至80℃。待溶液呈现浅蓝色之后继续反应2 h,然后冷却至室温,离心分离。将得到的粗产物用乙腈洗涤离心3次,然后在60℃真空干燥得到白色产物。
1.3 PVDF/PMAA基膜的制备
将适量聚醚(F127,质量分数为0.5%)均匀分散于DMF中,再加入2.0 g PMAA微球和6.0 g PVDF粉末,于60℃下磁力搅拌6 h,形成均一铸膜液,固含量为15%;然后真空脱泡0.5 h,将铸膜液倾倒在玻璃板上,用刮膜棒均匀刮制成液膜,将液膜放入25℃凝固浴(蒸馏水)中固化,用蒸馏水冲洗后,在蒸馏水中保存备用,将制备的基膜命名为M0。
1.4 PA/PVDF膜的制备
以水为溶剂,以质量分数为2.0%的MPD为单体配置水相溶液;以正己烷为溶剂,以质量分数为0.1%的TMC为单体配制有机相溶液。将M0膜用蒸馏水冲洗后固定于聚四氟乙烯框架之间,待膜表面自然风干后,将MPD水溶液均匀倾倒在膜表面,60 s后将溶液倒掉并用滚轮去除膜表面多余溶液;然后将TMC溶液倾倒在膜上,30 s后倒掉溶液,即得PA/PVDF膜,命名为MA。
1.5 Ag-PA/PVDF复合膜的制备
将质量分数为2.0%的MPD溶液超声分散30 min后加入AgNO3,混合均匀备用。以PA层为上表面将MA膜固定在自制膜池中,向膜池中加入50 mL AgNO3和MPD混合溶液,避光条件下将膜上表面浸泡12 h。将混合溶液倒出并用蒸馏水冲洗膜表面;然后将膜表面浸泡在1.0 g/L的NaBH4溶液中2 h,用蒸馏水冲洗膜表面后将膜取出备用。根据硝酸银的浓度不同(0.1、0.15、0.2 mmol/L),依次将复合膜命名为MA1、MA2、MA3。
1.6 复合膜的结构表征
(1)红外光谱分析:膜干燥后用傅里叶变换红外光谱(FTIR)对其进行表征,扫描范围为500~4 000 cm-1。
(2)形貌结构观察:将样品干燥,表面样品直接贴于导电胶上,断面样品用液氮脆断后贴于样品台侧面,喷金后采用扫描电子显微镜(SEM)测试。
(3)化学组成分析:采用X射线光电子能谱(XPS)进行分析,以Al Kα为X射线发射(hv=1 486.6 eV),用C1s(结合能=284.6 eV)校正峰位置。
(4)银含量测定:称取定量的干燥复合膜,剪为碎屑,将其浸泡入5 mL浓硝酸中24 h;然后滤除碎屑,将溶液稀释定容后用电感耦合等离子体发射光谱仪(ICP)测试复合膜的Ag含量。
(5)亲水性测试:剪尺寸为5 mm×25 mm干燥的膜样品,将膜固定在载玻片上,通过动态接触角测试仪测试水接触角大小,每次滴下液滴体积为3.0μL,每个样品测试3次,通过接触角大小探究复合膜的亲水性。
1.7 复合膜的分离性能测试
采用错流装置[18]对Ag-PA/PVDF复合膜进行分离性能测试。配制4-硝基苯酚(500 mL,10 mg/L,pH=10),利用紫外可见分光光度计测得原始溶液波长为400 nm处的吸光度,将其质量浓度记为C0;在0.6 MPa下预压1 h后,测试渗透端溶液波长为400 nm处的吸光度,将对应质量浓度记为Cp。

式中:Cp和C0分别为渗透液和原始料液的质量浓度;R为截留率。
1.8 复合膜催化还原4-硝基苯酚测试
配制4-硝基苯酚溶液(500 mL,10 mg/L),利用紫外可见分光光度计测得4-硝基苯酚溶液的最大吸收峰波长为400 nm。在4-硝基苯酚溶液中加入硼氢化钠配制混合溶液,使混合溶液于25℃、0.6 MPa条件下连续循环通过错流装置[18],研究Ag-PA/PVDF复合膜对4-硝基苯酚的催化还原性能。在此基础上,重复10次实验来研究复合膜的稳定性。
2 结果与讨论
2.1 膜的表征
2.1.1 红外光谱分析
图1为纯PVDF、M0、MA、MA3膜的红外光谱图。
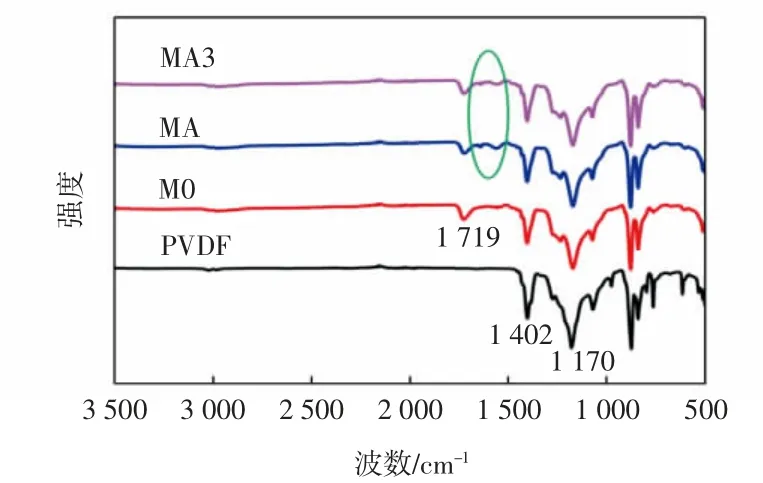
图1 不同膜的红外光谱图Fig.1 FTIR spectra of different membranes
由图1可知,所有膜的红外谱图在1 402 cm-1、1 170 cm-1处都含有特征峰,分别对应PVDF中CF2的弯曲振动和伸缩振动吸收峰以及CH2的非对称振动吸收峰[19]。与PVDF膜的红外谱图相比,M0膜的红外谱图在1 719 cm-1处出现了新的特征峰,为PMAA微球中羧基基团上C=O的伸缩振动峰[20]。与M0膜的红外谱图相比,MA和MA3复合膜的红外谱图在1 540~1 650 cm-1处出现了新的特征峰,为酰胺的伸缩振动吸收峰[21],表明MPD和TMC在M0膜表面发生了界面聚合,形成了聚酰胺层。
2.1.2 XPS谱图分析
图2为PVDF、M0、MA、MA3膜的XPS全谱图和MA3膜中Ag 3d的分峰拟合谱图。
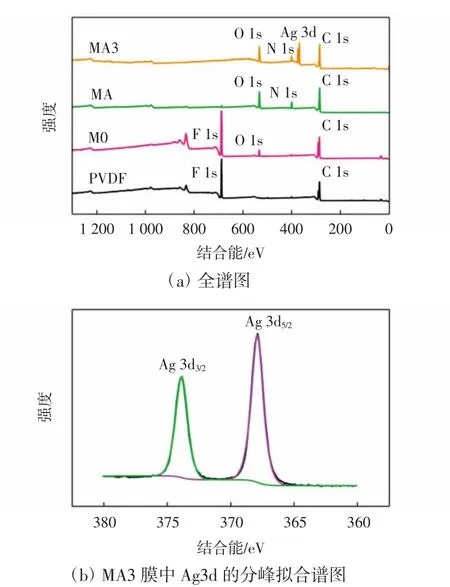
图2 不同膜的XPS谱图Fig.2 XPS spectra of different membranes
由图2可知,与纯PVDF膜相比,M0膜在结合能为534.36 eV处出现了O 1s的XPS特征峰,属于羧基中的氧[20],表明PMAA微球成功引入了膜内。与M0膜相比,MA和MA3膜在结合能为399.34 eV处出现了N 1s的XPS特征峰,为聚酰胺中的N—C=O基团[22],进一步表明了在膜表面形成了聚酰胺层。MA3膜的XPS谱图中还出现了Ag3d的特征峰,而且其可以进一步被分峰为位于374 eV处的Ag 3d3/2特征峰和368 eV处的Ag 3d5/2特征峰,表明MA3膜中银为零价,以单质形式存在[23]。
2.1.3 膜的表观形貌特征
图3、图4分别为M0、MA、MA3膜的断面和表面电镜图。

图3 不同膜的断面及其放大电镜图Fig.3 SEM images of cross section and enlarge images of different membranes

图4 不同膜的表面电镜图Fig.4 Surface SEM images of different membranes
由图3可以看出,所有膜的断面均呈现典型的非对称结构,从上到下依次为薄的表层、厚的指状孔和海绵孔层。将断面进一步放大后可以发现,M0膜的表面层断面相对光滑,MA和MA3复合膜的表面层有一明显粗糙薄层,由聚酰胺层形成。该层的厚度分别为47.72 nm和49.58 nm,表明催化剂的负载对该薄层的厚度影响不大。
由图4可以看到,M0膜的表面光滑,而MA、MA1、MA2和MA3复合膜的表面呈现卷叶褶皱和脊谷形态,具有聚酰胺层的典型特征[24-25]。同时还可以看到,与MA膜不同,MA1、MA2和MA3复合膜的表面均出现了Ag纳米颗粒。而且,Ag纳米颗粒的数量依次增加,但都均匀分布在膜表面。经过ICP测得MA1、MA2、MA3复合膜的银含量分别为0.317、0.452和0.613 mg/g。Ag纳米颗粒催化剂的粒径统计分布结果如图5所示。由图5可知,MA1、MA2和MA3膜上Ag纳米粒子的粒径分别为11.59、13.82和14.02 nm,尺寸依次略有增加。
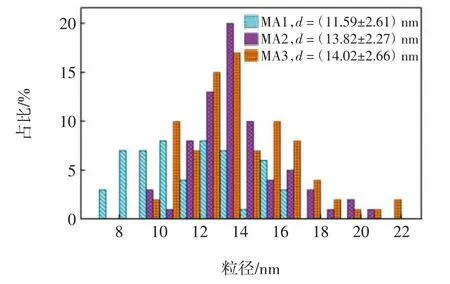
图5 不同膜上催化剂粒径分布Fig.5 Particle size distribution of catalyst on different membranes
2.1.4 亲水性分析
不同膜的水接触角如图6所示。
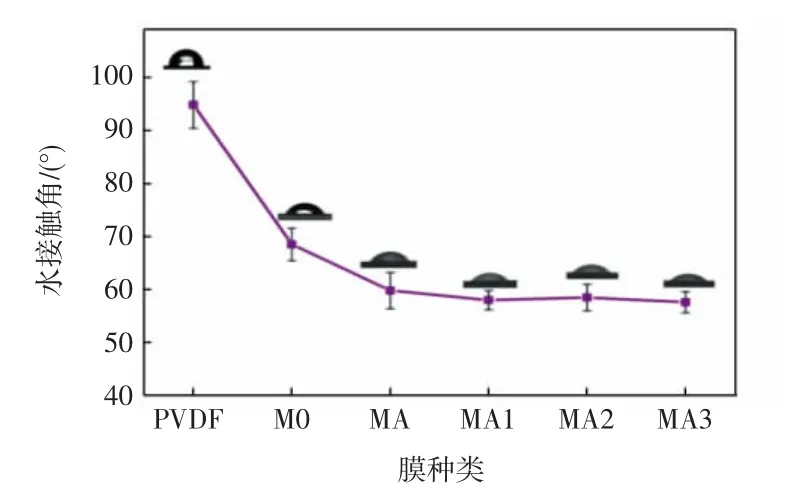
图6 不同膜的水接触角Fig.6 Water contact angle of different membranes
由图6可知,纯PVDF膜因其本身的疏水特性,其接触角为94.8°;引入PMAA微球后,微球上大量的羧基使得M0膜亲水性提高,接触角下降为68.5°;聚酰胺层存在可以使复合膜亲水性进一步提高[26],因而MA膜的接触角进一步下降为59.8°;MA1、MA2、MA3复合膜的接触角几乎没有变化,表明银纳米粒子催化剂含量对复合膜的亲水性影响不明显。
2.2 Ag-PA/PVDF复合膜的催化性能
2.2.1 分离4-硝基苯酚
以MA3复合膜为代表,过滤前后4-硝基苯酚的吸光度变化如图7所示。
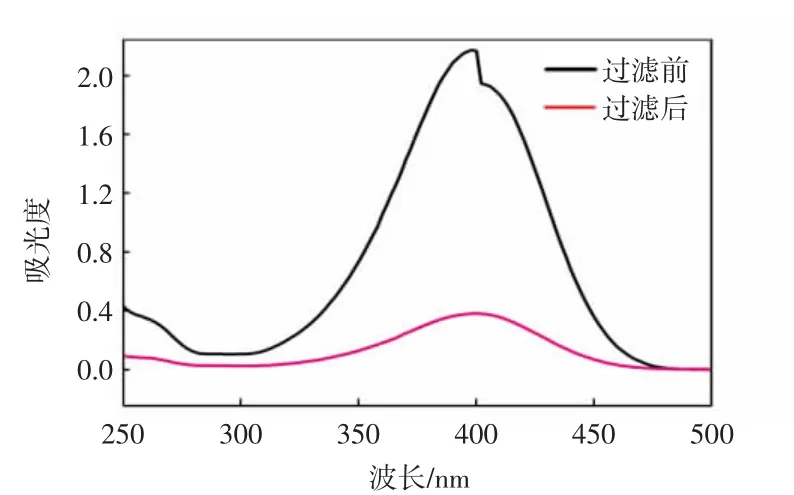
图7 过滤前后4-硝基苯酚的紫外光谱图Fig.7 UV absorption spectrum of 4-nitrophenol before and after filtration
由图7可以发现,过滤之后的滤液吸光度明显降低,经过式(1)计算得截留率为82.5%。虽然复合膜可以截住大部分4-硝基苯酚,但渗透液中污染物含量仍然较高,效果不理想。而且,截留后的保留液仍然需要通过实验进一步分离去除4-硝基苯酚。因此,本文采用错流模式循环,利用分离层上的Ag纳米粒子催化剂对截留下来的4-硝基苯酚进行同步催化还原,更好地对渗透液和保留液中的污染物进行去除。
2.2.2 催化还原4-硝基苯酚
以MA3复合膜为代表,研究了复合膜对4-硝基苯酚溶液在错流模式下的催化还原。4-硝基苯酚溶液为黄绿色,没有催化膜或还原剂硼氢化钠的情况下,溶液长时间放置不会有明显变化。当溶液中加入硼氢化钠后,MA3复合膜中的银纳米粒子催化剂可以催化硼氢化钠还原4-硝基苯酚为4-氨基苯酚;同时,溶液由黄绿色逐渐变为无色。错流模式下溶液吸光度随时间变化如图8所示。
由图8可以看出,随着催化还原反应的进行,400 nm处的吸光度逐渐衰减,在反应进行到60 min时完全消失;同时,在310 nm处出现了4-氨基苯酚的吸收峰[3],而且其强度逐渐增高。图8(b)显示ln(Ct/C0)与时间具有良好的线性相关性,说明反应过程符合一级动力学反应规律[27]。因此,通过一级反应动力学公式(2)可以计算出MA3复合膜催化还原4-硝基苯酚的速率常数kapp,其值为0.078 24 min-1。

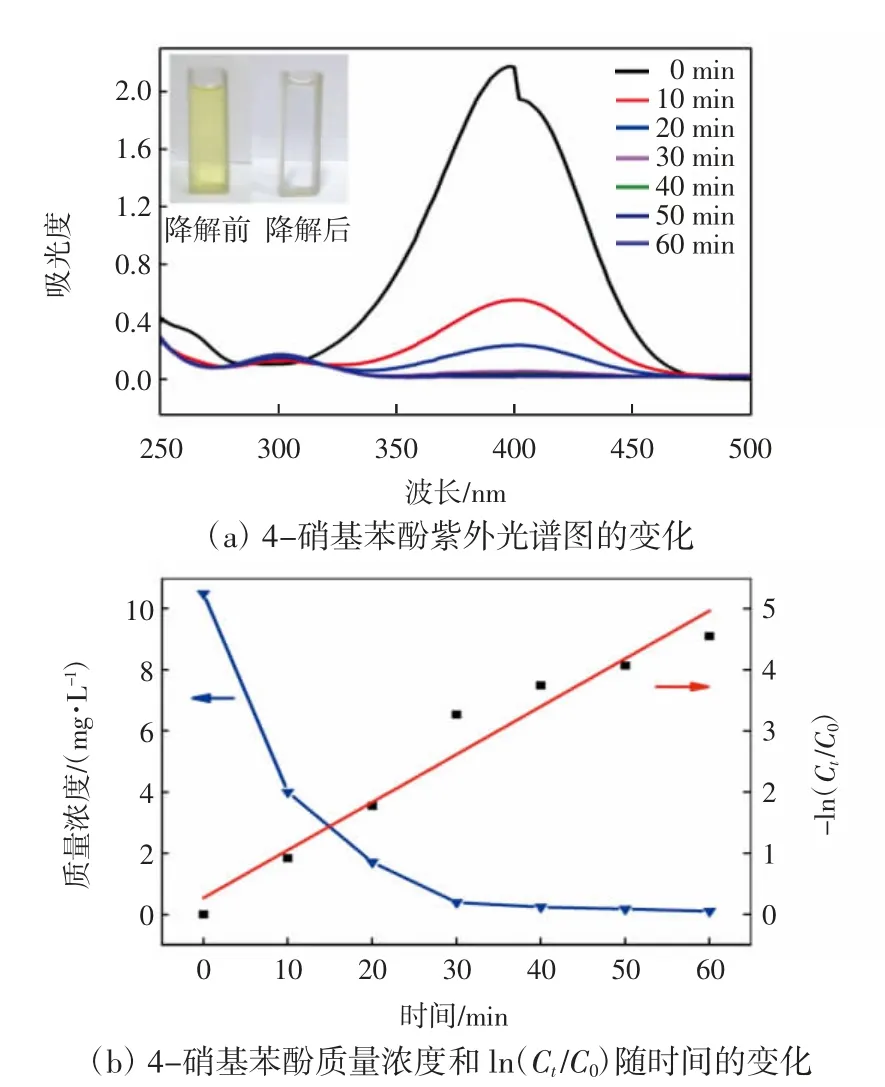
图8 4-硝基苯酚溶液吸光度和浓度的变化Fig.8 Changes of UV-vis absorption and concentration of 4-nitrophenol solution
式中:C0和Ct分别为反应溶液初始和反应t时刻的质量浓度;kapp为一级反应动力学表观速率常数。
2.2.3 银负载量对4-硝基苯酚催化反应的影响
图9为不同Ag纳米粒子负载量对4-硝基苯酚催化还原反应的影响。
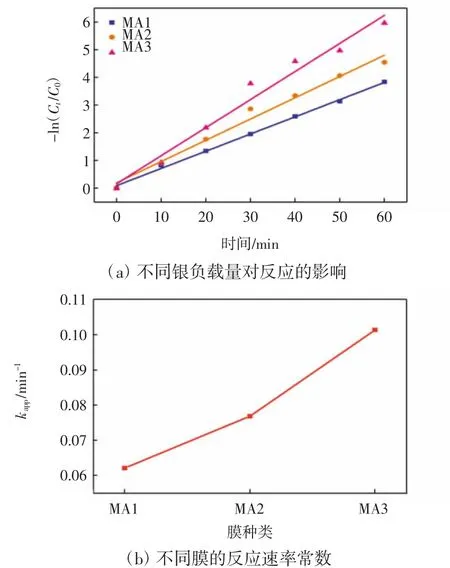
图9 银负载量对4-硝基苯酚催化反应的影响Fig.9 Effect of Ag load on catalytic reduction reaction of 4-nitrophenol
由图9可以看出,采用不同银负载量的复合膜对4-硝基苯酚进行催化还原去除,其-ln(Ct/C0)与时间均呈线性关系,表明所有反应都为一级动力学反应。通过公式(2)可计算得到催化反应的表观速率常数,如图9(b)所示,从MA1到MA3膜,随着催化剂负载量增加,催化反应速率常数由0.062 1 min-1增加到了0.101 3 min-1。这是因为催化还原反应在纳米粒子表面发生,催化剂负载量的增加使得催化活性位点增加,可以提供更多的反应位点促进还原反应发生。
2.2.4 温度对4-硝基苯酚催化反应的影响
图10所示为不同温度对MA3复合膜催化还原4-硝基苯酚反应的影响。
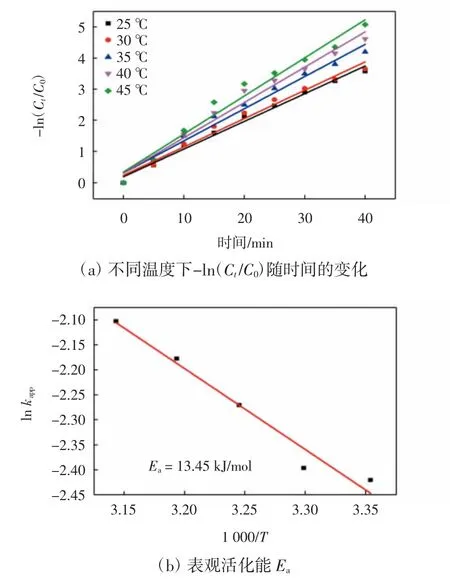
图10 温度对4-硝基苯酚催化反应的影响Fig.10 Effect of temperature on catalytic reduction reaction of 4-nitrophenol
由图10(a)可知,-ln(Ct/C0)与时间之间呈明显的线性关系,证明不同温度下的催化还原反应遵循一级动力学反应。随着温度升高,直线的斜率上升,反应速率常数由0.088 9 min-1增加到0.122 1 min-1,表明温度升高能明显加快4-硝基苯酚的催化速率。以1 000/T为横坐标,以lnkapp为纵坐标,通过式(3)的Arrhenius方程进一步研究了反应速率与温度的关系:

式中:A为指前因子(min-1);Ea为表观活化能(kJ/mol);T为开尔文温度(K);R为理想气体常数(8.314 J/(K·mol))。经过线性拟合得到图10(b)中的点,可得复合膜催化4-硝基苯酚还原的表观活化能,其值Ea=13.45 kJ/mol。Ea值小于29 kJ/mol,表明催化还原反应过程可能为扩散控制[28]。
2.2.5 复合膜的稳定性
复合膜(MA3)的稳定性通过10次重复性催化还原实验进行研究。反应温度为25℃,压力为0.6 MPa,反应时间为60 min。图11为4-硝基苯酚催化还原之后的去除率。
由图11可以看出,每次实验获得的4-硝基苯酚的去除率均在93.5%以上,且10次循环以后几乎没有下降,表明复合膜具有优异的稳定性。该复合膜省去了催化剂与反应体系分离,减少了催化剂分离的操作成本,在小分子污染物去除领域具有一定的应用前景。
3 结论
本文在PVDF/PMAA基膜表面通过界面聚合构建了聚酰胺分离层,然后在分离层上原位负载银纳米粒子催化剂,制备了Ag-PA/PVDF复合催化膜,在错流循环模式下研究了其对4-硝基苯酚的催化还原性能,结果表明:
(1)Ag-PA/PVDF复合膜可以催化还原4-硝基苯酚,反应遵循一级反应动力学,表观活化能为Ea=13.45 kJ/mol。
(2)随着膜表面催化剂负载量的增加,催化反应速率常数由0.062 1 min-1增加到0.101 3 min-1;随着温度升高,催化反应速率常数由0.088 9 min-1增加到0.122 1 min-1。
(3)经过10次循环反应后,复合膜催化还原4-硝基苯酚的去除率仍然在93.5%以上,具有良好的稳定性。
