荧光碳点的制备及其在I-检测中的应用
2021-11-10庞纪平江英霞颜范勇施锦辉
庞纪平,江英霞,颜范勇,施锦辉
(1.天津中新药业集团股份有限公司 中新制药厂,天津 300450;2.天津工业大学 分离膜与膜过程国家重点实验室/国家分离膜国际联合研究中心,天津 300387;3.南通海关 综合技术中心,江苏 南通 226004)
碘是人体必需的微量元素之一,可参与甲状腺激素的合成,调控人体的生长发育[1-3]。长期缺碘可引起甲状腺功能低下,而长期碘过量则容易引起碘中毒,表现为消化道刺激症状等[4-5]。因此,准确测定生物、环境样品及食品蔬菜中的碘含量对人体健康状况分析、食物营养评价和环境评估有重要意义。目前,I-的检测方法主要有离子色谱法、分光光度法、电化学法、中子活化法和色谱光谱法等[6-9]。这些方法具有灵敏度高和选择性好的优点,但成本高,操作复杂。与之相比,荧光分析法不仅选择性好,而且操作简便、成本低廉,可以高灵敏快速检测I-[10-13]。
CDs与传统的石墨烯量子点相比,其光学性质对pH值、光照、温度和离子强度等具有更好的稳定性,在应用时受到的限制条件较少。CDs还具有良好的水溶性、低毒性和良好的生物相容性等优点,被广泛应用于传感、生物成像和光学器件等多个领域[14-16]。CDs一般可用于检测金属离子以及其他无机离子,例如Fe3+、Hg2+、Al3+、F-、NO2-和OCl-[17-20],但对I-检测的研究仍然十分有限。因此,采用一步法合成用于检测I-的荧光CDs至关重要。
本文以无水柠檬酸为碳源,乙二胺为氮源,通过一步水热法合成了氮掺杂的CDs,通过TEM、UV-vis、FTIR和荧光光谱对CDs的结构和光学特性进行表征;并在此基础上,开发了一种基于CDs的快速、灵敏检测实际水样中I-的方法。
1 实验部分
1.1 实验试剂与仪器
试剂:无水柠檬酸(≥99.5%)、N-2-羟乙基哌嗪-N′-2-乙磺酸(HEPES),上海阿拉丁试剂有限公司产品;乙二胺,天津大茂化学试剂厂产品;NaH2PO4、Na2HPO4、Na2S2O3、Na2SO4、NaHSO3、Na2S,均为天津市风船化学试剂科技有限公司产品;NaNO2、NaNO3、NaAc、NaF,天津市北方天医化学试剂厂产品;KBr、NaCl、KI,天津市福晨化学试剂厂产品;CaCl2、MgCl2、AlCl3,天津市化学试剂三厂产品。以上试剂均为AR级。
仪器:ALC-210.4型分析天平,上海奥豪斯仪器有限公司产品;DZG-401型电热真空干燥箱,天津天宇实验仪器有限公司产品;RE-52A型旋转蒸发仪,上海雅荣生化设备仪器有限公司产品;KH-250型超声清洗器,昆山禾创超声仪器有限公司产品;TENSOR37型傅里叶变换红外光谱仪、F380型荧光分光光谱仪,天津港东科技发展股份有限公司产品;ZF-1型紫外-可见分光光度计,北京北分瑞利分析仪器有限责任公司产品;JEOL-2010F型透射电子显微镜,日本电子株式会社产品;T500型分析天平,天津市天马仪器厂产品。
1.2 CDs的合成及纯化
采用简单的一步水热法制备CDs。准确量取0.156 0 mL乙二胺和1.345 0 g无水柠檬酸于50 mL烧杯中,加入30 mL去离子水超声使其溶解,将溶液倒入50 mL水热反应釜中于190℃加热5 h。反应完成后待其自然冷却至室温得到深棕色的溶液。通过离心除掉溶液中的不溶性颗粒,转速为4 000 r/min,离心时长为15 min。将离心后的上清液进行进一步的透析纯化(MW=3.5 ku),透析时间为24 h,此操作目的是除去体系中未反应的前体化合物。之后再用旋转蒸发仪对透析后的产物进行旋转蒸发,真空旋干,得到纯化的CDs产物。
1.3 标准溶液的配置
(1)精密称量CDs 0.01 g,用水做溶剂使其充分溶解,溶解之后将其稀释定容到50 mL并进行适当摇晃,配制成质量浓度为0.2 mg/mL的标准母液。放置于冰箱保存备用。
(2)准确称取适量的NaH2PO4、Na2HPO4、Na2S2O3、Na2SO4、Na2S、NaHSO3、NaNO2、NaNO3、NaAc、NaF、KBr、NaCl、KI、MgCl2、AlCl3、CaCl2等配制成浓度为2.0 mmol/L的标准溶液。配制完成之后将其做好标记,保存于冰箱备用。
(3)准确称量119.15 g HEPES溶解在400 mL蒸馏水中,加0.5~1 mol/L的NaOH水溶液调节至pH值为7.4,然后用蒸馏水定容至500 mL,于冰箱保存备用。
1.4 CDs的选择性和I-的测定
(1)CDs的荧光选择性:首先取200μL CDs母液于10 mL容量瓶中,然后加入浓度为2 mmol/L的待测离子100μL,放置15 min后在350 nm的激发波长下进行荧光扫描,激发和发射狭缝均设置为2.5 nm。
(2)I-的测定:取100μL CDs溶液加入到10 mL容量瓶中,再向其中加入不同浓度的I-溶液,用10 mmol/L的HEPES缓冲液(pH值为7.4)定容。将混合液充分摇匀后于室温下静置10 min,之后在激发波长为350 nm下记录CDs荧光强度的变化。在此过程中,激发和发射狭缝均设置为2.5 nm。
(3)干扰性评估:分别取100μLCDs溶液和200μL阴离子的标准溶液加入到10 mL容量瓶中,再用配制的HEPES缓冲液定容。将混合液充分摇匀后于室温下静置10 min,之后在激发和发射狭缝为2.5 nm、激发波长为350 nm的条件下记录CDs荧光强度的变化。
1.5 量子产率的计算
CDs的量子产率(φ)是使用硫酸奎宁为标准物质(φf=54%)来计算的[21-22]。首先,将CDs溶解在水中,将硫酸奎宁溶解在0.1 mol/L H2SO4中形成0.1μg/mol溶液。然后配置5个不同梯度的CDs和硫酸奎宁溶液。为了最大程度地减少重吸收效果,硫酸奎宁在10 mm荧光比色皿中的吸光度保持在0.05以下,而CDs的吸光度保持在0.1以下。荧光积分强度是最佳激发波长下荧光光谱的积分面积。然后使用荧光积分强度对吸光度作图,截距为零。量子产率计算公式为:
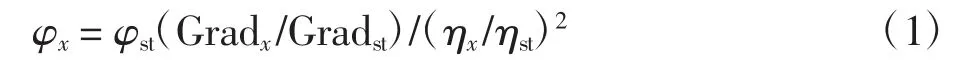
式中:φ为量子产率;Grad为荧光积分强度与吸光度之间关系的梯度;η为溶液折射率;x代表未知样品;st为标准品;对于水溶液来说,ηx/ηst=1。
1.6 I-的加标实验
为了评估CDs在实际应用中的可行性,研究了CDs在实际水样中对I-的加标回收实验。以天津工业大学的自来水为例。在进行I-加标实验前,该水样先通过0.35μm的滤膜过滤其中可能存在的不溶性杂质。之后,用该水样配制5、10、15和20μmol/L的KI溶液,在室温下孵育15 min后,在350 nm的激发波长下对每个样品测量3次,记录在450 nm处的荧光强度,与对应I-浓度的标准荧光强度作比较,计算回收率:
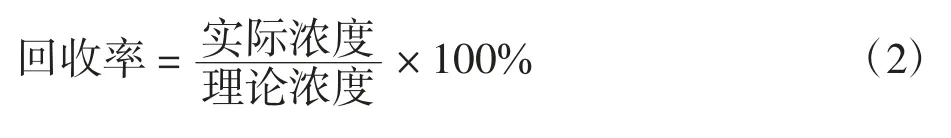
2 结果与讨论
2.1 碳点的表征与光学性质
本文利用TEM、FTIR、XRD、UV-vis和荧光光谱对所制备的CDs进行表征,结果如图1—图2所示。
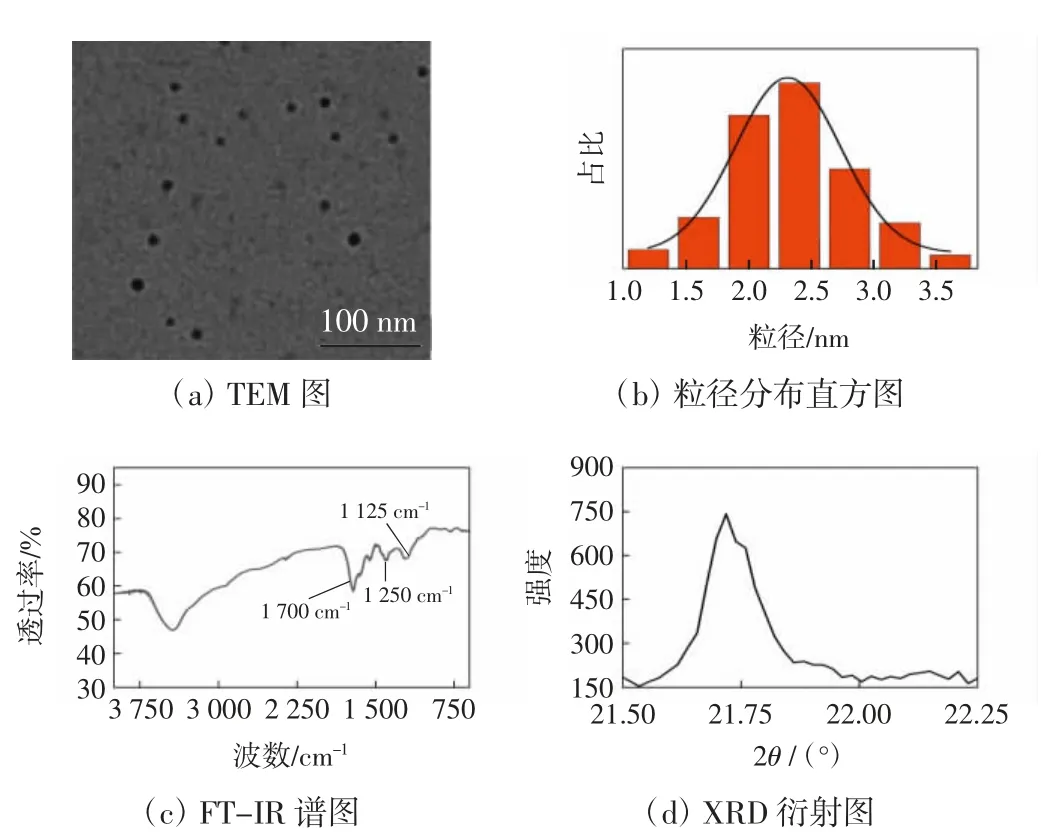
图1 CDs的TEM图、粒径分布直方图、FT-IR谱图和XRD衍射图Fig.1 TEM image,particle size distribution diagram,FT-IR spectra and XRD diffraction pattern of CDs
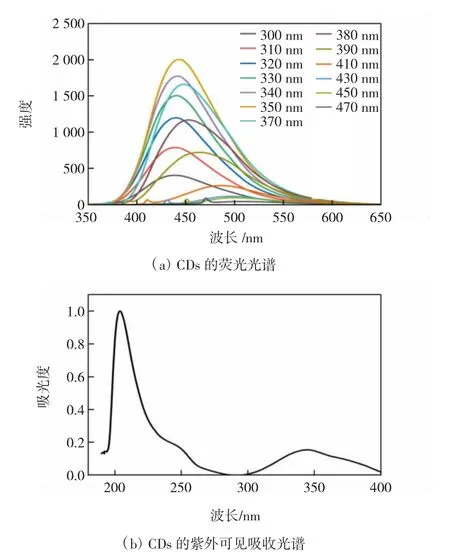
图2 CDs的荧光光谱和紫外可见吸收光谱Fig.2 Fluorescence spectra and UV-vis absorption spectra of CDs
CDs的形态和粒径通过TEM图像表征。由图1(a)和图1(b)可知,由柠檬酸和乙二胺通过一步水热法制备的CDs呈类球形结构并且具有良好的分散性;本文制备的CDs具有较窄的粒径分布,主要分布在1.1~2.7 nm的范围内,平均粒径为2.25 nm。
CDs表面官能团的类型通过FT-IR图谱测定。由图1(c)可知,N—H或O—H的伸缩振动峰位于3 400 cm-1左右;C=O的伸缩振动峰位于1 700 cm-1左右;1 250 cm-1左右的峰为C—N的伸缩振动峰;1 175 cm-1左右的峰为C—C的伸缩振动峰。由此可知,本文合成的CDs表面同时具有—NH2与—COOH等官能团。
图1(d)为CDs的XRD图谱,其在2θ=21.5°处具有一个明显且较宽的衍射特征峰,这归因于(002)晶格面的衍射。稍微大于石墨晶格间距(0.34 nm),是由于在CDs中引入了含N和含O基团。
CDs的荧光光谱如图2(a)所示,由于表面的不均一性,随着激发波长的增加,CDs的发射峰逐渐红移,表明CDs具有激发决定发射的性质[23-24]。并且CDs的荧光强度随着激发波长的增加先增加后降低,在激发波长为350 nm时荧光强度在450 nm处具有最佳的发射峰。因此,350 nm为该CDs的最佳激发波长,之后的测量均使用该激发波长。
图2(b)为CDs的UV-vis光谱,由图2(b)可知,该CDs在203、252和345 nm处具有3个吸收峰。在203和252 nm处的吸收峰主要由C=C键上π-π*的电子跃迁造成,而在345 nm处的吸收峰主要由C=O上n-π*的电子跃迁造成[25-26]。
通过对CDs在不同pH溶液和不同浓度NaCl溶液中的荧光强度来研究CDs的光稳定性,结果如图3和图4所示。
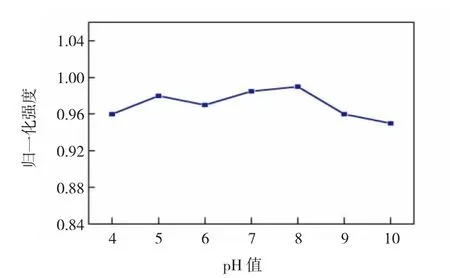
图3 不同pH条件下CDs的荧光稳定性Fig.3 Fluorescence stability of CDs at different pH conditions
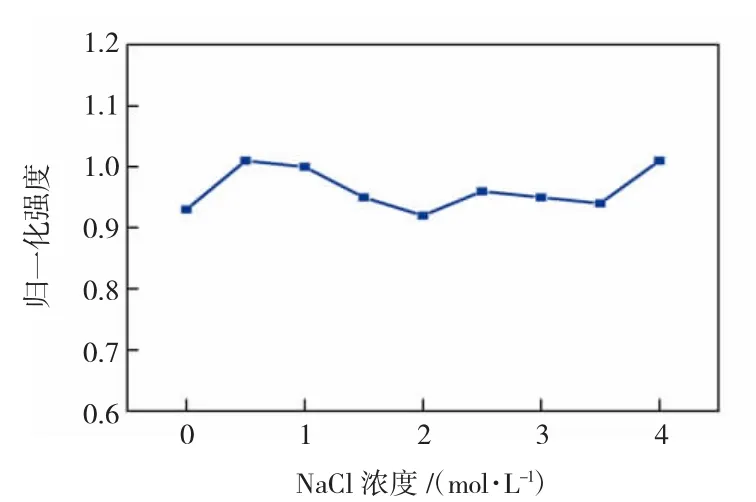
图4 盐浓度对CDs荧光强度的影响Fig.4 Effect of salt concentration on luorescence intensity of CDs
由图3可知,在pH值从4变化到10的过程中,CDs的归一化荧光强度仅有微弱的变化,并且在pH值为8时达到最高值。因此,在之后的检测中HEPES缓冲液的pH值在7~8之间对荧光检测最为有利。由图4可知,明显地,即使NaCl的浓度达到4.0 mol/L时,CDs的荧光强度也没有明显下降的趋势。以上结果表明,本文所合成的CDs具有优异的荧光稳定性。
2.2 CDs的选择性与滴定实验
CDs对常见离子的选择性识别结果如图5所示。
由图5可知,在阳离子对CDs的滴定过程中(图5(a)),Cr6+由于在470 nm处本来就有一定的吸收,所以Cr6+在阳离子检测中表现出来的特殊吸收现象并不能说明本文合成的CDs对其有特殊的选择性。而如图5(b)所示,在对阴离子检测的过程中,CDs的荧光被I-淬灭,这说明本文合成的CDs对I-具有特异性识别能力。
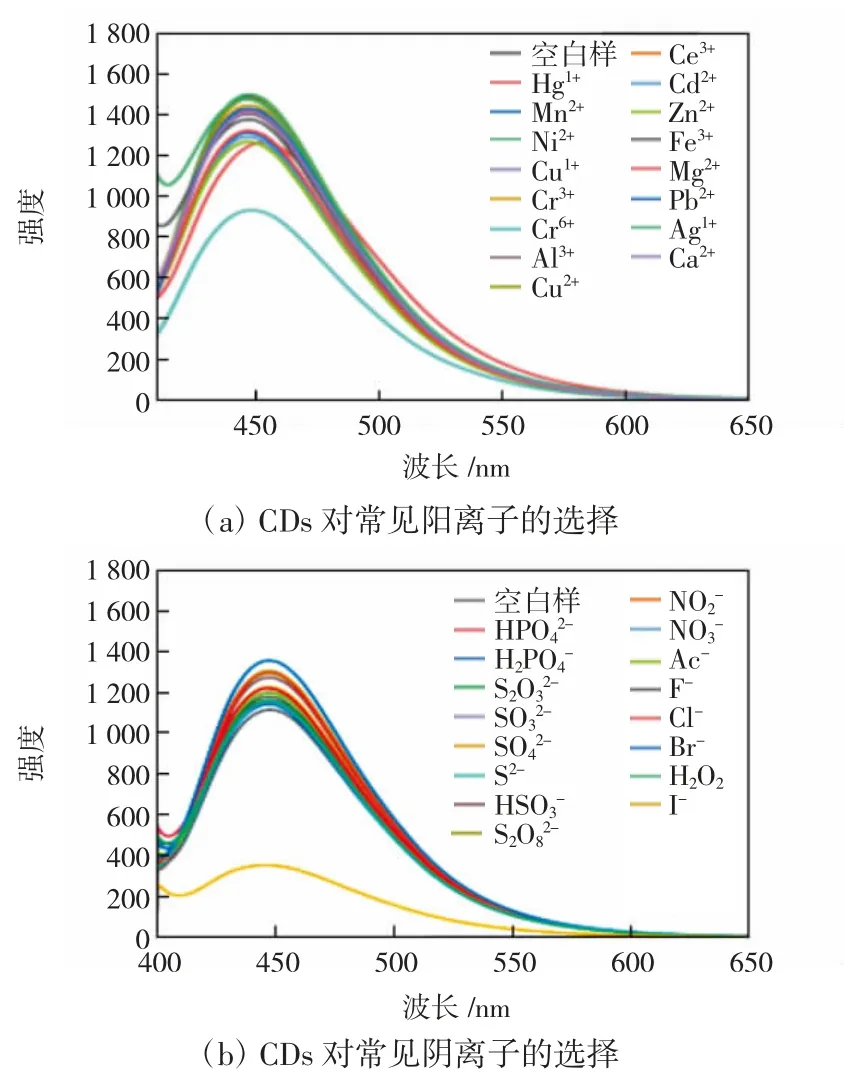
图5 CDs对常见阳离子和阴离子的选择性Fig.5 Selectivity of CDs for common cations and anions
在350 nm的激发波长下评估不同浓度的I-对CDs在450 nm处的荧光强度的影响,结果如图6和图7所示。由图6可知,随着I-浓度的增加,CDs的荧光强度逐渐降低。图7为CDs荧光强度与I-浓度的线性关系图。由图7可见,当I-浓度范围为20~90μmol/L时CDs的荧光响应(F0-F)与I-浓度有较好的线性关系,并且由此得到的检测限为1.743μmol/L。
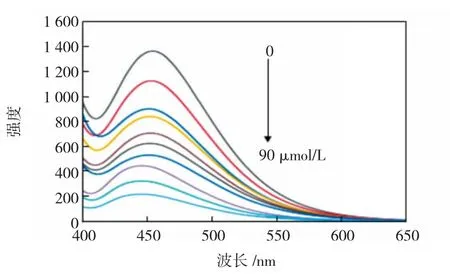
图6 I-对CDs的荧光滴定光谱Fig.6 Fluorescence titration spectra of I-on CDs
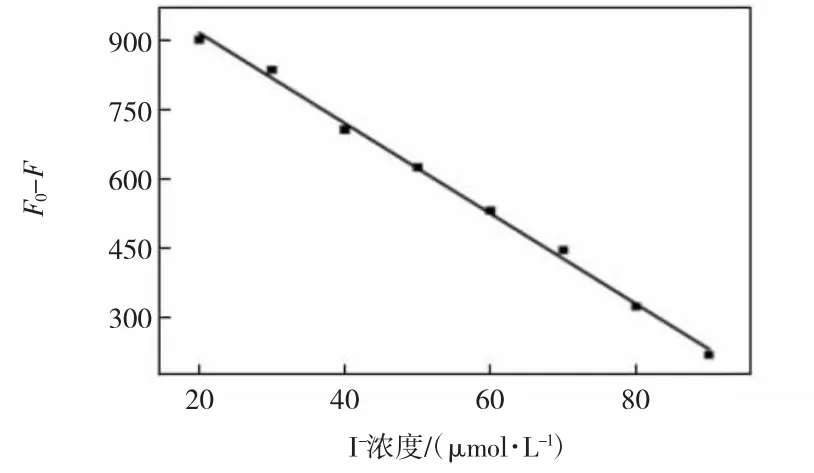
图7 F0-F与I-浓度的线性关系Fig.7 Linear relationship between F0-F and I-
2.3 干扰性评估和机理研究
CDs对I-灵敏性的抗干扰性评估结果8所示。由图8可知,当其他干扰性离子存在时,加入I-后CDs的荧光淬灭程度与没有存在干扰性离子几乎一样,说明其他阴离子的存在对CDs检测I-具有可忽略的影响,说明该CDs具有良好的抗干扰能力。
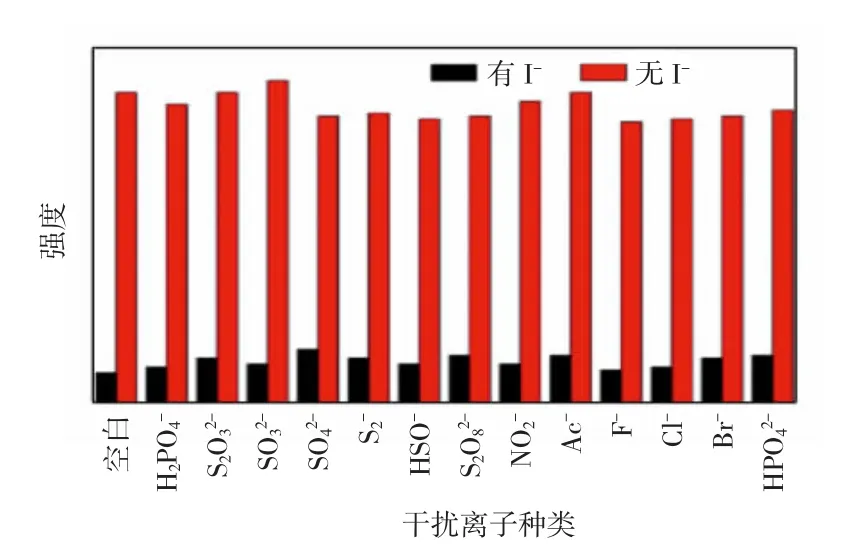
图8 干扰离子对CDs荧光强度的影响Fig.8 Effect of interfering ions on fluorescence intensity of CDs
通常CDs的淬灭机理主要包括静态淬灭、动态淬灭、内滤效应(IFE)和福斯特共振能量转移(FRET)[22-25]。通过测定加入I-前后CDs的荧光衰退曲线和紫外吸收光谱分析CDs对I-的检测机理,如图9所示。
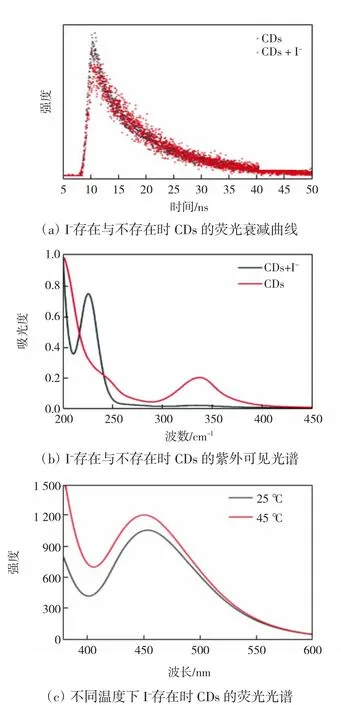
图9 CDs对I-的检测机理分析Fig.9 Detection mechanism analysis of I-by CDs
由图9(a)可知,CDs的荧光寿命为9.644 ns,加入I-之后CDs的荧光寿命为9.313 ns,荧光寿命几乎没有改变,因此,可排除动态淬灭和FRET。由图9(b)可知,加入I-后,CDs在345 nm处的吸收峰降低而240 nm处的吸收峰增加,240 nm处不发光基态复合物的形成导致CDs的紫外吸收谱图改变,由此排除IFE。因此,CDs与I-相互作用的机理为静态淬灭。由图9(c)可知,当加入相同浓度I-后仅升高反应温度时CDs的荧光淬灭程度下降,进一步验证了淬灭机理为静态淬灭[27]。
2.4 I-在实际样品中的加标实验
为了验证本文合成的CDs可以选择性识别I-,通过在自来水样品中分别加入不同浓度的I-进行加标回收实验,结果如表1所示。由表1可知,得到I-的回收率在98.7%~101%之间。以上结果表明回收率较高,能够定量回收I-。由此说明,本文合成的CDs可用于有效、灵敏地检测自来水中的I-含量。
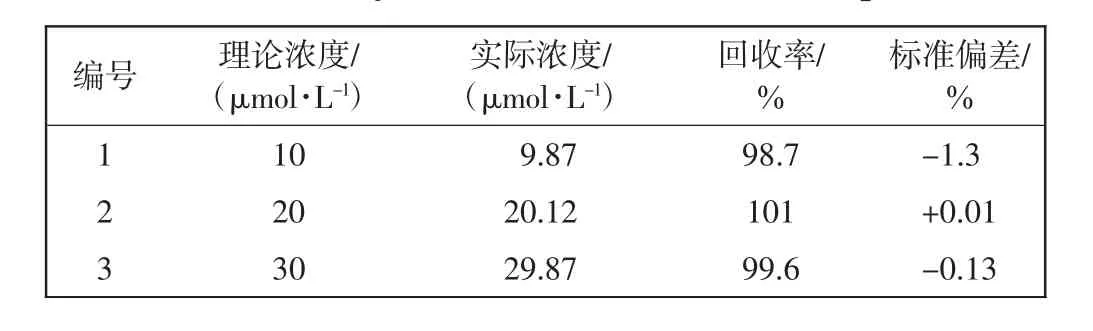
表1 水样中I-的分析结果Tab.1 Analytical results of I-in water samples
3 结论
采用无水柠檬酸和乙二胺通过一步水热法合成了水溶性的蓝色发射荧光CDs,利用TEM、FTIR、UVvis和荧光光谱对CDs的结构、元素组成和光学性质进行了表征,并采用CDs检测水样中的I-,考察其检测效果和淬灭机理,结果表明:
(1)CDs的荧光强度与I-浓度在20~90μmol/L的范围内具有良好的线性关系,检测限为1.743μmol/L。
(2)该CDs对I-具有良好的特异性识别能力和灵敏度,淬灭机理为静态淬灭。通过真实水样中的加标实验进一步发现,该方法具有良好的实际应用前景。
