江苏典型斑点叉尾鮰(Ictalurus punctatus)养殖区多环芳烃生态风险及健康风险评价
2021-11-09徐志华刘熠刘崇万任娣耿雪冰葛筱琴朱晓华
徐志华,刘熠,刘崇万,任娣,耿雪冰,葛筱琴 ,朱晓华*
(1.江苏省淡水水产研究所/江苏省渔业产品质量安全重点实验室,南京 210017;2.江苏省水产质量检测中心/农业农村部渔业产品质量监督检验测试中心(南京),南京 210017)
多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)指分子中含有两个以上苯环的碳氢化合物,是一类典型的持久性有机污染物,可以在环境中持久存在,难以降解。目前有150 余种PAHs,其中16 种被美国环保局(USEPA)列为优先控制的污染物[1−3]。该类化合物能够通过多种途径(如废水排放、大气沉降、地表径流及原油泄漏等)进入水体[4]。由于鱼类处于水生态系统食物链的顶端,水环境中的PAHs 能通过鱼的鳃、皮肤或饲料等途径进入鱼体内累积,进而导致人类食用后具有一定的健康风险[5]。水体沉积物被认为是PAHs 的最终归宿之一,富集在沉积物中的PAHs 可通过食物链传递给高营养级生物,通过再悬浮作用释放到环境中,从而造成“二次污染”[6−7]。因此研究水产品及养殖环境中水体和沉积物PAHs 的浓度分布、污染特征及其健康风险与生态风险具有重要意义。目前研究主要集中在水体和水产中PAHs的含量和风险评估[5,8−10],或沉积物及水产中 PAHs 的残留与风险分析[7,11],如张光贵[7]、王晓迪等[8]分别研究了大通湖表层沉积物和大庆湖泊群水体、淡水鱼含量及生态风险。由于水体的受污染程度与地区经济发展水平密切相关,目前大部分地区的水体都不同程度地受到PAHs 的污染[12−13]。江苏属于东部沿海经济较发达地区,目前PAHs 主要研究领域在长江太湖等热点水域,对江苏重点水产品养殖区污染监测较少,以渔业养殖环境(水体、水产品、底泥)作为研究方向的则更少,因此本文以江苏重点水产品养殖区为研究对象。斑点叉尾鮰属于鮰科鱼类[14],是我国斑点叉尾鮰产业的主要品种[15],鉴于近两年来商品鮰产品在营养和市场消费方面的优势,斑点叉尾鮰国内消费市场被逐步打开,带动斑点叉尾鮰养殖形势逐年向好。2019年,江苏斑点叉尾鮰主养区的斑点叉尾鮰池塘精养面积约6 667 hm2,产量达到1 400 t[16],因此选用斑点叉尾鮰典型养殖区具有较强的地域代表性。本研究根据生长周期分3次(3月、7月、10月)采集2020年江苏典型斑点叉尾鮰5 个养殖区水体、底泥、斑点叉尾鮰样品,测定PAHs 含量,探明其污染现状及污染特征,并对水体和底泥进行生态风险评估,对斑点叉尾鮰样品进行食用健康风险评价,以期为养殖区PAHs污染防治提供基础资料,这对保障食品安全、科学防范健康风险具有指导作用。
1 材料与方法
1.1 仪器与设备
采集设备:多参数水质分析仪(美国YSI);柱状采泥器(北京普雷德仪器设备有限公司)。主要前处理设备:GPC−ULTR GPC 凝胶净化浓缩系统(德国LC tech 公司);R−81 脂肪测定仪、R−200 旋转蒸发仪(瑞士步琦公司);TurbovapⅡ全自动浓缩工作站(英国Caliper 公司)。样品分析设备:Agilent7890A/5975C气相色谱−质谱联用仪(美国Agilent公司)。
1.2 标准品
16 种PAHs 混合标准品[萘(Nap)、苊(Ace)、苊烯(Acy)、芴(Flu)、菲(Phe)、蒽(Ant)、荧蒽(Fla)、芘(Pyr)、苯并[a]蒽(BaA)、苗屈(Chr)、苯并[b]荧蒽(BbF)、苯并[k]荧蒽(BkF)、苯并[a]芘(BaP)、茚酚[1,2,3−cd]芘(Inp)、二苯并[a,h]蒽(DahA)和苯并(g,h,i)苝(BghiP),200 mg·L−1,购自农业农村部环境保护科研监测所];内标苝−d124.0 mg·L−1、苊−d104.0 mg·L−1、菲−d120.2 mg·L−1、苗屈−d124.0 mg·L−1(美国 Accustan⁃dard公司)。
1.3 样品采集、制备及前处理
1.3.1 样品采集
选取5 个示范基地(图1),根据生长周期分3 次(3 月、7 月、10 月)采集同一池塘样品,每个养殖场根据池塘数采集1~2 个样品,共计72 个样品。采样信息见表1。

表1 采样地点及经纬度Table 1 Sampling location,longitude and latitude
1.3.2 样品制备
鱼体:每个样点采集斑点叉尾鮰鱼样若干(至少3条),取可食部分约200 g,用高速万能粉碎机制成鱼糜,冷冻贮存,供前处理使用。
水样:每个样点采集2 L 水样,过0.45µm 孔径玻璃纤维滤膜,去除悬浮物,待前处理。
底泥:每个样点抽取池塘底泥2 kg(池塘对角线平均取3 点),用金属抓斗式采样器采集池塘底表层沉积物样品,带回实验室后经过自然风干、均一,研磨过0.15 mm孔径(100目)铜筛,待前处理。
1.3.3 样品前处理
水样前处理:用C18固相萃取柱(6 mL,0.5 g,美国Supelco 公司)萃取PAHs,将萃取柱带回实验室进行洗脱与分析。鱼体、底泥参照徐志华等[17]关于渔业养殖环境及水产品中16 种PAHs 测定方法,气相色谱−质谱联用仪上机检测。
1.4 标准溶液及质量控制
标准溶液:使用正己烷配制成含16种PAHs 浓度为 1.0、5.0、25.0、50.0、100、250 µg·L−1,内标浓度为100µg·L−1的标准溶液,以标准溶液中被测组分峰面积和内标物质峰面积的比值为纵坐标,标准溶液中各种PAHs 的浓度和内标物质浓度的比值为横坐
标[17−18]。
质量控制:取同批次的底泥、养殖用水、斑点叉尾鮰,分别加入1.0 µg·kg−1混合标准溶液,每个浓度设置6 个平行。加标及相对偏差分别为:底泥52.4%~110.7%、0.64%~8.94%;养 殖 用 水 74.1%~116.7%、0.52%~8.91%,水产品70.3%~126.4%、0.14%~8.91%;平均检出限为0.017~0.171 µg·kg−1[17−18]。
1.5 仪器工作条件
色谱条件:DB35−MS(30 m×0.25 mm,0.25 µm);进样口温度260 ℃;载气为99.999%高纯氮气;不分流进样,进样量 1 µL;流量 1.0 mL·min−1;柱升温程序:初始温度70 ℃(1 min),15 ℃·min−1升至 190 ℃(1 min),25 ℃·min−1升至 200 ℃;5 ℃·min−1升至 230 ℃(4 min),2.5 ℃·min−1升至250 ℃(3 min),2 ℃·min−1升至280 ℃(3 min),20 ℃·min−1升至310 ℃(2 min)[17−18]。
质谱条件:EI源;离子源温度160 ℃;四极杆温度150 ℃;传输线温度280 ℃;选择离子检测(Selectedion recording,SIM)模式;各种PAHs及内标物的定性、定量离子参考文献[17−18]。
GPC 条件:TACS TM 系统参数:油浴温度 40 ℃,流速 5.0 mL·min−1,样品定量环 5 mL,前运行时间1 140 s,主运行时间 2 000 s,后运行时间120 s,真空参数:阶段 1 为 17 kPa,阶段 2 为 21 kPa,后运行时间120 s[17−18]。
1.6 生态风险评价方法
1.6.1 池塘水体生态风险评价
根据国内外学者研究实际情况与生态风险评价方法,本文参考 KALF 等[19]和 TONGO 等[20]的研究,采用风险商法(商值法)进行生态风险评价,该方法具有可操作性强和结论明确的特点[21]。
16种PAHs总的风险商值公式如下:
式中:RQ为风险商值;CPAHs为水体中某PAHs 单体浓度,ng·L−1;CQV为水体中某 PAHs 单体的风险标准值,ng·L−1;CQV(NCs)为最低风险标准值,ng·L−1;CQV(MPCs)为最高风险标准值,ng·L−1;RQNCs为最低风险商值;RQMPCs为最高风险商值。生态风险等级划分见表2。
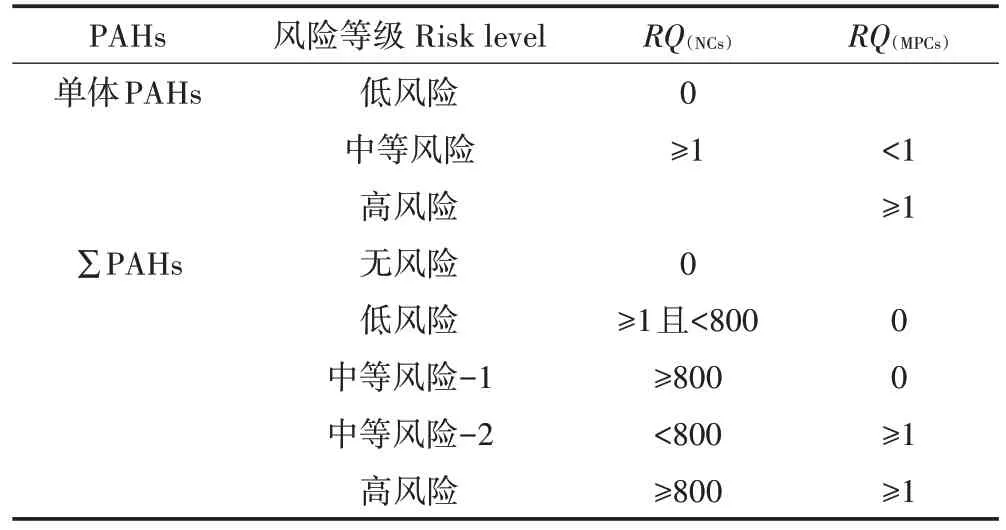
表2 单体PAHs和∑PAHs生态风险等级划分Table 2 Risk classification of individual of PAHs and total PAHs
1.6.2 底泥生态风险评价
采用沉积物质量基准法(SQGs)对底泥中PAHs生态风险开展评价。根据LONG等[22]和张嘉雯等[23]提出的沉积物中有机污染物潜在生态风险效应区间低值(Effects range low,ERL)和效应区间中值(Effects range median,ERM),当污染物含量小于ERL时,对生物毒副作用不显著(风险几率<10%);当污染物含量大于ERM 时,对生物会产生毒副作用(风险几率>50%),可能会产生一定的负面生态效应;当污染物含量在ERL 与ERM 之间时(风险几率介于10%~50%),偶尔会产生负面生态效应[23−24]。
1.7 斑点叉尾鮰消费健康风险评价
采用美国环保局(USEPA)推荐的终生致癌风险(Incremental life time cancer risk,ILCR)模型评价斑点叉尾鮰消费健康风险[25]。
式中:n=16;Ci为 PAHs 组分i在斑点叉尾鮰样品中的浓度,ng·kg−1;TEFi为组分i的BaP 毒性当量因子(表3);ILCR为PAHs 在某剂量下的人群终生致癌风险;TEQBaP为 PAHs 相 对 于 BaP 的 等 效 致 癌 毒 性 ,ng·kg−1;DR为每日的摄入量,根据江苏省统计局 2019统计年鉴[26]中的鱼类日均消费量及中国渔业统计年鉴[16]中的斑点叉尾鮰产量、鱼类产量,估算取值为 1.92×10−3kg·d−1,SF为 BaP 的致癌风险系数经口暴露数值,7.3 kg·d−1·mg−1;CF为转换系数,10−6mg·ng−1;EF为每年暴露天数,取值为 365 d;BW为成人人均体质量,kg,取值为 61.5 kg[27];AT为人群的预期寿命,a,根据国家统计局数据[28]取值为76 a;ED为暴露年数,非致癌物取30 a,致癌物取70 a;AT为人的预期寿命,对于非致癌物取30 a(10 950 d),对于致癌物取70 a(25 550 d)。

表3 PAHs的BaP等效因子Table 3 Toxic equivalent factors(TEFs)of PAHs
1.8 数据处理及制图
使用Excel 2007、Origin 2018、ArcGIS 10.7 进行数据处理和制图。
2 结果与讨论
2.1 典型养殖池塘中斑点叉尾鮰、池塘水体、底泥PAHs的含量及特征
本文对5 个主养殖区进行了16 种PAHs 组分检测,总检出率为100%,在鱼体、养殖水体、底泥中,PAHs 单体 Nap、Phe、BaA、Pyr、Chr、Flu、Ace 为常见检出物,其中Phe 在各组别中均有检出,检出率达100%,Nap 达到80%以上。菲是主要的污染物,但致癌性物质苯并[a]芘均未检出。从不同组别来看,5个典型养殖区养殖环境均远离工业区及城市主要生活区,鱼体、水体、池塘底泥总PAHs 含量无明显差异(表4)。
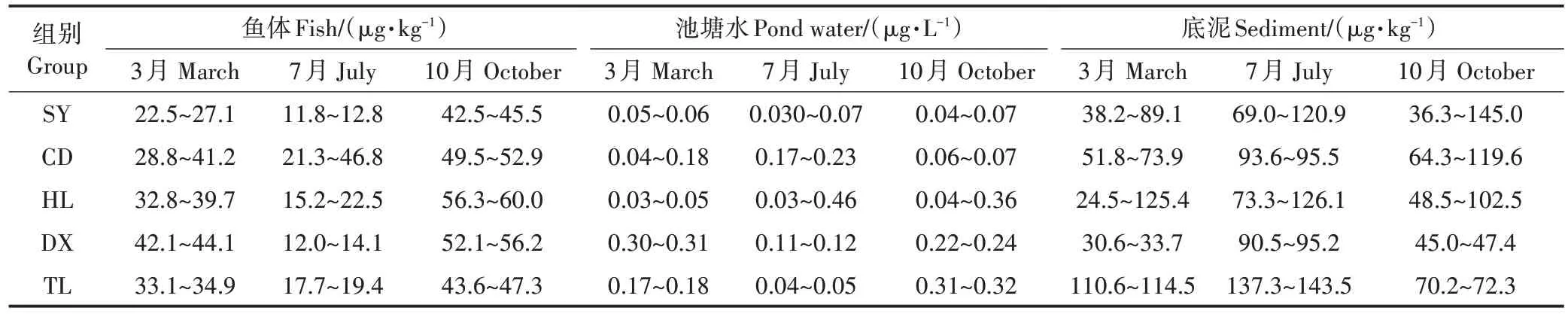
表4 各养殖区典型池塘中斑点Ictalurus punctatus叉尾鮰、池塘水体、底泥中16种PAHs含量Table 4 Concentrations of 16 species PAHs in Ictalurus punctatus pond water,sediment of different aquaculture areas
鱼体中总 PAHs 含量范围在 11.8~60.0 µg·kg−1(以湿质量计,下同),整体来说,养殖区斑点叉尾鮰PAHs 含量较低,受污染程度较轻。不同鱼品种的富集能力不同,长江下游江段7 种不同鱼体含量43.4~113.1 µg·kg−1[13],其同一流域鳜鱼、鲤鱼含量分别为43.42、67.70 µg·kg−1。
池塘养殖水总PAHs 含量范围在0.03~0.46 µg·L−1,同为江苏水域的太湖流域 1 月、7 月地表水中总PAHs 的浓度均值分别为 1.380、0.054 µg·L−1[29],长江流域含量为 0.033 µg·L−1[30],与本研究结果具有一致性。环境中大多数PAHs 与人为来源排放有关,与水域、地域具有很强关联性,七大流域水系中,珠江流域高于长江流域[30]。谢文平等[10]调查的广东地区罗非鱼养殖水体PAHs 含量平均值为0.27 µg·L−1,范围为0.053~0.680 µg·L−1,鱼体含量为 36.53~143.44 µg·kg−1,水体、鱼体含量较本研究含量略高。
池塘底泥总 PAHs 含量在 24.48~145.04 µg·kg−1(以干质量计,下同),根据欧盟规定,土壤中总PAHs的浓度小于200 µg·kg−1为未污染,200~600 µg·kg−1为轻度污染[31],可见养殖区底泥污染程度属于未污染。淮河干流沉积物中PAHs 平均含量为143.30 µg·kg−1[32],骆马湖表层沉积物总量范围在189.2~725.9µg·kg−1,处于低−中等污染水平[33]。马万里[34]研究表明,总体上我国土壤PAHs污染程度较轻。
进一步分析单体PAHs,如Nap 主要源于原油及原煤的燃烧[35],Pyr、Phe、Fla 可作为煤炭燃烧指示物[36],表明环境中存在原油、煤炭等污染来源。因此,从单体来源上可推测养殖区PAHs 污染来源主要为石油、煤炭燃烧。
2.2 养殖池塘中斑点叉尾鮰、池塘水体、底泥PAHs结构组成特征
根据PAHs 结构差异,可以将PAHs 分为低环(2~3 环)、中环(4 环)、高环(5~6 环)。对5 个主要养殖区PAHs 结构进行分析,发现斑点叉尾鮰鱼体、养殖水体以2~4 环为主要成分,5 环以上未检出(低于检出限)。其中水体中低环PAHs 含量高于高环;底泥结构较为复杂,以3~4 环为优势组分,底泥中低环PAHs 与高环PAHs 含量比值较水体中低(图2)。
由于PAHs 在鱼体内累积程度与其水环境中的背景浓度相一致[37],鱼体和水体在PAHs 结构上也具有相似性,以中低环为主。汪红军等[5]调查了汉江下游水样及相应江段典型鱼鱼体,发现PAHs 结构组成呈现以低中环为主、高环最低的规律,秦宁等[9]对巢湖水体的研究也得出巢湖水体PAHs 以低环和中环为主的结论。
养殖区池塘水体与底泥PAHs 结构不同,分析发现底泥PAHs结构更为复杂,以3~4环作为优势组分,且底泥中低环PAHs 与高环PAHs 含量比值较水体中低。底泥结构不同可能是因为水体低环PAHs 的产生来源比高环PAHs 广泛,且高环PAHs 的疏水性较强,与之相比,低环PAHs 在水体中的溶解度较高,最终导致水体中低环PAHs 浓度较高[38−39]。而底泥中低环PAHs 与高环PAHs 含量比值较水体中低,是因为高环PAHs 在水中的溶解度较小,促使高环PAHs 从水相中分配到生物体内或底泥中,且微生物只能利用吸收底泥液相中的有机物,而难以利用固相中的有机物,这造成4 环或4 环以上的PAHs 难以被生物降解而在底泥中累积[39],从而呈现低环浓度较低的结果。
通常认为不同分子量PAHs 的相对丰度可以反映其来源[37],一般4 环以下的低分子量PAHs 主要来源于石油类污染及木材、煤等在低至中温范围内的燃烧,4 环以上高分子量的PAHs 主要来源于化石燃料的高温燃烧,从环数结构上进一步验证了本文养殖区PAHs污染来源主要是石油类污染及木材、煤低、中温燃烧[38]。
2.3 风险评价
2.3.1 水体生态风险评价
据PAHs 的风险等级划分(表2),结合养殖区池塘水体PAHs 的RQ值(表5)发现,主要养殖区池塘水体总PAHs最高风险标准值(RQMPCs)为0,最低风险浓度风险商值(RQMPCs)小于800,表明生态风险为低风险程度,各单体产生的生态风险均未达到严重生态风险水平。其中Nap、Phe 以及部分池塘中Ace、Pyr、Fla的RQNCs大于1,而RQMPCs小于1,说明这些单体PAHs处于中等风险水平,需要进一步研究相应控制和修复措施;其余单体PAHs 的RQNCs小于1,对生态系统的影响可以忽略。江苏主要水域中,太湖流域地表水中PAHs 造成的生态风险较小[29];长江中下游支流水体中未发现生态系统风险,除DahA 单体外,其余单体PAHs 造成的污染可列为中等水平[40]。郭广慧等[41]研究了中国七大流域地表水系,也得出了部分如单体Bap、Ant、Flua和Pyr对水生生物具有潜在的生态风险的结论。因此从长期的环境暴露角度出发,应采取一定的控制措施,以降低PAHs的生态风险。

表5 主要养殖区池塘水体PAHs的RQNCS和RQMPCsTable 5 RQNCs and RQMPCs of PAHs in ponds of main aquaculture area
2.3.2 表面沉积物生态风险评价
采用效应区间低、中值法(ERL/ERM)对各个主要养殖区池塘表面沉积物中PAHs 进行生态风险评价。据表6 中风险评价标准得出沉积物中生态风险值可知,各个主要养殖区各单体PAHs 和PAHs 总量最高值都低于ERL,总体上表明PAHs 对生物毒副作用不显著(风险几率<10%)。分析斑点叉尾鮰5 个主要养殖区的数据,整体上PAHs 均有检出,检出率为100%,以Nap、Pyr、Phe、Fla等单体PAHs在池塘底泥环境中检出率较高,经过计算,发现单体PAHs的生态风险值较小,但环境中长期存在的PAHs 仍然可能会对生物产生毒副作用。查阅江苏相关流域沉积物资料,发现太湖总体不存在严重的PAHs 生态风险,局部点位芴、菲可能具有一定的生态风险[42];淮河干流沉积物中PAHs平均含量远低于潜在生态风险的效应区间低值ERL(风险几率<10%),极少产生负面效应[32],与本文结果一致。

表6 主要养殖区池塘表面沉积物中PAHs生态风险评价(µg·kg−1)Table 6 Ecological risk assessment of PAHs in surface sediments of ponds in main aquaculture areas(µg·kg−1)
2.3.3 斑点叉尾鮰健康风险评价
根据USEPA 规定,可接受的致癌风险为小于10−6a−1,风险大于 10−4a−1则被认为具有较高的风险性。ILCR 模型计算结果显示,成人的PAHs终生致癌风险范围为2.25×10−9~5.80×10−7a−1(表7),说明主要养殖区斑点叉尾鮰样品的致癌风险远小于可接受水平,处于致癌风险控制水平。从组别上分析,5 个斑点叉尾鮰养殖区中,SY组、CD组相对其余3个养殖区致癌风险更小,整体上各组别差异较小。汉江下游鱼类食用健风险水平在8.00×10−7~2.08×10−6a−1,有潜在风险[4];广东罗非鱼主要养殖区罗非鱼肌肉中8 种非致癌PAHs的总非致癌风险为2.51×10−10~1.54×10−9a−1,6种致癌PAHs 造成个人年致癌风险值范围为2.87×10−6~1.56×10−5a−1[10]。这一方面表明江苏主要养殖区食用斑点叉尾鮰健康风险水平较小,另一方面也说明各地方食用鱼的健康风险水平也有差异,可能是由于鱼类食性、年龄、个体大小等存在差异,导致不同鱼对PAHs的富集因子也不同[5]。

表7 各养殖区PAHs基于BaP的毒性当量和终生致癌风险Table 7 Toxic equivalence and lifelong carcinogenic risk of PAHs based on BaP in main aquaculture areas
健康风险评价的一个重要特征是在整个评价过程中的每一步都存在着一定的不确定性[2]。本文主要讨论了从生长阶段到成鱼阶段的成人可食用健康风险,而没有考虑个体对污染物的吸收和利用能力,如果想要更加准确地估计健康风险,还需要考虑人群生理因子参数、人群行为因子参数、易感程度等。因此,本研究评价结果具有不确定性[2]。
3 结论
(1)16 种 PAHs 组分在 5 个主要养殖区的总检出率为100%,PAHs 单体在鱼体、养殖水体、底泥中,Nap、Phe、BaA、Pyr、Chr、Flu、Ace 为常见检出物,其中Phe 检出率达100%,Nap 达到80%以上。鱼体中总PAHs含量范围在11.75~60.02 µg·kg−1,池塘养殖水含量范围在0.03~0.46 µg·L−1,底泥含量在24.48~145.04µg·kg−1。PAHs 结构组成上,斑点叉尾鮰、养殖水体以2~4 环为主要成分,底泥结构较为复杂,以3~4 环为优势组分。5 个斑点叉尾鮰养殖区含量差别较小,未发现明显差异性。
(2)养殖水体中PAHs 生态风险程度为低风险,Nap、Phe 及部分池塘中Ace、Pyr、Fla 处于中等风险水平,其余单体对生态系统的影响可以忽略。池塘底泥环境中,各单体PAHs 和PAHs 总量最高值都低于潜在生态风险效应区间低值,PAHs 对生物毒副作用不显著。但 Nap、Pyr、Phe、Fla 等单体 PAHs 在池塘底泥环境中有检出,还需加以重视,加强监测与防控。
(3)斑点叉尾鮰食用健康风险评价结果表明,成人的终生致癌风险范围为2.25×10−9~5.80×10−7a−1,养殖区斑点叉尾鮰样品的致癌风险远小于最大可接受水平,处于致癌风险控制水平。
