不同有机肥施用量对反季节莲雾园区土壤细菌群落的影响
2021-11-08吴斌黄东梅马伏宁王必尊宋顺何应对王丽霞刘永霞
吴斌 黄东梅 马伏宁 王必尊 宋顺 何应对 王丽霞 刘永霞
摘 要:以海南蓮雾(Syzygium samarangense)为研究对象,采用Illumina MiSeq高通量测序技术,比较分析不同有机肥施用量对反季节莲雾园区土壤细菌群落多样性的影响。结果表明:(1)共检测到741 391条有效序列,32 778个OTU(operational taxonomic unit,操作分类单元),包含28门分类和418个属分类,其中酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)和变形菌门(Proteobacteria)为优势群落;(2)土壤细菌群落多样性和丰富度顺序为BML(香蕉茎秆有机菌肥,低浓度,2 kg/株)=GML(羊粪有机肥,低浓度,2 kg/株)>GMM(羊粪有机肥,中浓度,4 kg/株)=BMH(香蕉茎秆有机菌肥,高浓度,6 kg/株)>CK(对照)>GMH(羊粪有机肥,高浓度,6 kg/株)=BMM(香蕉茎秆有机菌肥,中浓度,4 kg/株);(3)线性判别分析(linear discriminant analysis effect size, LEfSe)发现不同施肥处理组(CK处理组、GM处理组、BM处理组)中有37个显著差异的物种(5个纲,7个目,9个科,8个属,8个种),与维恩图的分析结果一致,即不同浓度的羊粪有机肥和香蕉茎秆有机菌肥处理下的细菌群落结构具有一定的相似性和差异性。研究表明,施用低浓度的羊粪有机肥和香蕉茎秆有机菌肥时,土壤细菌群落结构的多样性显著高于其他处理。因此,莲雾反季节催花时,施用低浓度的有机肥不仅有利于提高土壤细菌群落的多样性和稳定性,同时还可以减少有机肥施用量,达到精准施肥的目的。
关键词:莲雾;反季节催花;有机肥;细菌群落;Illumina MiSeq
中图分类号:Q939.96 文献标识码:A
Effects of Different Organic Fertilizer Rates on the Bacterial Community of Off-season Syzygium samarangense Park Soil
WU Bin, HUANG Dongmei, MA Funing, WANG Bizun, SONG Shun, HE Yingdui, WANG Lixia,
LIU Yongxia*
Haikou Expenmental Station (Insttute of Tropical Fruit Tree Research), Chinese Academy of Tropical Agnicultural Sciences / Hainan Key Laboratory of Banana Genetic Improvement, Haikou, Hainan 571101, China
Abstract: The effects of different organic fertilizer rates on the bacterial community diversity of soil in the off-season Syzygium samarangense plantation were analyzed using the Illumina MiSeq high-throughput sequencing technology. 741 391 effective sequences and 32 778 operational taxonomic units (OTU) were detected, including 28 phyla and 418 genera. Acidobacteria, Chloroflexi and Proteobacteria were the dominant soil bacterial communities under different fertilizers in S. samarangense plantation. The order of the soil bacterial communities diversity and richness was the BML (organic fungi-manure for banana stalks, low concentration, 2 kg per plant) = the GML (organic manure of sheep manure, low concentration, 2 kg per plant) > the GMM (organic manure of sheep manure, medium concentration, 4 kg per plant) = the BMH (organic fungi-manure for banana stalks, high concentration, 6 kg per plant) > the CK (Control) > the GMH (organic manure of sheep manure, high concentration, 6 kg per plant) = the BMM (organic fungi-manure for banana stalks, medium concentration, 4 kg per plant). 37 significantly different species (5 classes, 7 orders, 9 families, 8 genera and 8 species) in the different fertilization treatment (CK treatment group, GM treatment group, BM treatment group) were found using the linear discriminant analysis effect size (LEfSe) analysis, which was consistent with the results from Venn, i.e.. The soil bacterial community structure was similar, but still had some differences under different concentrations of organic manure treatments. Moreover, the soil bacterial community diversity under low concentration of sheep and banana stalk manures was significantly higher than those of the other treatments. It indicates that low concentration of organic fertilizer could not only improve the soil bacteria diversity and soil bacterial community structure stability, but also save fertilizer use.
Keywords: Syzygium samarangense; promoting flowers of counter-season; organic fertilizer; soil bacterial community; Illumina MiSeq
DOI: 10.3969/j.issn.1000-2561.2021.09.039
莲雾(Syzygium samarangense),又称洋蒲桃,属桃金娘科乔木,是著名的热带水果之一。莲雾全年枝叶繁多,叶片凋落到地面形成较好的有机质来源,丰富了细菌群落的孕育。据不完全统计,自然环境下土壤微生物中的细菌群落可达106~ 109个/g,约占70%以上,由于细菌群落的大量存在,因此在维持土壤微生态中发挥着主要的作用[1-3]。细菌群落的多样性和丰富度的增加,不仅有助于维持土壤微生态的稳定性[4-6],同时还促进植物对营养元素的吸收。莲雾在进行反季节催花时,为了提升产量和品质,通常以施用有机肥为主。但频繁、过量施用有机肥会破坏土壤细菌群落的平衡[7-8]。因此,为了科学施用有机肥,达到精准施肥、提質增效的目的,开展不同类型有机肥及其施用浓度对莲雾园区土壤细菌群落结构影响的研究具有重要意义。
目前,涉及细菌群落多样性研究的主要方法是传统培养方法与分子技术。由于自然界中超过99%的细菌无法进行人工培养或人工培养难以成活[9-10],因此,基于传统培养方法进行研究存在一定的局限性[11-13]。分子技术方法发展至今,对土壤细菌群落的多样性进行研究分别有变性梯度凝胶电泳(PCR-DGGE)、末端限制性长度多态性(T-RFLP)、Sanger测序和焦磷酸测序等技术手段[14-15]。由于Illumina MiSeq高通量测序技术对数据量的测序深度较高,相对于其他分子方法能够较全面地解析土壤细菌群落的情况。因此,本文基于Illumina MiSeq高通量测序技术,分析不同有机肥施用量对莲雾园区土壤细菌群落多样性的影响,为合理科学施用有机肥提供数据支持。
1 材料与方法
1.1 试验处理
选取长势一致的莲雾,即将开展反季节催花时,进行如下处理:CK(不进行任何处理)、GML(羊粪有机肥,低浓度,2 kg/株)、GMM(羊粪有机肥,中浓度,4 kg/株)、GMH(羊粪有机肥,高浓度,6 kg/株)、BML(香蕉茎秆有机菌肥,低浓度,2 kg/株)、BMM(香蕉茎秆有机菌肥,中浓度,4 kg/株)、BMH(香蕉茎秆有机菌肥,高浓度,6 kg/株)。其中,羊粪有机肥中有机质≥35%,香蕉茎秆有机菌肥中N+P2O5+K2O≥5%、有机质≥45%、菌剂∶香蕉茎秆有机肥=1∶20。
1.2 样品采集
选取植株冠幅下距主干70~80 cm、深度10~15 cm处的土层进行样品采集,每个处理随机采集3~4个土样,开展微生物总DNA的提取和土壤理化性质测定。
1.3 土壤理化性质测定
参照《土壤理化分析与剖面描述》进行全氮(TN)、速效磷、速效钾、有机质、pH等土壤理化性质的测定[16]。
1.4 样品总DNA提取
采用Power Soil? DNA Isolation Kit (MOBIO, USA)试剂盒,参照试剂盒使用说明书进行土壤微生物总DNA的提取和定性定量检测。
1.5 PCR扩增及高通量测序
根据细菌16S rRNA V3-V4区保守序列合成338F/806R引物,以土壤微生物总DNA为模板,进行PCR扩增并回收PCR产物。委托上海美吉生物医药科技有限公司进行Illumina MiSeq高通量测序。
1.6 数据处理
采用Excel 2016软件进行前期处理,采用IBM SPSS Statistics 22软件进行多组样本间差异显著性分析(Duncan法)。采用QIIME进行OTU分析[17],采用Mothur和UniFrac进行α多样性分析[18-19]和β多样性分析[20],采用R语言等软件进行维恩图、热图和群落结构组分图等分析。
2 结果与分析
2.1 莲雾园区土壤理化性质
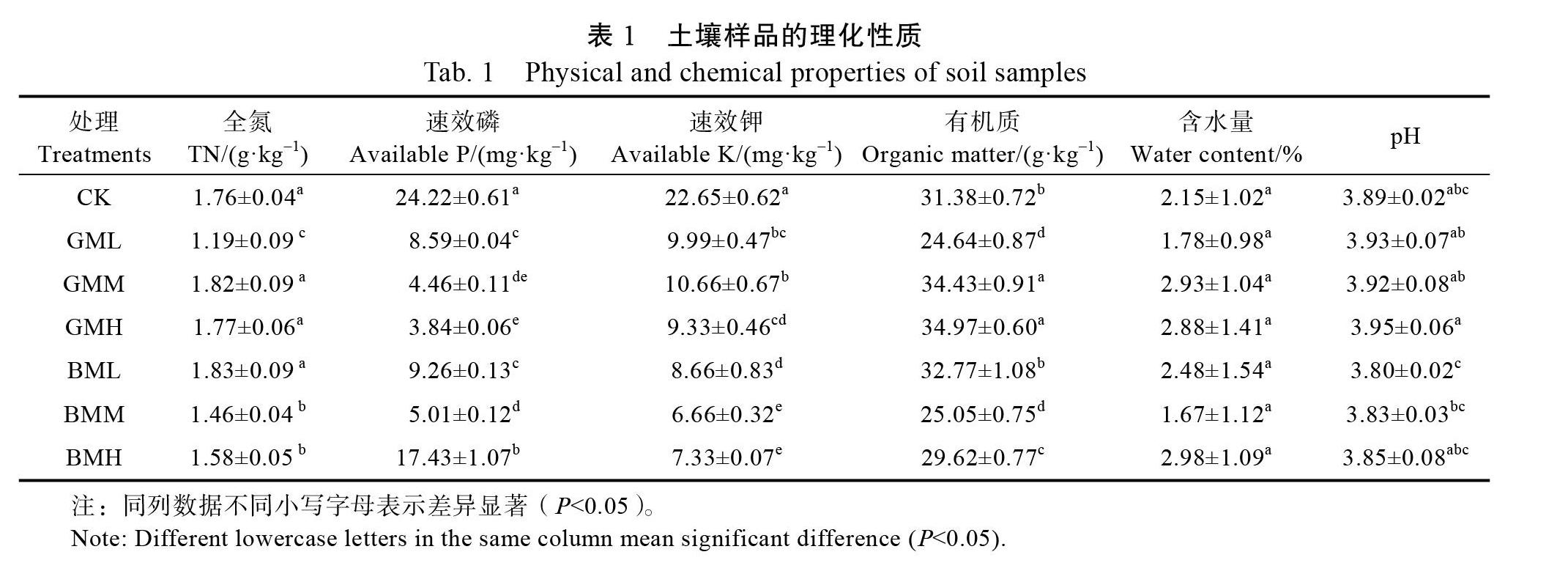
由表1可知,不同施肥处理下的莲雾园区土壤,除含水量不存在显著性差异外,全氮(TN)、速效磷、速效钾、有机质含量及pH均存在显著差异(P<0.05)。此外,不同类型和浓度的施肥处理可使土壤中速效磷和速效钾的浓度显著低于对照(P<0.05)。
2.2 莲雾园区土壤细菌群落OTU及多样性分析
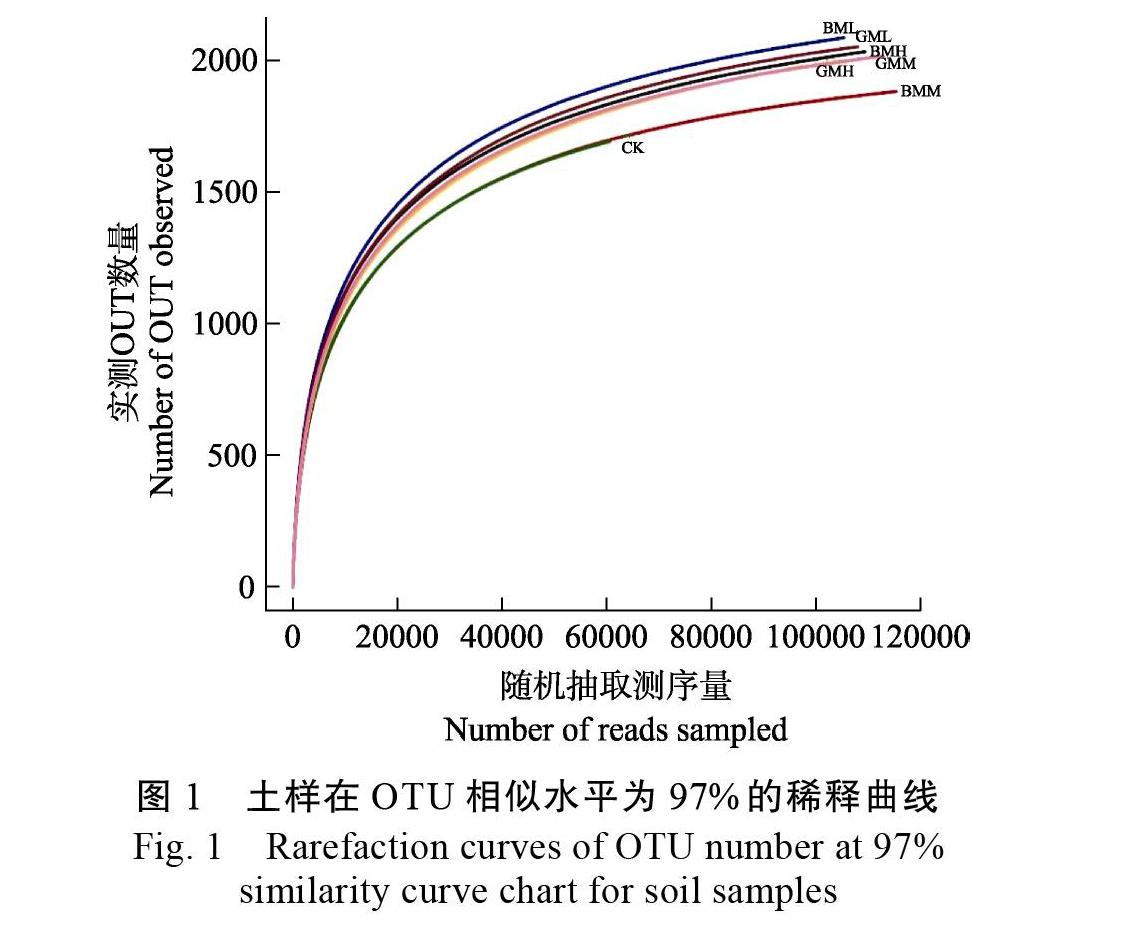
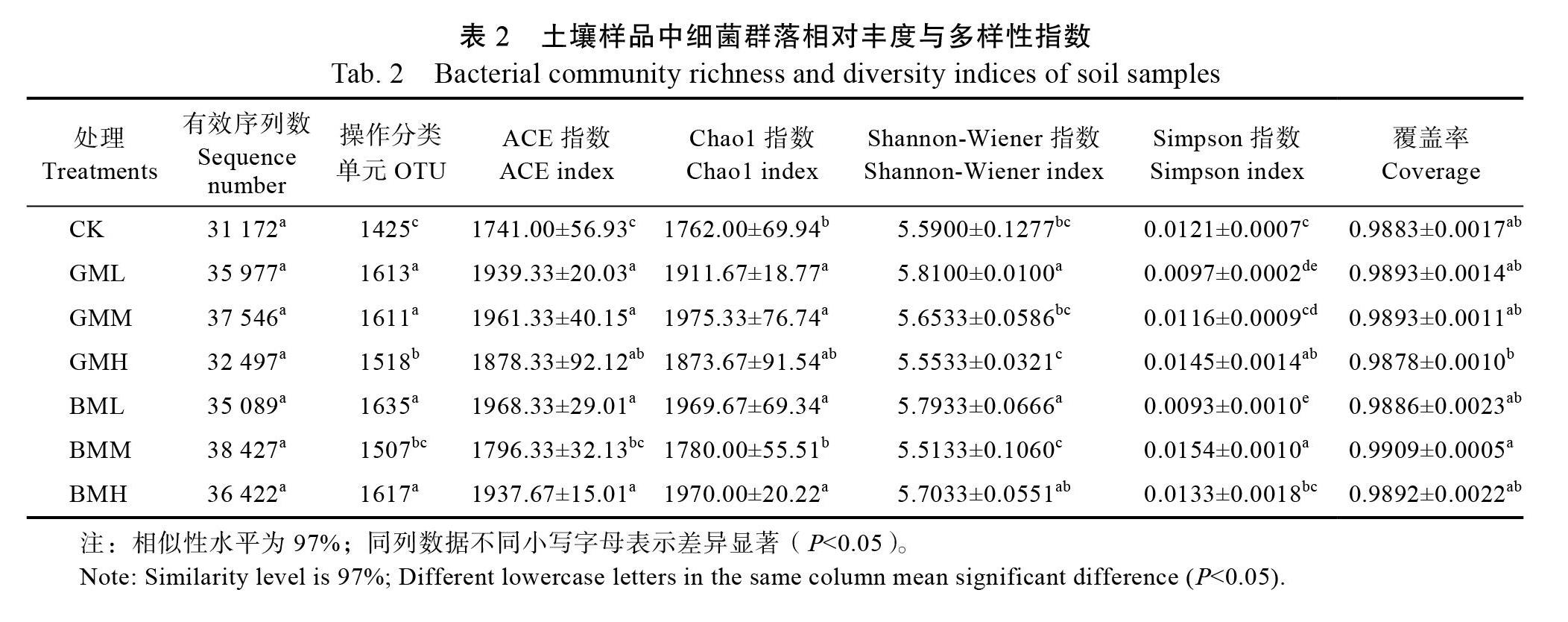
基于Illumina MiSeq测序平台进行高通量测序,共获得741 391条有效序列;聚类分析获得32 778个OTU(表2)。分析不同施肥处理样品获得的稀释曲线亦表明各个样品的测序深度较高,稀释曲线趋近于平坦(图1),测序结果已具有代表性[21],可进行下一步分析。
基于分析表征细菌丰富度的ACE指数、Chao1指数,以及指示细菌多样性的Shannon- Wiener和Simpson指数可知,在羊粪有机肥GML和GMM处理后的土壤细菌群落多样性和丰富度均高于对照,其中GML(低浓度羊粪有机肥)处理后细菌群落丰富度最高,但GMH处理低于对照;在香蕉茎秆有机菌肥处理下,虽然BML(低浓度香蕉茎秆有机菌肥)处理后细菌群落丰富度最高,与羊粪有机肥处理结果相似,但细菌群落丰富度最低的表现为BMM,且低于对照。
综上所述,不同施肥处理下莲雾园区土壤细菌群落多样性和丰富度大小顺序为:BML= GML>GMM=BMH>CK>GMH=BMM。由于BML和GML两种处理均无显著性差异,无法比较出BML和GML处理对莲雾根际土壤细菌群落多样性的影响程度。从整体上看,在低浓度(2 kg/株)处理下,羊粪有机肥和香蕉茎秆有机菌肥对莲雾园区土壤细菌群落的影响显著高于其他处理。
2.3 莲雾园区土壤细菌群落结构组成分析
通过Silva数据库比对发现,样品中的细菌群落包含28門分类(图2A),所有土壤样品中细菌群落结构的组成存在一定的相似性。其中,酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)和变形菌门(Proteobacteria)占比最高,以上3种细菌群落约占土壤总细菌群落的73.47%~81.03%,在莲雾园区细菌群落结构中起着主要作用。与对照相比,GML、GMM、GMH、BML和BMH处理下,酸杆菌门占比最高,分别为33.22%、35.46%、32.25%、27.54%和33.48%,而在对照和BMM处理中,变形菌门占比最高,分别为27.30%和27.89%。酸杆菌门群落的大量存在与莲雾园区偏酸性的砖红壤类型密切相关[22]。由于不同施肥方式及其不同浓度处理导致土壤理化性质发生改变,对土壤各个优势菌群的影响存在一定的差异(如BMM)。
为进一步细化分析细菌群落结构间的差异,在属分类学水平上开展分析,共检测出418个属(如图2B)。除GML处理外,在其余的6个处理中(含CK),绿弯菌门下的一个分属JG37-AG-4所占比例最高,其中CK、GMM、GMH、BML、BMM、BMH处理的占比分别为13.00%、12.36%、15.89%、9.50%、16.21%、14.30%。而在GML处理中,优势菌属为酸杆菌门下的一个分属Subgroup_2,其占比为11.57%。
由不同施肥处理的土壤细菌OTU维恩图(图3)可知,3种施肥处理类型,细菌OTU总量为2443个,而共有OTU为1719个,占比70.4%;CK、GM和BM处理特有的OTU数量分别为20、67和80个,占比分别为0.8%、2.7%和3.3%。表明不同浓度羊粪有机肥和香蕉茎秆有机菌肥处理莲雾园区土壤细菌群落结构具有一定的相似性和差异性。
2.4 莲雾园区土壤细菌群落空间差异物种(Biomarker)分析
根据不同施肥处理下,莲雾园区土壤细菌群落的组间差异物种(Biomarker)进行LEfSe分析,将LDA的阈值设定为3.5,发现不同处理组间(CK处理组、GM处理组、BM处理组)的差异显著菌群(图4),并对不同差异的群落物种进行门、纲、目、科、属、种的分支情况展开分析(图5)。发现不同施肥处理组中共存在37个显著差异的物种,其中CK处理组中具有显著性差异的物种最多(20个种群:2个纲,3个目,6个科,4个属,5个种),其次为GM处理组(11个种群:2个纲,3个目,2个科,2个属,2个种),最后是BM处理组(6个种群:1个纲,1个目,1个科,2个属,1个种)。
3 讨论
反季节莲雾不仅可以满足消费市场的需求,还可以增加果农的经济收入,显著提高果农的经济效益。莲雾在进行反季节催花调控时,为了提高产量和品质,降低反季节生产对植株的损伤,需要施用催花肥,促进植株生长。催花肥的施用量或施用类型都会改变土壤理化性质,从而对莲雾园区土壤细菌群落多样性产生影响[8]。目前,莲雾催花肥的施用类型中,主要有无机肥、有机肥、微生物菌肥等。本文对施用羊粪有机肥和添加无机肥、菌剂的香蕉茎秆有机菌肥的莲雾园区土壤细菌群落进行分析,发现不同施肥处理对土壤理化指标的影响存在显著差异。
细菌群落的丰度和多样性对土壤微环境的稳定性起着不可或缺的作用。人工施肥或添加外源菌剂等方式致使外界因素发生变化时,土壤细菌群落会随之发生变化[23-26]。本文基于Illumina MiSeq高通量测序技术,分析羊粪有机肥和香蕉茎秆有机菌肥对莲雾园区土壤细菌群落多样性的影响,发现表征土壤细菌丰富度的ACE、Chao1指数,以及指示细菌多样性的Shannon-Wiener和Simpson多样性指数大小顺序为BML=GML> GMM=BMH>CK>GMH=BMM。同时与对照相比,发现土壤细菌群落会随着施肥类型和浓度的变化而发生显著性变化,与前人研究结果相一致[27-28]。无论是羊粪有机肥还是香蕉茎秆有机菌肥,低浓度(2 kg/株)施用时,土壤细菌群落的多样性显著高于同类型肥料的其他处理浓度,但在低浓度处理下的2种肥料之间无显著差异。从多样性和丰富度的角度分析,施用低浓度(2 kg/株)的有机肥(含羊粪有机肥和香蕉茎秆有机菌肥)有利于提高土壤细菌群落的稳定性,与前人研究结果大致一致[29-30]。
门分类水平分析表明,酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)和变形菌门(Proteobacteria)是不同施肥处理莲雾园区土壤中的优势菌门,与前期研究结果大致相同[31]。其中,酸杆菌门(Acidobacteria)占比最大,与试验地区砖红壤的酸碱度存在一定的相关性,酸杆菌门在土壤生态循环中具有重要作用[32]。绿弯菌门(Chloroflexi)细菌是一种含有绿色色素的细菌门类,其丰富度与土壤的保水性和植株的生物量存在显著正相关[33-34]。变形菌门(Proteobacteria)是细菌中最大的一门,包括病原菌和固氮菌等。属分类水平分析表明,在BML、GMM、BMH、CK、GMH、BMM等6个处理中,绿弯菌门下的一个分属JG37-AG-4所占比例最高,而在GML处理中,优势菌属为酸杆菌门下的一个分属Subgroup_2占比最大。表明不同施肥类型和施肥浓度处理下的莲雾园区土壤细菌群落结构存在一定的相似性和差异性。基于LEfSe分析,对照组(CK组)、羊粪有机肥处理组(GM组)和香蕉茎秆有机菌肥处理组(BM组)中,共检测到37个具有显著差异的物种,其中CK组20个,GM组11个,BM组6个。表明不同类型施肥处理形成了不同施肥特有的细菌组成,这一结果与维恩图分析结果相一致。
参考文献
[1] 闫 冰, 齐 月, 付 刚, 等. 莠去津对野生植物群落下土壤微生物功能多样性的影响[J]. 环境科学研究, 2017, 30(8): 1246-1254.
[2] Richard D B, Chris F, Nicholas J O. Microbial contributions to climate change through carbon cycle feedbacks[J]. The ISME Journal, 2008, 2(8): 805-814.
[3] Bryan S G, Laurent P. Insights into the resistance and resilience of the soil microbial community[J]. FEMS Microbiology Reviews, 2013, 37(2): 112-129.
[4] Campbell V, Murphy G, Romanuk T N. Experimental design and the outcome and interpretation of diversity-stability relations[J]. Oikos, 2011, 120(3): 399-408.
[5] Jiang L, Pu Z C. Different effects of species diversity on temporal stability in single-trophic and multitrophic communities[J]. American Naturalist, 2009, 174(5): 651-659.
[6] Konopka A. What is microbial community ecology?[J]. The ISME Journal, 2009, 3(11): 1223-1230.
[7] 庞凤梅. 有机无机肥料配施对麦田土壤氨挥发和硝态氮含量的影响[D]. 北京: 中国农业科学院, 2008.
[8] 闫 晗, 吴祥云, 黄 静, 等. 评价土壤质量的微生物指标及其研究方法[J]. 山西农业科学, 2010, 38(10): 78-81.
[9] 李國庆, 郭华春. 连作对马铃薯根际土壤细菌群落结构的影响[J]. 分子植物育种, 2014, 12(5): 914-928.
[10] Prosser J I. Molecular and functional diversity in soil micro-organisms[J]. Plant Soil, 2002, 244(1/2): 9-17.
[11] Mori H, Maruyama F, Kato H, et al. Design and experimental application of a novel non-degenerate universal primer set that amplifies prokaryotic 16S rRNA genes with a low possibility to amplify eukaryotic rRNA genes[J]. DNA Research, 2014, 21(2): 217-227.
[12] 楼 骏, 柳 勇, 李 延. 高通量测序技术在土壤微生物多样性研究中的研究进展[J]. 中国农学通报, 2014, 30(15): 256-260.
[13] Poisot T, Péquin B, Gravel D. High-throughput sequencing: A roadmap toward community ecology[J]. Ecology and Evolution, 2013, 3(4): 1125-1139.
[14] Sun H Y, Deng S P, Raun W R. Bacterial community structure and diversity in a century-old manure-treated agroecosystem[J]. Applied & Environmental Microbiology, 2004, 70(10): 5868-5874.
[15] Hamm A. Bacterial Community Ecology and Fate in Integrated Livestock Production Systems[D]. Winnipeg: University of Manitoba, 2014.
[16] 孙鸿烈, 刘光崧. 土壤理化分析与剖面描述[M]. 北京: 中国标准出版社, 1996: 9-41.
[17] Caporaso J G, Kuczynski J, Stombaugh J, et al. QIIME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335-336.
[18] Schloss P D, Gevers D, Westcott S L. Reducing the effects of PCR amplification and sequencing artifacts on 16S rRNA- based studies[J]. PLoS One, 2011, 6(12): e27310.
[19] Schloss P D, Westcott S L, Ryabin T, et al. Introducing mothur: open-source, platform-independent, community- supported software for describing and comparing microbial communities[J]. Applied and Environmental Microbiology, 2009, 75(23): 7537-7541.
[20] Lozupone C, Lladser M E, Knights D, et al. UniFrac: An effective distance metric for microbial community comparison[J]. The ISME Journal, 2011, 5(2): 169-172.
[21] Hong C, Si Y, Xing Y, et al. IlluminaMiSeq sequencing investigation on the contrasting soil bacterial community structures in different iron mining areas[J]. Environmental Science and Pollution Research, 2015, 22(14): 10788- 10799.
[22] 海南省农业厅土肥站. 海南土壤[M]. 海口: 海南出版社, 1993: 12.
[23] Shen J P, Zhang L M, Guo J F, et al. Impact of long-term fertilization practices on the abundance and composition of soil bacterial communities in Northeast China[J]. Applied Soil Ecology, 2010, 46(1): 119-124.
[24] Chu H Y, Fierer N, Lauber C L, et al. Soil bacterial diversity in the Arctic is not fundamentally different from that found in other biomes[J]. Environmental Microbiology, 2010, 12(11): 2998-3006.
[25] Vasvi C, Ateequr R, Aradhana M, et al. Changes in bacterial community structure of agricultural land due to long-term organic and chemical amendments[J]. Microbial Ecology, 2012, 64(2): 450-460.
[26] Chandra S N, Puneet S C, Chittranjan R B. Changes in soil physico-chemical properties and microbial functional diversity due to 14 years of conversion of grassland to organic agriculture in semi-arid agroecosystem[J]. Soil and Tillage Research, 2010, 109(2): 55-60.
[27] 龐 欣, 张福锁, 王敬国. 不同供氮水平对根际微生物量氮及微生物活度的影响[J]. 植物营养与肥料学报, 2000, 6(4): 476-480.
[28] Debosz K, Rasmussen P H, Pedersen A R. Temporal variations in microbial biomass C and cellulolytic enzyme activity in arable soils: effects of organic matter input[J]. Applied Soil Ecology, 1999, 13(3): 209-218.
[29] 蔡燕飞, 廖宗文, 章家恩, 等. 生态有机肥对番茄青枯病及土壤微生物多样性的影响[J]. 应用生态学报, 2003, 14(3): 349-353.
[30] 李东坡, 武志杰, 陈利军. 有机农业施肥方式对土壤微生物活性的影响研究[J]. 中国生态农业学报, 2005, 13(2): 99-101.
[31] 吴 斌, 王必尊, 王丽霞, 等. 不同催花肥对莲雾根际土壤细菌群落多样性的影响[J]. 环境科学研究, 2018, 31(4): 732-741.
[32] 商丽荣, 万里强, 李向林. 有机肥对羊草草原土壤细菌群落多样性的影响[J]. 中国农业科学, 2020, 53(13): 2614-2624.
[33] Iino T, Mori K, Uchino Y, et al. Ignavibacterium album gen. nov., sp. nov., a moderately thermophilic anaerobic bacterium isolated from microbial mats at a terrestrial hot spring and proposal of Ignavibacteria classis nov., for a novel lineage at the periphery of green sulfur bacteria[J]. International Journal of Systematic and Evolutionary Microbiology, 2010, 60(6): 1376-1382.
[34] Podosokorskaya O, Kadnikov V, Gavrilov S N, et al. Characterization of Melioribacter roseus gen. nov., sp. nov., a novel facultatively anaerobic thermophilic cellulolytic bacterium from the class Ignavibacteria, and a proposal of a novel bacterial phylum Ignavibacteriae[J]. Environmental Microbiology, 2013, 15(6): 1759-1771.
責任编辑:谢龙莲
