椰子CnRADIALIS-like转录因子的克隆与表达分析
2021-11-08郭树宽曾春茹吴翼李静李新国杨耀东
郭树宽 曾春茹 吴翼 李静 李新国 杨耀东

摘 要:本研究依据前期已经完成的4个品种椰子外果皮转录组测序数据结果,筛选获得在4个品种椰子外果皮中表达水平显著差异的MYB类基因CnRADIALIS-like。从椰子(Cocos nucifera L.)外果皮中克隆获得CnRADIALIS-like,序列分析显示,CnRADIALIS-like基因的开放阅读框(ORF)长288 bp,编码95个氨基酸。结构域分析显示,CnRADIALIS-like含有1个典型的SANT/MYB结构域,属于MYB转录因子家族中的I-box-binding-MYB型。多序列比对发现,CnRADIALIS-like氨基酸序列与油棕MYB-RADIALIS(RAD)氨基酸序列相似度最高。理化性质、亲/疏水性和无序化分析显示,CnRADIALIS-like转录因子是亲水性蛋白且偏碱性,存在无序化区域。信号肽和跨膜结构域分析表明,其不存在信号肽和跨膜结构域。空间结构分析显示,CnRADIALIS-like有典型的α-螺旋结构。实时荧光定量PCR(qRT-PCR)显示,CnRADIALIS-like基因在4个品种椰子外果皮中的表达量存在显著差异,在红矮椰子中表达量最高,红矮椰子不同组织中在外果皮表达量最高。该基因的表达在红矮椰果从幼果至成熟果的3个发育阶段依次降低,套袋条件下表达量低于正常光照条件下,表明该基因可能与光形态下细胞发育及代谢产物合成存在相关作用。通过对该基因的生物信息功能进行分析,为深入研究其功能及作用机制提供参考,同时以期为深入剖析椰子的外果皮颜色形成机制提供重要的理论依据。
關键词:椰子;外果皮颜色;MYB家族;RAD蛋白
中图分类号:S667.4 文献标识码:A
Cloning and Expression Analysis of Coconut CnRADIALIS-like Transcription Factor
GUO Shukuan1,2,3, ZENG Chunru2,3, WU Yi2,3, LI Jing2,3, LI Xinguo, YANG Yaodong2,3*
1. College of Horticulture, Hainan University, Haikou, Hainan 570228, China; 2. Coconut Research Institute, Chinese Academy of Tropical Agricultural Sciences, Wenchang, Hainan 571339, China; 3. Hainan Provincial Key Laboratory of Tropical Oil Crops Biology, Wenchang, Hainan 571339, China
Abstract: Based on the results of the transcriptome sequencing data of the four coconut exocarps that have been completed previously, the expression levels of a MYB gene, CnRADIALIS-like, show significant difference in four coconut exocarps with different color. CnRADIALIS-like was cloned from coconut (Cocos nucifera L.) exocarp. Sequence analysis showed that the open reading frame (ORF) of CnRADIALIS-like was 288 bp long, encoding 95 amino acids. The domain analysis showed that CnRADIALIS-like contains a typical SANT/MYB domain, which belongs to the I-box-binding-MYB type in the MYB transcription factor family. Multi-sequence comparison found that the amino acid sequence of CnRADIALIS-like had the highest similarity with the amino acid sequence of oil palm MYB-RADIALIS (RAD). Physicochemical properties, affinity/hydrophobicity and disorder analysis showed that the CnRADIALIS-like transcription factor is a hydrophilic protein and alkalescent, with disordered regions. Analysis of signal peptide and transmembrane domain showed that there was no signal peptide and transmembrane domain. Spatial structure analysis shows that CnRADIALIS-like had a typical α-helical structure. Real-time fluorescent quantitative PCR (qRT-PCR) showed that the expression levels of CnRADIALIS-like were significantly different in the epicarp with different color, and the highest expression was observed in the red dwarf coconut. This gene showed the highest expression in the epicarp in comparison with other tissues of the red dwarf coconut. The expression of the gene decreased in the three developmental stages of red dwarf coconut from young fruit to mature fruit. The expression level under bagging conditions was lower than under normal light conditions, indicating that this gene may be related to cell development and metabolite synthesis under light morphology effect. The bioinformatic analysis of this gene would provide a reference for in-depth study of its functiona, and at the same time, it would also provide an important theoretical basis for the role of this gene in the formation of epicarp color of coconut.
Keywords: coconut; exocarp color; MYB family; RAD protein
DOI: 10.3969/j.issn.1000-2561.2021.09.006
椰子(Cocos nucifera L.)为棕榈科椰子属多年生热带木本油料和食品能源植物,是分布最广、栽培面积最大的热带果树种类之一[1]。椰子在我国已有2000多年的栽培历史,是营养丰富的天然有机食品,具有极高的经济价值[2]。而果皮颜色是椰子的重要品质性状,椰子具有橙红、金黄、绿色、褐色等多种果皮颜色,且果皮颜色很大程度上决定着果实的商品价值,因此,研究椰子果皮颜色的形成机制,对于椰子种质资源创新与开发利用具有重要意义[3]。
MYB转录因子是植物中最大的一类转录家族之一,在植物生长发育、细胞形态、次级代谢等方面发挥重要作用[4-5],与动物中的MYB类转录因子相比,植物中的MYB转录因子的第3个重复中的第1个色氨酸残基被苯丙氨酸或异亮氨酸残基所替换,C端序列则具有高度多样性,从而保证MYB转录因子的功能多样性[6-7]。早在1987年,Paz-Ares等[8]从玉米(Zea mays)中克隆出第1个参与类黄酮合成的MYB转录因子Colorless1(C1)后,相继克隆到其他MYB转录因子。MYB家族广泛参与花青素等次生代谢产物的生物合成,从而参与植物着色形成,而类胡萝卜素与花青素广泛存在于植物花瓣、果实的细胞液组织及茎叶的表面细胞中,赋予植物多彩的颜色[9]。为研究MYB家族转录因子对椰子外果皮的着色调控机制,本试验前期对4个不同品种椰子外果皮组织的转录组进行分析,筛选出与黄酮类等次生代谢产物生物合成相关的33个MYB转录因子基因,对该家族基因进行克隆及荧光定量表达分析,发现MYB-RAD家族中的CnRADIALIS- like基因在4个品种中的表达差异达显著水平,并且在红矮椰果外果皮中的表达量显著高于其他3个品种,推测其可能与红矮椰果外果皮颜色形成存在一定相关性,因此将该基因作为调控椰果外果皮颜色的候选基因之一。但目前对于MYB转录因子家族中的RADIALIS(RAD)的研究相对较少,作为MYB转录因子家族中的RAD蛋白,其研究主要集中于花的不对称性方向的调控作用,并且已证实在早期花分生组织的背侧区域特异表达[10]。在蓝猪耳(Torenia fournieri Linden. ex Fourn.)中,发现TfCYC2和TfRAD1在花的背侧区域和花冠色素沉着中高度表达[11]。目前,已有大量的MYB-RAD基因从植物中分离出来,但只有少数基因的功能已被证实,而椰子MYB家族转录因子成员结构及其在椰子外果皮的功能研究未见报道。
为探索椰子MYB家族转录因子成员结构及其在椰子外果皮的功能,本研究从椰子外果皮中克隆MYB-RAD转录因子基因(CnRADIALIS- like)并进行生物信息学分析,了解该基因的理化特性,为进一步研究该基因功能及蛋白互作等提供重要参考,并且为深入研究椰子MYB家族转录因子成员的结构和功能及揭示椰子外果皮颜色的调控机制提供参考依据。
1 材料与方法
1.1 材料
供试材料:均取自中国热带农业科学院椰子研究所种质资源圃,于2020年6月28号采集7~8月果龄的红矮、黄矮、褐矮及香水4个不同品种的椰果为品种间基因表达验证比较材料;采集红矮椰子果龄为3、5、7月3个不同发育阶段的椰果;采集红矮椰子套袋45 d的约7月果龄椰果和同株树未套袋生长阶段基本相同的椰果为对照。椰果带回实验室取外果皮并分装至液氮中速凍,–80 ℃保存备用。根、茎、叶取自红矮椰子幼苗,雄花、雌花取自红矮椰子未授粉花朵,清洗干净装袋放入液氮中,带回实验室存于–80 ℃冰箱保存备用。
实验耗材:通用柱式植物总RNA抽提纯化试剂盒、Mighty Script Plus第一链cDNA合成Master Mix(去基因组DNA)、San Prep柱式DNA胶回收试剂盒、San Prep柱式质粒DNA小量抽提试剂盒、pMD18-T载体及DNA Markers等购自生工生物工程(上海)股份有限公司;大肠杆菌DH5α购自日本TaKaRa公司;由生工生物工程(上海)股份有限公司进行引物合成与质粒测序;其他常规化学试剂均为国产分析纯。
主要仪器:M400磨样机、恒温培养箱、恒温水浴锅、超微量核酸蛋白仪、梯度PCR仪、凝胶电泳仪、凝胶紫外成像仪、切胶回收仪、冷冻高速离心机、高温高压灭菌锅、恒温摇床等。
1.2 方法
1.2.1 椰子总RNA提取及cDNA合成 取出超低温保存的红矮、黄矮、褐矮、香水椰果外果皮及椰子不同组织冻干样本,用研磨仪(MM 400, Retsch)研磨(30 Hz, 1 min)至粉末状,按照生工生物工程(上海)股份有限公司RNA提取试剂盒中操作说明提取样品RNA,采用Mighty Script Plus第一链cDNA合成Master Mix(去基因组DNA)试剂盒将所得样品RNA反转录成cDNA,置于–20 ℃冰箱保存备用。
1.2.2 引物设计及目的基因克隆 根据椰果外果皮转录组测序获得的序列CnRADIALIS-like(GenBank登录号:MW289067),并利用NCBI及Primer 5设计特异性引物CnRADIALIS-like For和CnRADIALIS-like Re,引物序列见表1。以红矮品种椰果外果皮cDNA为模板扩增目的片段全长。对PCR扩增产物进行回收纯化后与pMD18-T载体进行连接,连接产物转化至大肠杆菌DH5α感受态细胞,鉴定挑选阳性的克隆送至生工生物工程(上海)股份有限公司测序。
1.2.3 CnRADIALIS-like基因序列生物信息学分析 利用ProtParam、TMHMM Server v.2.0、SignalP-5.0 Server、DeepLoc-1.0、SMART、PSIPRED V4.0等在线分析软件对CnRADIALIS- like氨基酸序列进行生物信息学分析,利用BioEdit和MEGA-X进行多序列比对;以MEGA-X中的邻接法(neighbor-joining, NJ)构建系统发育进化树(Bootstrap设为1000),用于系统发育进化分析的其他物种的MYB氨基酸序列均下载自NCBI。
1.2.4 CnRADIALIS-like基因表达分析 依据CnRADIALIS-like基因序列通过Primer3 input在线设计特异性荧光定量引物CnRADIALIS-like RT2For和CnRADIALIS-like RT185Re,引物序列见表1。以不同样品反转录cDNA稀释5倍后为模板,参照Monad公司的Mon AmpTM SYBR? Green qPCR Mix (Low ROX)试剂盒的操作步骤进行实时荧光定量PCR分析,反应在QuantStudio3荧光定量PCR仪上运行,PCR反应体系为20 μL,反应程序:95 ℃ 30 s,95 ℃ 10 s,60 ℃ 30 s,40个循环;以椰子的Co-Actin基因为内参基因(Co ACT-1F: ATAAAGTATGGCTGATGCTGAGG, Co ACT-1R: CAACAATGCTTGGGAACACA),每个样品设3次重复,采用2–ΔΔCT法进行定量分析。
1.3 数据处理
采用Excel软件进行数据整理及方差分析,通过SAS 9.2软件进行单因素ANOVA检验及差异显著性分析。
2 结果与分析
2.1 RNA质量浓度检测
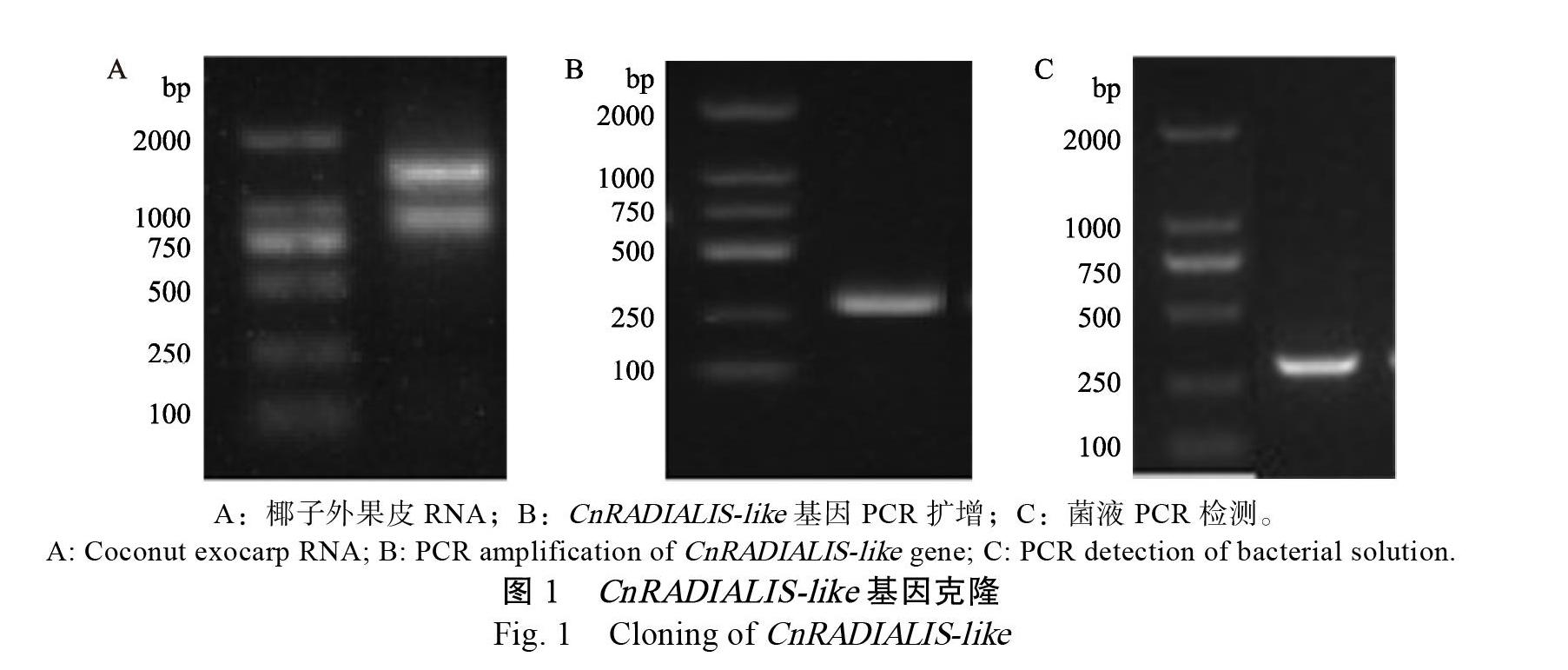
椰子外果皮RNA提取完成后进行1%琼脂糖电泳检测(图1A),RNA完整性较好;再利用超微量核酸蛋白检测仪检测RNA质量,OD值均在1.8~2.1之间,说明RNA纯度较高没有其他污染,可以进行逆转录及后续试验。
2.2 CnRADIALIS-like基因克隆及序列分析
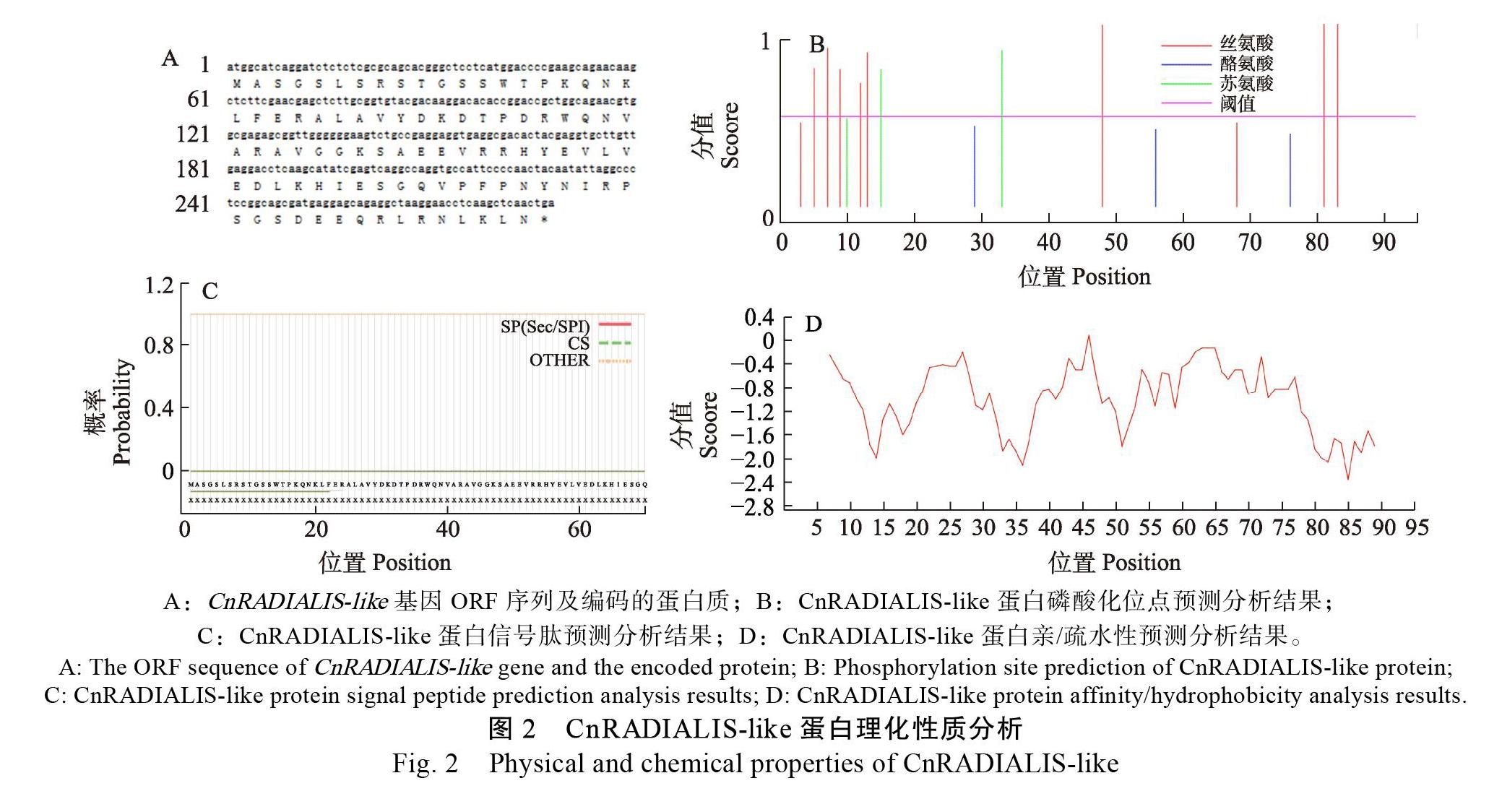
以椰子外果皮的cDNA为模板,CnRADIALIS- like For、CnRADIALIS-like Re为引物,经PCR扩增到的目的片段(图1B),获得一条250 bp处条带。通过回收目的片段与pMD18-T载体连接,经大肠杆菌菌液培养,再次通过菌液PCR验证后,1%琼脂糖电泳检测获得250 bp左右的基因片段(图1C)。挑选阳性克隆菌液进行测序分析,与转录组测序结果比对,目的基因全长序列为288 bp,将基因编码区序列进行比对,确定成功克隆获得CnRADIALIS-like基因。基因ORF全长288 bp,编码95个氨基酸(图2A),将该基因序列上传至NCBI数据库,并命名为CnRADIALIS-like(GenBank登录号:MW289067)。
2.3 CnRADIALIS-like蛋白理化性质预测分析
利用ProtParam在线预测分析CnRADIALIS- like蛋白的理化性质,得到其分子量为10 814.03 Da,分子式为C470H746N144O148S 理论等电点(pI)为9. 带负电荷残基总数(Asp+Glu)为13个,带正电残基总数(Arg+Lys)为15个,不稳定系数为73.36(属于不稳定蛋白),脂肪族氨基酸指数为68.74,总平均亲水性系数为–0.946(图2B),故推测CnRADIALIS-like蛋白是一个不稳定的亲水性蛋白。
2.4 CnRADIALIS-like蛋白磷酸化位点、跨膜结构及亚细胞定位预测分析
利用NetPhos 3.1预测分析CnRADIALIS-like蛋白磷酸化位点,结果(图2D)显示CnRADIALIS- like肽链中可能发生磷酸化且分值在0.5以上的氨基酸位点有10个,其中丝氨酸磷酸化位点8个、苏氨酸磷酸化位点2个、酪氨酸磷酸化位点0个。由于CnRADIALIS-like肽链以丝氨酸磷酸化位点为主,推测CnRADIALIS-like蛋白是以丝氨酸为主、苏氨酸为辅的磷酸化修饰调控其生物功能。利用TMHMM Server v.2.0预测分析CnRADIALIS- like蛋白跨膜结构,结果表明CnRADIALIS-like蛋白无跨膜结构。利用SignalP-5.0 Server预测分析CnRADIALIS-like蛋白的信号肽,结果显示存在信号肽的概率为0.06%,故推测CnRADIALIS-like是非分泌蛋白(图2C)。利用DeepLoc-1.0預测分析CnRADIALIS-like蛋白亚细胞定位,发现其定位于细胞核中。
2.5 CnRADIALIS-like蛋白保守结构域及二、三级结构预测分析
利用在线分析工具SMART: Main page预测分析CnRADIALIS-like蛋白保守结构域可知(图3A),CnRADIALIS-like的保守结构域存在1个SANT结构域和1个low complexity,其位置分别在10~62和3~13氨基酸处,CnRADIALIS-like
氨基酸序列具有植物MYB转录因子家族的特异性SANT/MYB DNA结合结构域,属于MYB家族。利用PSIPRED V4.0预测分析CnRADIALIS- like蛋白二级结构,结果显示其二级结构主要以α-螺旋和无规则卷曲为主(图3B),分别占52.63%和47.37%。利用SWISS-MODEL预测分析该蛋白三级结构,发现其主要由螺旋和卷曲结构组成,分析其三级结构发现存在HTH结构(螺旋-转角-螺旋模式)与二级结构预测结果相符合(图3C)。
2.6 CnRADIALIS-like系统发育进化分析
将克隆到的CnRADIALIS-like测序结果与已报道的152个MYB-RAD基因的序列进行同源进化比对,构建同源进化树(图4),结果表明,CnRADIALIS-like与MYB基因家族基因聚为一簇,单子叶植物中CnRADIALIS-like与棕榈科植物油棕(NC_026005.1)相似度最高,亲缘关系较近。双子叶植物中与柑橘(NC_023048)、芝麻(NC_026151.1)、向日葵(NC_035448.2)等相似度较高。此外,从NCBI中下载其余17种植物的MYB-RAD转录因子的氨基酸序列,利用邻接法与椰子CnRADIALIS-like蛋白序列比对建立系统进化树,结果显示其与油棕(Elaeis guineensis)RADIALIS-like 3氨基酸聚集在一个分支上(图5),表明这二者的同源性最高。
2.7 CnRADIALIS-like基因表达分析
对于不同品种而言,CnRADIALIS-like在红矮椰果外果皮中表达量最高,约为香水椰子的9倍,褐矮椰果和黄矮椰果外果皮中的表达量也显著高于香水椰子(图6A)。CnRADIALIS-like基因在本研究检测的6个椰子组织(根、茎、叶、雌花、雄花、外果皮)中均有表达,但其表达量存在差异。CnRADIALIS-like主要在外果皮、雌花、根和叶中高表达,茎和雄花中表达量较低,其中外果皮中的表达量显著高于其他组织,约为茎的40倍,而雌花中的表达量是雄花的10倍(图6B)。对于不同发育阶段的红矮品种椰果而言,CnRADIALIS-like在3月果龄、5月果龄和7月果龄的表达量依次下调,其中3月果龄外果皮中的表达量显著高于5月果龄和7月果龄,3月果龄外果皮中的表达量约是7月果龄的3倍,是5月果龄的2倍多(图6C)。对于不同光照处理而言,无套袋处理的红矮椰果外果皮中的表达量显著高于套袋45 d的红矮椰果外果皮中的表达量,说明该基因可能参与光形态下细胞发育及代谢的相关过程(图6D)。
3 讨论
目前,已有大量的MYB-RAD基因从植物中分离出来,但只有少数基因的功能已被证实。RAD是一種小蛋白,属于I-box-binding-MYB型[12],由约99个氨基酸组成,含有1个单一的MYB结构域,为典型色氨酸残基被酪氨酸取代,该结构域大致跨越蛋白质的N端三分之二[13]。RAD类基因从裸子植物开始就已经存在,它是由MYB TFs进化后期中的DIV基因进化而来的,该基因可能通过缺失或选择性剪接事件丢失了编码MYBII结构域的区域[14-17]。本研究从椰子外果皮中克隆得到的CnRADIALIS-like基因与RAD基因同源,序列分析表明RAD属于MYB转录因子家族,MYB转录因子在真核生物中广泛存在,尤其存在于植物[18-20]的生长发育、生命周期和代谢过程中。
MYB转录因子家族中的RAD蛋白在不同的植物物种中起着不同的作用。在茄属(Solanum L.)植物中,与RAD同源的SANT/MYB1-like1蛋白参与其果实和植株发育的早期阶段[21-23]。而CnRADIALIS-like基因在红矮椰子3月果龄、5月果龄和7月果龄不同果实成熟发育阶段外果皮中的表达量依次减少,与该类蛋白参与植株发育早期阶段相对一致。在唇形目(Lamiales)金鱼草(Antirrhinum majus)中研究表明,RAD与DIV竞争与其他MYB样蛋白的结合,称为DRIF1和DRIF2(DIV和RAD相互作用因子),RAD通过抑制金鱼草花背侧区域的DIV和DRIFs之间的相互作用,以建立花分生组织中基因活性的不对称模式[24]。在生长组织中经常发现RAD基因高表达,这表明RAD基因可能参与了组织发育。这与导致胚胎停滞的AtRL2突变表型以及拟南芥(Arabidopsis thaliana)中导致叶片面积减小的异位RAD表达的效应是一致的[25]。当植物在黑暗中生长时,RAD的过表达也阻止了下胚轴中顶端弯钩处的形成,从而达到可以抑制植物生长的作用[26]。本研究中对椰果套袋处理的CnRADIALIS-like基因表达量显著低于光照环境下,推测该基因的表达可能参与光形态下细胞的分化与发育过程,进而影响外果皮表皮组织细胞中苯丙氨酸解氨酶(PAL)、查耳酮合酶(CHS)及二氢黄酮醇4-还原酶(DFR)等花青素合成途径关键合成酶的活性,进而抑制花青素的合成和积累,导致红矮椰果外果皮颜色由红色褪变为白色或淡黄色,这与RAD类蛋白影响细胞分化和发育结果相对一致,但对于细胞如何参与代谢产物的影响还需要更深入的研究。在棉属(Gossypium)中,GbRL1属于RAD2分支,该基因在胚珠和胚珠组织中强烈表达,具有潜在的控制棉纤维生长的作用,为RAD类蛋白新功能提供了证据[26]。这种模式可能意味着RAD、DIV和CYC之间的相互作用途径可能是唇形亚纲(Lamiidae)或菊亚纲(Asteridae)特有的。在番茄(Lycopersicon esculentum)的FSM1(RAD样)和MYBI(DIV样)蛋白中发现的类似拮抗相互作用与果实发育有关。水果SANT/MYB(FSM1)蛋白,是一种RAD同系物,与MYBI竞争FSB1[27],而研究表明,FSM1的番茄植株对细胞的扩增有抑制作用,特别是对那些具有较高扩增潜力的细胞,如位于果皮维管束内部的细胞[24, 26]。本研究中,套袋导致椰子外果皮RAD类CnRADIALIS-like基因表达量下降,推测其影响果实表皮细胞的扩增,同时对果皮表皮细胞内苯丙氨酸解氨酶、蜡质、角质、木质素等合成酶的活性存在一定抑制作用,从而引起外果皮木质化程度降低、颜色变浅及果皮亮度、饱和度增加,与RAD类蛋白参与果皮维管束细胞扩增结果相对一致。
此外,在唇形花如蓝猪耳中,TfCYC2和TfRAD1也在花的背侧区域和花冠色素沉着中高度表达[11]。而本研究中克隆到的CnRADIALIS-like基因在椰子外果皮中的表达量显著高于其他组织,并且在4个不同颜色品种椰子外果皮的表达量存在显著差异,由此推测其可能参与椰子外果皮颜色形成的过程。目前对RAD和DIV同源物的进化和/或表达的研究集中在选定的核心真双子叶植物上,包括川续断属(Dipsacus Linn.)、豆科(Leguminosae sp.)、车前(Plantago asiatica L.)和茄目(Silanales)[15, 27-30]。已有少数开展非核心真双子叶植物的研究,特别是单子叶植物中鉴定出RAD和DIV基因[14, 17]。单子叶植物(兰科Orchidaceae)的稀有表达评估中揭示了可能的冗余功能,表明RAD/DIV基因的调控有一定程度的保守性。因此,单子叶植物中得到的RAD基因为其功能扩展提供了更加广泛的可能性。
综上所述,从单子叶植物椰子中克隆到的RAD类型基因,通过参考前人对MYB-RAD基因的研究进展,完善了MYB-RAD基因家族成员信息,为该基因家族后续研究,以及为揭示椰子外果皮颜色形成机理提供理论依据,但对其参与代谢产物功能的验证及其蛋白互作机制的揭示仍需进一步的研究。
参考文献
[1] 曹红星, 雷新涛, 刘艳菊, 等. 椰子抗寒相关生理生化指标筛选及评价[J]. 广东农业科学, 2016, 43(2): 49-54.
[2] 李 静, 吴 翼, 杨耀东, 等. 不同成熟度椰子胚乳糖酸组分变化规律[J]. 西南农业学报, 2019, 32(6): 1267-1272.
[3] 段 颖, 向成钢, 刘新艳, 等. 印度南瓜果皮结构与色素组成对果皮颜色的影响[J]. 中国蔬菜, 2017(11): 33-39.
[4] 关淑艳, 焦 鹏, 蒋振忠, 等. MYB转录因子在植物非生物胁迫中的研究进展[J]. 吉林农业大学学报, 2019, 41(3): 253-260.
[5] 杨 雪, 雒 军, 杨彩霞, 等. 当归MYB4转录因子基因的克隆及表达分析[J]. 河南农业科学, 2018, 47(12): 48-56.
[6] Ogata K, Kanei-Ishii C, Sasaki M, et al. The cavity in the hydrophobic core of Myb DNA-binding domain is reserved for DNA recognition and trans-activation[J]. Nature Structural Biology, 1996, 3(2): 178-187.
[7] Supriya A, Poonam S, Neelam R Y, et al. MYB transcription factor genes as regulators for plant responses: An overview[J]. Physiology and Molecular Biology of Plants, 2013, 19(3): 307-321.
[8] Paz-Ares J, Ghosal D, Wienand U, et al. The regulatory c1 locus of Zea mays encodes a protein with homology to myb proto-oncogene products and with structural similarities to transcriptional activators[J]. The EMBO Journal, 1987, 6(12): 3553-3558.
[9] 彭亞丽, 高 倩, 董 文, 等. MYB转录因子调控蔬菜花青素生物合成的研究进展[J]. 中国瓜菜, 2020, 33(12): 1-7.
[10] Susie B, Corley Rosemary C, Lucy C, et al. Floral asymmetry involves an interplay between TCP and MYB transcription factors in Antirrhinum[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(14): 5068-5073.
[11] Su S H, Xiao W, Guo W X, et al. The CYCLOIDEA- ADIALIS module regulates petal shape and pigmentation, leading to bilateral corolla symmetry in Torenia fournieri (Linderniaceae)[J]. The New Phytologist, 2017, 215(4): 1582-1593.
[12] Chen Y H, Yang X Y, He K, et al. The MYB transcription factor superfamily of Arabidopsis: Expression analysis and phylogenetic comparison with the rice MYB family[J]. Plant Molecular Biology, 2006, 60(1): 107-124.
[13] Du H, Wang Y B, Xie Y, et al. Genome-wide identification and evolutionary and expression analyses of MYB-related genes in land plants[J]. DNA Research, 2013, 20(5): 437-448.
[14] Raimundo J, Sobral R, Laranjeira S, et al. Successive domain rearrangements underlie the evolution of a regulatory module controlled by a small interfering peptide[J]. Molecular Biology and Evolution, 2018, 35(12): 2873-2885.
[15] Gao A, Zhang J B, Zhang W H. Evolution of RAD-and DIV-like genes in plants[J]. International Journal of Molecular Sciences, 2017, 18(9): 1961.
[16] Madrigal Y, Alzate J F, González F, et al. Evolution of RADIALIS and DIVARICATA gene lineages in flowering plants with an expanded sampling in non-core eudicots[J]. American Journal of Botany, 2019, 106(3): 334-351.
[17] Pil J S, Shin Y H, Sang G K, et al. Competitive inhibition of transcription factors by small interfering peptides[J]. Trends in Plant Science, 2011, 16(10): 541-549.
[18] Valoroso, M C, Paolo D, Iazzetti G, et al. Transcriptome-wide identification and expression analysis of DIVARICATA-and RADIALISlike genes of the mediterranean orchid Orchis italica[J]. Genome Biology and Evolution, 2017, 9(6): 1418-1431.
[19] Aya Hamaguchi, Takafumi Yamashino, Nobuya Koizumit, et al. A small subfamily of Arabidopsis RADIALIS-LIKE SANT/MYB genes: A link to HOOKLESS1-mediated signal transduction during early morphogenesis[J]. Bioscience Biotechnology & Biochemistry, 2008, 72(10): 2687-2696.
[20] Yang B C, Song Z H, Li C N, et al. RSM1, an Arabidopsis MYB protein, interacts with HY5/HYH to modulate seed germination and seedling development in response to abscisic acid and salinity[J]. PLoS Genetics, 2018, 14(12): e1007839 .
[21] Park D Y, Shim Y G, Gi E J, et al. The MYB-related transcription factor RADIALIS-LIKE3 (OsRL3) functions in ABA-induced leaf senescence and salt sensitivity in rice[J]. Environmental and Experimental Botany, 2018, 156: 86-95.
[22] Garcês Helena M P, Spencer Victoria M R, Kim M. Control of floret symmetry by RAY3, SvDIV1B, and SvRAD in the capitulum of Senecio vulgaris[J]. Plant Physiology, 2016, 171(3): 2055-2068.
[23] Zhang F, Liu X, Zuo K J, et al. Molecular cloning and characterization of a novel Gossypium barbadense L. RAD-like gene[J]. Plant Molecular Biology Reporter, 2011, 29(2): 324-333.
[24] Raimundo J, Sobral R, Bailey P, et al. A subcellular tug of war involving three MYB‐like proteins underlies a molecular antagonism in Antirrhinum flower asymmetry[J]. The Plant Journal, 2013, 75(4): 527-538.
[25] Baxter Catherine E L, Costa Maria M R, Coen E S. Diversification and co-option of RAD-like genes in the evolution of floral asymmetry[J]. The Plant Journal: For Cell and Molecular Biology, 2007, 52(1): 105-113.
[26] Zhang F, Liu X, Zuo K J, et al. Molecular cloning and expression analysis of a novel SANT/MYB gene from Gossypium barbadense[J]. Molecular Biology Reports, 2011, 38(4): 2329-2336.
[27] Katja M, Oxana S, Yehiam S, et al. Interplay of MYB factors in differential cell expansion, and consequences for tomato fruit development[J]. The Plant Journal, 2011, 68(2): 337-350.
[28] Howarth D G, Donoghue M J. Duplications and expression of DIVARICATA-like genes in Dipsacales[J]. Molecular Biology and Evolution, 2009, 26(6):1245-1258.
[29] Du H, Yang S S, Liang Z, et al. Genome-wide analysis of the MYB transcription factor superfamily in soybean[J]. BMC Plant Biology, 2012(1): 106.
[30] Larsson A. AliView: a fast and lightweight alignment viewer and editor for large datasets[J]. Bioinformatics (Oxford, England), 2014, 30(22): 3276-3278.
責任编辑:谢龙莲
