互花米草育性基因Pollen Tube Blocked 1的自然变异及其表达与自交结实的相关性
2021-11-08乔红梅周佳文张宜辉李庆顺
乔红梅,周佳文,张宜辉,李庆顺*
(1.厦门大学环境与生态学院,滨海湿地生态系统教育部重点实验室,福建 厦门 361102;2.厦门大学嘉庚学院,河口生态安全与环境健康福建省高校重点实验室,福建 漳州 363105)
互花米草(SpartinaalternifloraLoisel)为禾本科(Poaceae)米草属(Spartina)的六倍体(2n=62)多年生草本植物[1],起源于美洲大西洋沿岸和墨西哥湾的潮间带[1],目前已在全球范围入侵,包括美国的太平洋沿岸、欧洲的大西洋沿岸以及亚洲的东部地区,其中中国是最大的入侵区域[1-3].1979年,南京大学的研究人员从美国佐治亚州(Georgia)的萨佩洛岛(Sapelo Island)、北卡罗来纳州(North Carolina)的莫尔黑德城(Morehead City)以及佛罗里达州(Florida)的坦帕湾(Tampa Bay)收集3种生态型的互花米草,分别被称为G型、N型和F型,到我国福建省罗源湾试种,随后人工收集种子引种到我国沿海的其他地区[1-2,4].由于其生长和繁殖速度快,很快向种植地南北两个方向入侵,现已遍布于南起广东北至辽宁的整个沿海地区,成为我国首批16种入侵物种之一[5],极大地影响了滨海湿地的养殖业与生态安全.
互花米草成功入侵的重要原因之一是它的生殖方式,包括有性生殖和无性生殖两种.无性生殖以地下的根状茎为繁殖器官,通过分蘖的方式向外扩大种群斑块;有性生殖所产生的种子,是其远距离扩张的主要方式[1-2,4].有性生殖过程主要通过风媒传播,由于柱头具有捕捉花粉的特性,花柱伸出先于花粉囊裂,所以授粉方式主要以异花传粉和异交结实为主[6].早期入侵到美国旧金山湾的互花米草开花但结实很少甚至不结实,研究发现这主要是由于自交不亲和,自交的胚胎因无法正常生长而败育,尤其在对营养等竞争激烈的环境中,这种近交衰退程度达到最高[7].随后互花米草和当地物种叶米草发生杂交,形成了杂交种群,而这些杂交种群在初期能够自花授粉并形成幼苗[8].Liu等[9-10]研究发现,入侵到中国的互花米草,其结实率在野外呈现随纬度梯度变化的趋势,即高纬度地区种群的结实率显著高于低纬度地区种群.随后Qiao等[11]发现:互花米草自引入中国后发生了种群间的遗传混合,使得一些优势基因相互组合形成超级基因型,具体表现为不仅有很强的分蘖能力还具有很高的结实率,这些性状在高纬度地区受到自然选择进而形成了很强的入侵能力;不仅如此,移栽到温室环境中的种群也表现出相同的趋势,推测北方的种群可能发生了自交进化.然而导致结实这一性状南北差异的影响因素目前还不得而知.
种子结实是一个受多基因调控的数量性状.目前,有关育性基因的研究在水稻中多有报道.其中雌性不育基因PollenTubeBlocked1(PTB1)具有E3泛素化的特性,可以通过泛素化作用抑制下游对花粉管生长有抑制作用的负调控因子,促进花粉管生长,进而影响受精过程,是影响结实率的一个主效基因[12].在水稻中PTB1基因定位于第5号染色体的短臂上,实时荧光定量PCR(RT-qPCR)发现不同株系的结实率与该基因的表达量呈正相关,同时过表达PTB1基因会使得结实率高于野生型,证明其对结实具有重要作用[12-13].
互花米草与水稻同为禾本科植物,针对其结实率这一性状的南北差异现象,提出两个待解决的科学问题:1) 不同种群的结实率差异是否与SaPTB1的变异及表达情况有关?2) 入侵中国的互花米草是否发生了自交进化现象?为此,本研究选取种植于温室的8个互花米草种群,克隆SaPTB1并进行测序,寻找单核苷酸多态性(single nucleotide polymorphism,SNP)位点,同时比较该基因在不同种群的表达情况,并采取套袋实验统计自交结实率.
1 实验材料与方法
1.1 实验材料准备
在2013年9月—2014年10月期间,沿中国海岸线,南北跨越2 000 km,在北纬39.05°(天津)~20.90°(广东)的地区,按照纬度梯度从南至北采集互花米草的种子,每个纬度梯度采集一个种群,每个种群包括10个个体,共10个种群[1-2,4].为了避免采集到相同克隆斑块的样本,不同个体的间隔大于30 m,将种子带回厦门大学翔安校区的同质园(24.62° N,118.31° E)进行种植,随后每年用根状茎进行繁殖培育以确保植株连续生长.相同植株的根状茎培育而来的幼苗分盆形成克隆植株,得到和原种群遗传背景完全相同的一批克隆植株.其中克隆种群用来采集雌蕊,原种群供套袋实验以收集种子(图1).
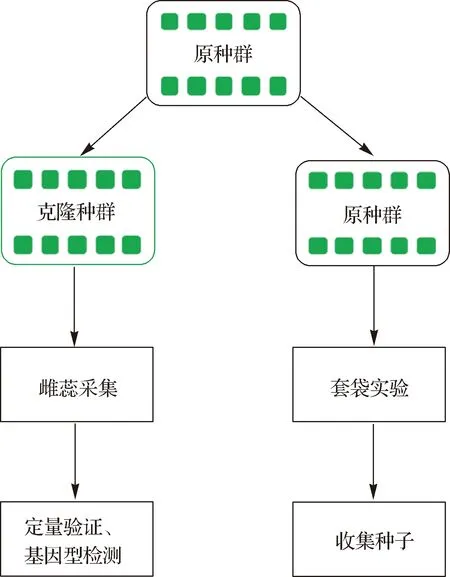
图1 实验设计示意图
2018年6—9月(开花季)进行雌蕊采集.为了保证样品的一致性,每次采样都在上午9:00—10:00进行.由于台风和物候等原因,10个种群中只采集到8个种群的样品(表1),每个种群3个个体,共24个样品.采集好的雌蕊放置于液氮保存以供后续的RNA提取.为了检测植株的自交结实情况,原种群于开花季将植株的花序用孔径0.5 mm的网袋套住以防止异花授粉(互花米草作为风媒传粉的植物, 在温室中几乎无风的条件下,套袋可以更加有效地减少异花授粉的概率).同年11月统计种子结实情况,为了保持样品的一致性,选取和采集雌蕊相同的种群计算结实率:结实率=饱满的种子数/种子总数×100%.

表1 互花米草样品采集信息
1.2 定量验证与基因型检测
用RNAprep Pure多糖多酚植物总RNA提取试剂盒(TIANGEN)提取互花米草雌蕊的总RNA.提取的RNA分别用NanoDrop 2000(Thermo)和凝胶成像系统(Bio-Rad)检测其纯度和完整性.用反转录试剂盒(上海麦克林生化科技有限公司)将质检合格的RNA反转录成cDNA,过程如下:RNA 600 ng,AccuRT Reaction Mix(4×) 2 μL,加焦碳酸二乙酯处理的水(DEPC H2O)至8 μL,42 ℃孵育2 min;加AccuRT Reaction Stopper(5×) 2 μL,All-In-One RT MasterMix(5×) 4 μL,无核酸酶H2O 6 μL,充分混匀;先后在25 ℃ 孵育10 min,42 ℃孵育15 min,85 ℃孵育5 min;放置于冰上,加入180 μL无核酸酶H2O,制成cDNA原液,将原液稀释10倍,制成cDNA工作液.在荧光定量PCR仪(CFX96,Bio-Rad)中进行RT-qPCR,反应体系如下:SYBR Green Mix(Roche,Switzerland)10 μL,正/反向(F/R)引物各0.5 μL,cDNA模板1 μL,DEPC H2O 8 μL.反应条件为:95 ℃ 3 min;95 ℃ 10 s,56 ℃ 10 s,72 ℃ 10 s,40个循环;95 ℃ 10 s.原液送至厦门闽博生物技术有限公司测序.SaPTB1的基因序列信息源于前人的研究[14],在该基因的两端设计引物PTB1-F/PTB1-R,内参Tubulin基因的引物为Tubulin-F/Tubulin-R,参考Baisakh等[15]对互花米草耐盐性基因的定量扩增实验(表2).以上两对引物均由赛默飞世尔科技(中国)有限公司合成.
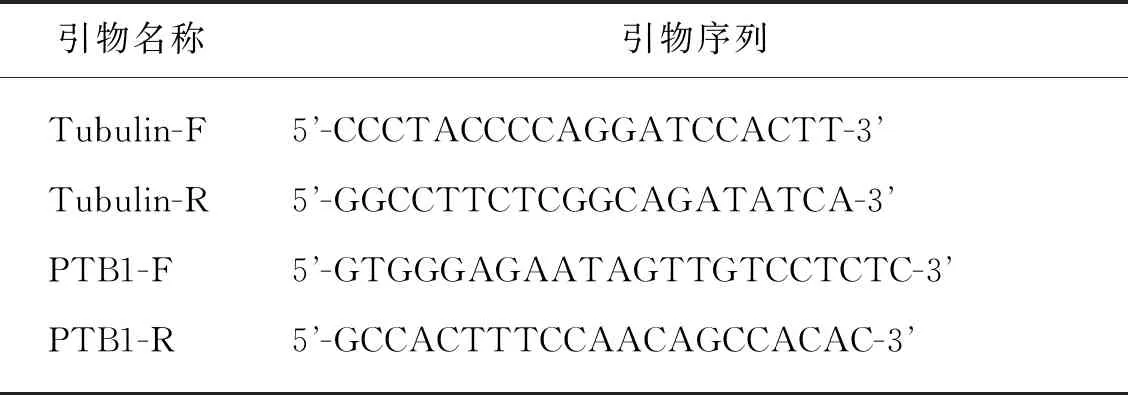
表2 用于RT-qPCR分析的引物
1.3 统计方法
采用SPSS 21.0软件进行统计分析,SaPTB1的相对表达水平和结实率用种群的平均值±标准差表示,两组数据的相关性用皮尔森(Pearson)相关系数表示.
2 结果与分析
2.1 结实率统计
实验发现套袋自交的互花米草可以观察到结实现象,不是绝对的“自交不亲和”,但空壳比例很高,各种群的结实率都处于较低水平(图2).最高纬度地区的东营种群结实率最高,为22.22%;最低纬度地区的雷州种群结实率次之,为8.98%;剩余6个中纬度和低纬度地区种群的结实率都很低,只有1.49%~3.08%.

云霄种群没有收集到数据.
2.2 PTB1表达情况
对24个样品中23个样本(有一个样本因未得到高质量RNA而舍弃)的SaPTB1表达情况进行RT-qPCR分析发现,该基因在8个种群中的表达水平都相对较低,相对表达水平为0.92~1.97,无显著差异(p>0.05).东营(1.80)与雷州(1.97)种群的平均表达水平相对较高,而盐城(1.02)、崇明(0.99)、乐清(0.96)、罗源(1.19)、云霄(1.12)和珠海(0.92)种群的平均表达水平普遍较低(图3).相关性分析结果显示SaPTB1的相对表达水平和结实率呈正相关,两组数据的相关系数高达0.80(p=0.03).

图3 互花米草SaPTB1基因在不同种群中的相对表达水平
2.3 SaPTB1单倍体划分
对互花米草24个样品的SaPTB1编码序列进行双端测序后,最终成功获得21个样品的数据,再用Bio-Edit软件将正向和反向序列进行拼接获得完整的基因序列.所有序列进行比对寻找SNP位点,再根据双端的测序峰图进行校正,最终获得2个SNP位点:第1个是C/T的替换,第2个是A/G的替换,共组合成3种类型(C…A、C…G和T…G)(图4(a));系统发育分析结果显示21个样品共聚为3组,与碱基替换的分类结果一致(图4(b)).将核酸序列翻译成蛋白质序列后发现:C/T为同义突变,碱基的替换不会改变所编码的氨基酸,密码子CTC和CTT均编码亮氨酸(L);A/G的替换会导致氨基酸的不同,密码子GAC编码天冬氨酸(D)而替换后的AAC则编码天冬酰胺(N)(图4(a)).把SNP位点为G,翻译成天冬氨酸的样品划分为单倍型1(Haplotype 1,Hap.1);把SNP位点为A,翻译成天冬酰胺的样品划分为单倍型2(Haplotype 2,Hap.2)(图4(c)).21个样品中有8个(DY1、YC3、YQ1、YQ2、LY3、YX1、YX2和LZ2)为Hap.1,占总样品的38%;剩余的13个(62%)为Hap.2(图4(c)).对两种单倍型的种源地进行追溯,发现在南北均有分布,并未呈现区域性变异的规律(图4(d)).
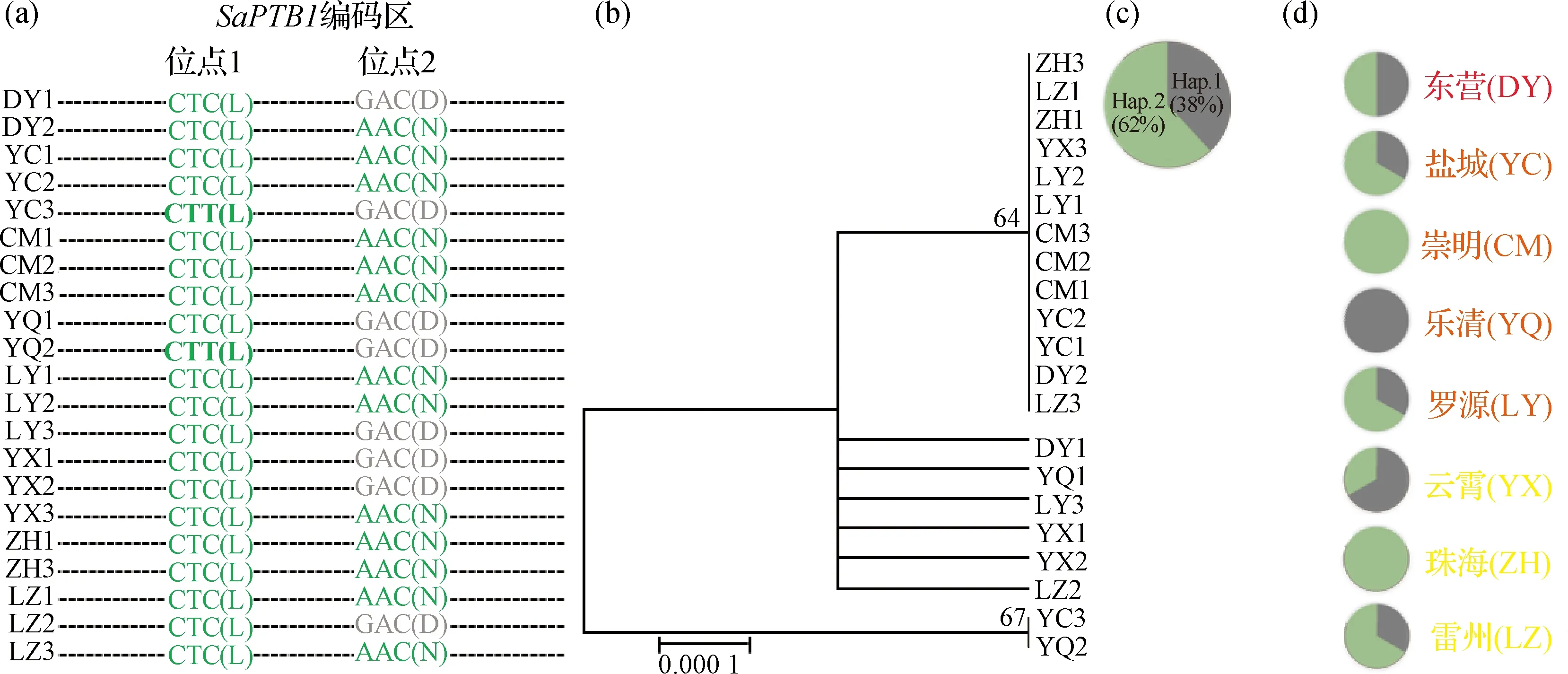
(a)绿色和灰色表示碱基变异位点信息,括号中为相应的氨基酸;(b)节点数值代表自展值,下方比例尺为距离标尺;(c~d)绿色和灰色表示两种不同的单倍型,其中(d)中红色、橙色、黄色分别表示高纬度、中纬度以及低纬度地区的种群,DY3、YQ3和ZH2没有得到数据.
3 讨论与结论
互花米草中SaPTB1基因的编码区发生了同义和非同义位点突变,这种有意义的突变意味着该基因可能受到很强的自然选择.然而本研究中两种单倍型没有表现出像结实率那样随纬度梯度而变化的现象,说明SaPTB1基因的序列变异与结实率没有显著的相关性.相反,这可能是由引种历史造成的:3种生态型同时被引种到罗源湾试种后,收集到的种子又被带到山东、江苏、浙江和福建省其他地区,因此3种生态型便分布到全国各地,如同本研究中的两种单倍型的分布一样.
SaPTB1基因在各种群的表达水平与其自交结实能力密切相关(相关系数为0.80,p=0.03),虽然SaPTB1基因的表达水平在各种群中都很低,这可能是由于在开花季节(6—9月)温室的温度偏高造成的,SaPTB1基因的表达受到温度的调控,高温会显著抑制其表达[12].尽管如此,除了雷州种群外,高纬度地区东营种群的平均表达水平仍高于其他地区,研究结果显示表达水平最高的这两个种群的自交结实率也是最高的,分别为22.22%和8.98%,说明SaPTB1基因的表达水平可能对自交结实能力具有重要影响.此外,本研究发现位于最低纬度地区的雷州种群也具有较高的自交结实能力,其因种群面积小,处于一个竞争相对较弱的环境[3],有利于自交结实,因此推测低纬度地区种群的结实主要得益于自交结实.在互花米草生活史特点的研究中,Davis等[16]发现若植物入侵初期把较多的能量投入到生殖中,会导致其更易死亡,生存力和生殖力间存在一定平衡.雷州种群作为一个低密度地区的种群[3],很容易经历环境影响带来的瓶颈效应和花粉限制造成的“阿利效应”(Allee effect)[17],最终造成生殖失败;而自交结实可以帮助种群突破低密度制约,从一定程度上减轻“阿利效应”的影响,实现以自交结实繁殖而形成入侵斑块[18],这样的繁殖策略在旧金山湾入侵的互花米草种群中取得了成功.引种到中国的互花米草在早期发生杂交后,杂交种群通过自交结实克服了“阿利效应”.早期的生殖成功不仅保证了种群的存活,更为以后的快速入侵奠定了基础.本研究结果显示SaPTB1基因在中纬度地区种群中的表达水平较低,自交结实率也是最低的,可能是由于中纬度地区的种群对空间和营养的竞争激烈,自交衰退严重[7],结实主要来自于异交结实.而Liu等[9-10]的研究中所统计的结实率包括自交结实和异交结实,高纬度地区种群较高的结实率来自较高的自交和异交结实的总和,中纬度地区种群的结实率主要来自异交结实,低纬度地区种群的结实率则主要来自自交结实.互花米草是一种以异交结实为主的植物,其异交结实率远高于自交结实,因此结实率总体呈现出高纬度(异交+自交)、中纬度(异交)和低纬度(自交)逐渐降低的趋势.
综上所述,本研究证实引种到中国的互花米草具有自交结实能力,并且SaPTB1基因发生了位点变异;同时,该基因的表达与其自交结实能力呈现正相关性.本研究初步探究了互花米草结实差异的内在遗传机制,为预防和控制互花米草入侵提供了新的理论参考.由于实验条件的限制,种植于温室的互花米草开花的样本有限,今后还需要进一步开展大样本量的分析.
