白细胞介素-10基因的3个单核苷酸多态性位点与慢性乙型肝炎病毒感染后炎症程度的相关性分析
2021-11-08苏成豪
张 璋,林 勇,苏成豪*
(1.厦门大学公共卫生学院,福建 厦门 361102;2.复旦大学附属中山医院厦门医院,福建 厦门 361015;3.厦门大学附属中山医院,福建 厦门 361004)
慢性乙型肝炎病毒(HBV)感染是肝硬化和肝癌的主要危险因素.有研究表明乙肝表面抗原(HBsAg)阳性者的肝癌发生风险显著高于阴性者[1].据估计全球约有2.4亿慢性HBV感染患者,死亡人数每年超过68.6万[2].据2019年的报道,我国HBsAg携带者约占总人口的10%,以此计算约有1.39亿HBV携带者[3].目前没有根除已感染患者体内HBV的治疗方法,因此仍有大量慢性HBV感染人群,并且有可能出现肝硬化和肝癌等严重并发症,迫切需要调查影响慢性HBV感染患者疾病进程的因素,并提供及时的干预措施以减少严重并发症的发生.
以往研究表明,HBV和宿主免疫均与慢性HBV感染后的进程和结局有关[4-6].一项在中国汉族人群中进行的病例对照研究显示,白细胞介素-10(IL-10)基因多态性对感染HBV的风险有显著影响[7].IL-10可以通过抑制T淋巴细胞、自然杀伤(NK)细胞等介导的免疫应答,抑制促炎因子mRNA的表达,从而抑制促炎因子的合成和释放,维持体内免疫反应与炎性反应平衡[8].IL-10基因启动子区域存在单核苷酸多态性(SNP)位点,能改变IL-10基因的转录活性,进而影响IL-10的合成及分泌.大量研究表明IL-10基因多态性与多种肝脏疾病相关,如慢性乙型肝炎、慢性丙型肝炎、酒精性肝炎等免疫性肝损伤及部分药物性肝损伤[9-12];但IL-10基因多态性是否与慢性HBV感染后的疾病进程相关有待进一步研究.
本研究基于212名划分为轻度肝炎组(对照组,151例)和中、重度肝炎组(病例组,61例)的HBV感染者,选取IL-10基因中被研究最多的3个SNP位点rs1800871、rs1800872和rs1800896[13]进行基因分型,分析IL-10基因多态性与慢性HBV感染后炎症程度的相关性,以期从基因层面探索HBV感染者疾病的进程,为开展HBV高危人群的预防和健康促进工作提供科学理论依据.
1 资料与方法
1.1 资料与数据收集
本研究在厦门大学附属中山医院选取212名慢性HBV感染患者.为排除以往抗病毒治疗等因素引起的混杂效应,研究对象的纳入标准为患者年龄20~79岁,HBV DNA含量≥107拷贝/mL,既往没有抗病毒治疗史;排除标准为患者拒绝参与或接受过抗病毒治疗,合并感染丙型肝炎病毒或人类免疫缺陷病毒[14].通过对患者肝穿刺活检,结合国际常用的Metavir系统[15]进行肝组织纤维化分期和炎症分级:将肝组织炎症活动度评分为A0~A1的患者定义为轻度慢性肝炎患者,作为对照组;将评分为A2~A3的患者定义为中度至重度慢性肝炎患者,由于病例数较少,合并作为病例组.本研究的所有程序均符合《赫尔辛基宣言》要求且患者均已签署知情同意书.通过面对面采访的方式收集患者的性别、年龄和肝炎家族史等信息,通过医院信息系统查阅电子病例,收集有关HBV感染的信息.伦理审批号:xmzsyyky伦审第(2018009)号.
1.2 基因型检测
在入选患者进入研究当日收集其静脉血样,并将血液样品以4 000 r/min离心10 min,分离血清和血细胞,-78 ℃下储存.采用Magna Pure LC 2.0试剂盒(德国Roche Applied Science公司)从血细胞样品中提取基因组DNA.利用基质辅助激光解吸附电离飞行时间质谱对IL-10基因的3个SNP位点rs1800871、rs1800872和rs1800896进行基因分型,正/反向(F/R)引物设计见表1.所有程序严格按照用户手册(Sequenom,美国)进行.在基因分型测定过程中,采用阴性对照和参考DNA作为质量控制措施.此外,随机选择约5%的样本重复进行基因分型,作为实验重复对照.根据平台的结果,基因分型率为100%.

表1 3个SNP位点的引物序列
1.3 统计方法

2 结果与分析
2.1 HBV相关的一般特征
运用Metavir系统对212名研究对象的肝组织炎症活动度进行评分,并根据评分结果将研究对象分为对照组(n=151)和病例组(n=61).HBV相关的一般特征比较分析表明(表2):对照组与病例组在性别分布和HBV家族史上差异显著(p<0.05);而年龄和HBV基因型分布在两组间差异不显著(p>0.05).

表2 212名慢性HBV感染者的人口学特征
2.2 IL-10基因各SNP位点的等位基因分布
利用基质辅助激光解吸附电离飞行时间质谱对IL-10基因的3个SNP位点进行基因分型,各SNP位点的等位基因分布频率见表3:其中,rs1800871和rs1800872位点的等位基因频率分布在病例组和对照组间差异显著(p<0.05);而rs1800896位点的等位基因频率分布在两组间差异不显著(p>0.05).这初步说明rs1800871和rs1800872位点与HBV感染后炎症程度相关,而尚不能认为rs1800896位点与炎症程度相关.

表3 IL-10基因SNP位点的等位基因分布
2.3 IL-10基因各SNP位点的基因型分布
经检验IL-10基因各SNP位点的基因型频率在病例组和对照组中均符合Hardy-Weinberg平衡(p>0.05).如表4所示,rs1800871和rs1800872位点的各基因型在病例组和对照组间分布差异显著(p<0.05),rs1800896位点的各基因型在两组间分布差异不显著(p>0.05).rs1800871位点上,相较于基因型AA,基因型GG在HBV感染后炎症重度化风险更高(OR为4.238,p<0.05);基因型AG同样提高了炎症重度化的风险(OR为2.410,p<0.05).rs1800872位点上,与基因型TT相比,基因型GT和GG增加了HBV感染后炎症重度化的风险,OR分别为2.270和3.202,差异显著(p<0.05);而rs1800896位点的各基因型分布差异不显著(p>0.05).
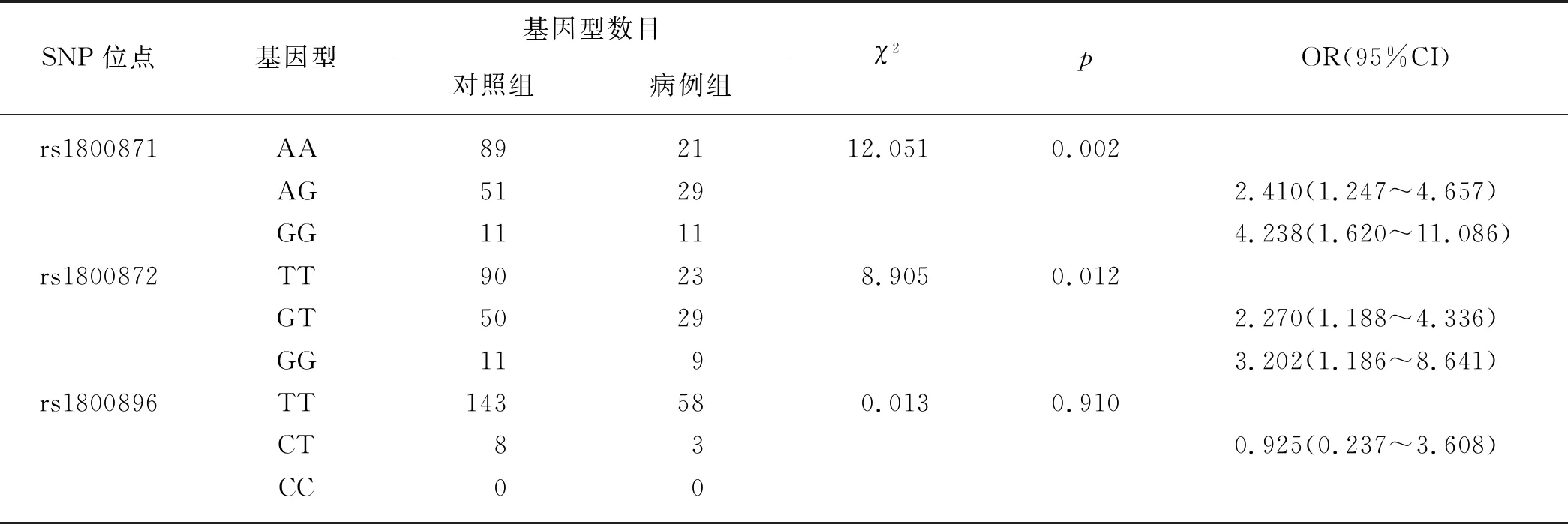
表4 IL-10基因各SNP位点的基因型分布
2.4 IL-10基因各SNP位点的单倍型分析
运用SHEsis在线遗传分析软件对IL-10基因位点进行连锁不平衡分析(频率低于0.03的单倍型不分析其分布的差异),结果显示,rs1800871、rs1800872和rs1800896这3个SNP位点间存在连锁不平衡(标准化后各单倍型分布频率之间的差异D′>0.813,r>0.145).如表5所示,IL-10基因的4个单倍型A-G-T、A-T-T、G-G-T和G-T-T在病例组和对照组间的分布差异显著(p<0.05).其中,单倍型A-G-T、G-G-T和G-T-T均可使HBV感染后炎症重度化的风险显著提高,OR分别为8.717,1.670和14.436(p<0.05);而单倍型A-T-T则显著降低了炎症重度化的风险,OR为0.346(p<0.05).

表5 IL-10基因单倍型分布比较
2.5 3种遗传模型下IL-10基因多态性与HBV感染发展的关联
因本研究中3个SNP位点的纯合子突变患者数量有限,故运用显性模型将纯合子突变和杂合子突变归为一组.以rs1800871为例,基因型AA为对照组,基因型AG+GG为病例组.如表6所示,病例组和对照组相比,AG+GG型和AA型的差异显著(p<0.05),相较于基因型AA携带者,基因型AG+GG携带者在HBV感染后炎症重度化的风险提高(OR为2.734).在显性、隐性和相加3种遗传模型下比较各SNP位点在病例组和对照组中的关联性,结果显示(表6):除上述rs1800871显性模型外,rs1800872显性模型下,与基因型TT携带者相比,基因型GT+GG携带者在HBV感染后炎症重度化的风险提高(OR为2.438,p<0.05);而rs1800871隐性模型下,与基因型GG携带者相比,基因型AA+AG携带者在HBV感染后炎症重度化的风险降低(OR为0.357,p<0.05);其他模型在病例组和对照组间的差异均不显著(p>0.05).

表6 显性、隐性和相加模型下IL-10基因多态性与HBV感染的关联
3 讨论与结论
宿主免疫系统影响HBV感染后的转归,而细胞因子与机体免疫系统功能状态密切相关.以往研究表明,细胞因子的多态性会影响其自身mRNA的表达水平,因此细胞因子基因的SNP与多种肝炎相关疾病的分子机制密切相关[13].IL-10被认为是一种重要的抗炎介质及免疫抑制因子,可抑制促炎介质的合成和活性,并与抗炎介质有协同作用[16].
有研究显示IL-10基因位点的突变会对该位点所在区域与转录因子的结合造成影响, 从而影响mRNA的转录,使得IL-10基因在个体间的表达水平存在差异[17].而突变对IL-10基因表达水平产生的影响尚存在争议:向瑜等[18]研究发现rs1800872位点上的突变基因型GG促进IL-10基因高表达,野生基因型TT则引起其低表达.王云英等[19]发现位点的基因突变会显著降低IL-10基因的表达水平.王少扬等[20]研究发现,rs1800872位点上的野生型T等位基因与肝功能损害和激发免疫应答反应有一定相关性;而rs1800871位点上的突变型G等位基因则与免疫耐受相关,提示IL-10基因多态性可影响 HBV感染者病情发展.陈望等[21]在深圳地区进行的一项IL-10基因血清表达水平及其SNP与HBV感染的研究显示:rs1800872位点上的突变基因型GG和G等位基因可能是该地区的HBV易感基因,且与IL-10基因表达水平有关;rs1800871位点上A被G替换和rs1800872位点上T被G替换,可使IL-10基因在不同个体间的表达水平出现差异;IL-10基因的低表达可能使机体在HBV感染后炎症程度加重,而IL-10基因的高表达可能使HBV感染出现持续性和慢性化.上述研究结果间存在差异可能受到研究对象族群不同和样本量大小等因素的影响.
本研究探讨了IL-10基因SNP与慢性HBV感染后转归的相关性.研究结果显示rs1800871和rs1800872位点上的等位基因和基因型在病例组和对照组间频率分布差异显著(p<0.05).在rs1800871位点上,与AA基因型携带者相比,AG和GG基因型携带者炎症重度化的风险分别提高至2.410倍和4.238倍;在rs1800872位点上,与TT基因型携带者相比,GT和GG基因型携带者炎症重度化的风险分别提高至2.270倍和3.202倍;而在rs1800896位点上,等位基因和基因型在两组间频率分布差异不显著(p>0.05).rs1800871和rs1800872位点显性模型及rs1800871位点隐形模型在病例组和对照组间差异均显著(p<0.05),AG+GG和GT+GG基因型携带者炎症重度化的风险提高,而AA+AG基因型携带者炎症重度化的风险则降低.A-G-T、G-G-T和G-T-T单倍型携带者炎症重度化的风险分别提高至8.717倍、1.670倍和14.436倍,而A-T-T单倍型携带者则降低了炎症重度化的风险(OR为0.346).
综上所述,IL-10基因rs1800871和rs1800872位点的SNP与HBV感染后炎症重度化相关,而rs1800896位点与炎症转归尚不能证明有显著相关性,提示IL-10基因多态性与HBV感染后临床发展过程的相关性可作为病毒感染后临床发展的一个预测因素.本研究样本量有限,还需要增大样本量进一步深入研究;同时,将重点关注IL-10基因SNP对IL-10基因转录活性及血清表达水平的调控对乙型肝炎转归产生影响的机制.
