α粒子与酒精联合作用致肝细胞恶性转化的影响
2021-11-08刘红艳王婧洁张慧芳党旭红张忠新张睿凤原雅艺董娟聪柴栋良李幼忱
刘红艳,王婧洁,张慧芳,党旭红,王 超,张忠新,张睿凤,原雅艺,任 越,董娟聪,柴栋良,李幼忱
中国辐射防护研究院,山西 太原 030006
随着我国核技术应用产业的发展,电离辐射对人类健康的影响越来越受到重视。α粒子由于具有较高的传能线密度(LET),会导致较强的相对生物效应能(RBE),它对人体健康的影响一直是职业健康中关注的重点[1-4]。超铀核素在核材料生产、MOX燃料制造、乏燃料后处理以及高放废物处理与处置中对人体健康存在潜在风险[5-6]。超铀核素半衰期长,比活度高,人体内负荷小,主要考虑通过吸入或从皮肤进入体内后产生的α粒子辐射能量沉积对组织器官的影响,肝脏是其重要的靶器官[7-8]。众所周知,肝脏是人体代谢的主要场所,且几乎是酒精代谢的唯一场所,涉核工作人员的饮酒习惯是否会增加α粒子内照射对人体的健康风险,目前没有足够的人群流行病学调查和实验动物、细胞水平的数据支持[9-12]。在α粒子内照射氡的健康评估中,已有流行病学研究表明氡与吸烟的联合致肺癌作用存在协同效应,与部分细胞学和动物学实验研究结果一致[13-16]。
因此本工作拟通过α粒子辐射体,建立体外细胞实验,开展α粒子辐射、酒精单独作用和两者联合作用肝细胞的实验研究,从细胞生物学、分子生物学水平探讨单因素、联合因素对人肝细胞生物学效应的影响,为系统评价α粒子内照射风险提供基础数据。
1 实验部分
1.1 实验细胞
LO2细胞是人正常肝上皮细胞构建成的永生化细胞系,购于中国科学院上海细胞库。
1.2 辐射源
苏州大学241Am α粒子辐射源装置,如图1所示,α粒子源几何尺寸为36 mm×4 mm,是有效直径为20 mm的面源,其活度为5.7×106Bq,文献[17]计算给出表面剂量率为0.138 Gy/min。面源与盖玻片盘平行放置,两者间距离为10 mm。
1.3 仪器和试剂
CO2细胞培养箱、酶标仪,Thermo 公司;超洁净工作台,苏州安泰空气技术有限公司;实时荧光定量 PCR 扩增仪,Bio-Rad 公司;倒置相差显微镜,OLYMPUS公司;流式细胞仪,Beckman公司;高速冷冻离心机,Sigma公司。
RPMI-1640 培养基、胰蛋白酶、胎牛血清、青霉素和链霉素,上海生工;Trizol(主要成分为苯酚,含有8-羟基喹啉、异硫氰酸胍、β-巯基乙醇等抑制内源和外源RNA酶)、RNA 反转录、荧光定量PCR试剂盒,天根公司;细胞周期试剂盒、CCK-8试剂盒,凯基生物;酒精,分析纯,南京碧云天生物工程有限公司;Transwell板、Matrigel基质胶,美国康宁公司。
1.4 实验方法
1.4.1细胞培养 LO2人肝细胞在37 ℃恒温5%(体积分数)CO2环境下的细胞培养箱中,用含10%(体积分数)胎牛血清的RPMI-1640培养基进行培养,贴壁细胞生长至培养瓶底面积的80%~90%,经0.25%(质量分数)胰蛋白酶消化,进行1∶3传代,传代一次计1代(P1),培养细胞瓶于倒置相差显微镜下观察细胞状态。
1.4.2细胞生长增殖检测 细胞生长增殖采用CCK-8试剂盒进行检测,已广泛应用于细胞毒理试验。首先制作人肝细胞生长标准曲线,取对数生长期细胞,用血球计数板计数细胞浓度,并将肝细胞密度分别调整为每毫升1万个、2万个、4万个、8万个、16万个,每孔分别接种100 μL于96孔板进行培养,每组设置5个复孔。待接种细胞贴壁后,加入CCK-8试剂,37 ℃孵育3 h后,采用酶标仪于490 nm 波长处测量吸光度(OD)值。
1.4.3α粒子辐照剂量筛选 在文献[18-19]调研的基础上,初步确定了5个剂量点对肝细胞进行α辐照,剂量分别为0.05、0.10、0.25、1.00、2.00 Gy,根据辐照剂量=剂量率×辐照时间,α源的剂量率为0.138 Gy/min,计算出各实验点所需辐照时间分别为21.7、43.5、108.7、434.8、869.6 s,辐照前细胞接种于已消毒的玻片上,滤纸吸控细胞表面培养基,将贴有细胞的玻片面朝α源,置于α粒子辐射源装置辐照区卡槽内。辐照完成后,玻片直接放入培养基,待细胞继续生长数小时后进行消化转移至细胞培养瓶培养。对照组细胞同时置于玻片接受假辐照(0 Gy),辐照后48 h进行细胞增殖活力检测,显微镜动态观察细胞形态和生长状况,筛选合适的辐照剂量进行后续α粒子辐照实验。
1.4.4酒精作用浓度筛选 在文献[20-22]调研的基础上,根据中国人群饮酒习惯,计算血液和肝脏代谢酒精浓度,初步采用酒精浓度(体积百分比)0.5%、1.0%、2.0%、3.0%、4.0%、5.0%、6.0% 和7.0%的细胞培养基进行肝细胞酒精作用24 h,结束后换成正常培养基,进行细胞增殖活力检测,显微镜动态观察细胞形态和生长状况,筛选合适的酒精浓度和作用时间进行后续酒精作用肝细胞实验。
1.4.5联合作用方式及实验分组 根据α粒子辐射和酒精单因素作用模型,建立复合作用方式。实验分为4组:对照组(不进行任何处理);辐射组(单纯α粒子辐照);酒精组(单纯酒精处理);复合组(辐射组+酒精组,即细胞先经α粒子辐照后再经酒精作用处理)。实验用细胞经消化后进行传代,采用相同代数的各组细胞,且均处于40代以内,进行细胞生物学指标检测。
1.4.6细胞生物学效应
(1) 流式细胞术检测细胞周期
细胞周期是反映细胞生长增殖状态的重要指标之一。采用PI染料进行DNA染色,利用流式细胞术检测肝细胞周期。用Multicycle for windows 32-bit软件统计分析人肝细胞在G0/G1、S、G2/M这3个不同时期的细胞占比。每个实验样品设3个平行样,收集人肝细胞约1 × 106个,加入无水乙醇过夜固定肝细胞,用预冷的磷酸盐缓冲溶液(phosphate buffered saline, PBS)清洗细胞去掉乙醇;加PI染料,室温避光孵育30 min后,用流式细胞仪进行定量检测。
(2) 细胞迁移和侵袭能力检测
细胞迁移和侵袭实验是反映细胞发生恶性转变的重要指标。采用Transwell实验测定细胞迁移和侵袭能力。细胞迁移检测:细胞接种于24孔板8 μm孔径滤膜的chamber上室,下室加入500 μL含胎牛血清培养基,避免起泡产生。每个实验组接种3个平行样,于37 ℃培养箱培养24 h后终止,用0.1%(质量分数)结晶紫染色,棉签擦去上室内膜上的细胞,将Transwell小室反过来底朝上,显微镜下观察小室底膜上附着细胞,随机选取5~10个视野,显微镜拍照,记录图像中细胞数量。检测细胞侵袭能力时,Transwell小室底部膜需要包埋 Matrigel基质胶,将冰上缓慢溶解的Matrigel基质胶与无血清培养基按体积比1∶8稀释后,加入小室底部,室温待其凝固,再接种细胞悬液,其余步骤与细胞迁移检测一致。采用Image J图像处理软件进行肝细胞数量自动计数。
(3) mRNA分子水平表达
采用实时荧光定量聚合酶链锁反应(Real-time qPCR)测定肝细胞恶性转化相关mRNA表达水平。在文献[23-25]调研的基础上,根据美国国家生物技术信息中心(NCBI)DNA序列数据库GeneBank公布的序列,设计Real-time qPCR引物,结果列入表1。实验细胞待生长至80%~90%,用PBS冲洗3遍后,直接加入Trizol试剂,提取细胞总RNA,并逆转录成 cDNA,并以此为模板进行 Real-time qPCR 检测,每个样本设置3个重复样,结果采用ΔΔCT法进行分析。
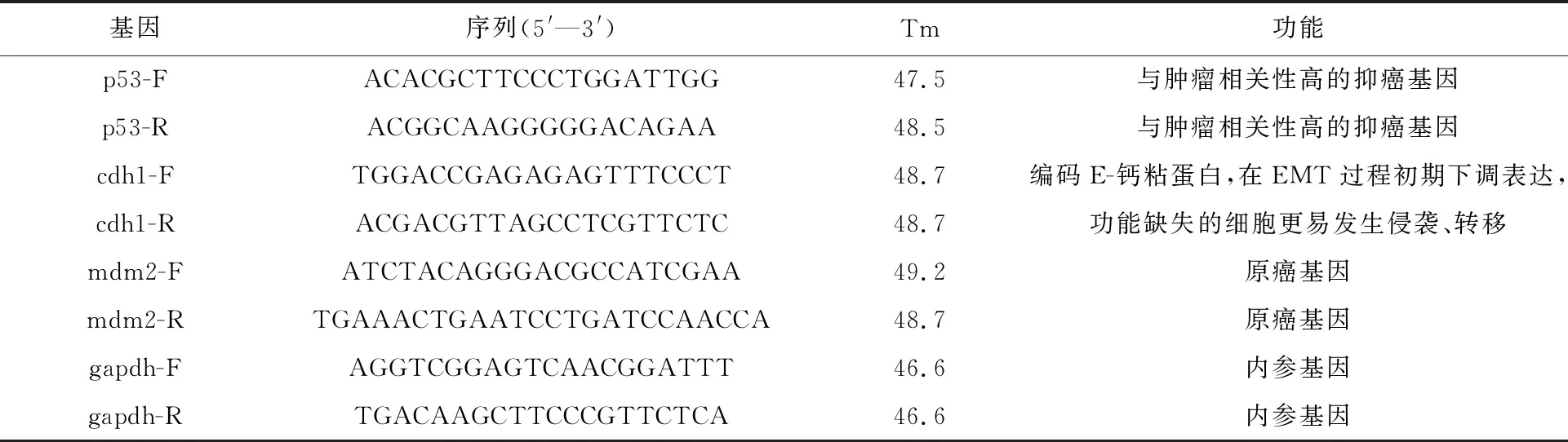
表1 引物序列
1.5 统计学分析
2 结果和讨论
2.1 α粒子辐照剂量
LO2人正常肝细胞在含10%新生胎牛血清RPMI-1640培养基中正常生长,于倒置显微镜下观察细胞形态,呈上皮样、多角型,贴壁生长状态。采用241Am放射源对肝细胞进行不同剂量(0.05、0.10、0.25、1.00、2.00 Gy)α粒子辐照,辐照后48 h检测肝细胞存活分数,结果示于图2。由图2可知:与对照组(NC)比较,0.05 Gy组细胞活力差异不显著(P>0.05);0.10、0.25、1.00 Gy组肝细胞的存活分数低于对照组,差异不显著(P>0.05);2.00 Gy组肝细胞存活分数明显低于对照组,差异有统计学意义(P<0.05),肝细胞接受2.00 Gy辐照后,连续培养72 h,50%的细胞呈悬浮状态,出现明显死亡。因此,选择肝细胞存活分数几乎不受影响的1.00 Gy辐射剂量进行单因素α粒子辐照细胞,记为辐射组。
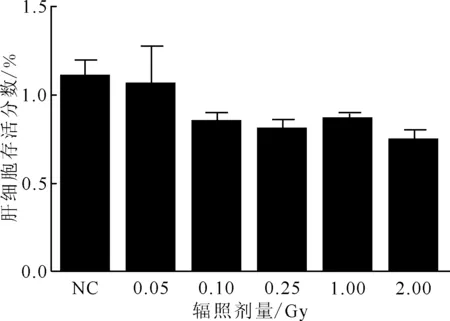
图2 不同剂量辐照48 h后对肝细胞存活分数的影响
2.2 酒精作用浓度
采用含酒精浓度(体积百分比)分别为0.5%、1.0%、2.0%、3.0%、4.0%、5.0%、6.0%和7.0%的细胞培养基作用于肝细胞,与对照组比较,结果示于图3。由图3可知:酒精作用24 h后,0.5%和1.0%酒精作用组肝细胞存活分数低于对照组,但差异不显著(P>0.05);2.0%和3.0%酒精作用组肝细胞存活分数低于对照组,差异有统计学意义(P<0.05),在作用5 min后,长梭型贴壁细胞变圆,4 h 后形态恢复正常;4.0%~7.0%酒精作用组肝细胞存活分数显著低于对照组。因此,选择肝细胞存活分数几乎不受影响的1.0%酒精进行作用,记作酒精组。

图3 不同浓度酒精处理24 h后对肝细胞存活分数的影响
2.3 α粒子与酒精联合作用人肝细胞
在以上筛选的单因素辐射和酒精作用肝细胞模型的基础上,进行α粒子辐照和酒精联合作用,组成了复合作用方式:细胞先接受α粒子辐照后再经酒精作用。辐照剂量为1.00 Gy/次,累计辐照两次后经酒精作用,采用含1.0%酒精浓度的培养基培养,每代进行一次酒精处理,隔三天传代一次。
2.4 细胞生物学效应
2.4.1细胞周期 流式细胞术检测各实验组肝细胞周期示于图4。由图4可知:与对照组比较,辐射组S期细胞比例增加(P<0.05)、G2/M期细胞比例减少(P<0.05),差异具有统计学意义;酒精组与复合组肝细胞处于G0/G1期的细胞比例均减少、S期细胞比例均增加,差异均具有统计学意义(P<0.05)。辐射组与酒精组比较,G0/G1期细胞比例增加、S期和G2/M期细胞比例减少,差异均具有统计学意义(P<0.05)。复合组与辐射组比较,G0/G1期细胞比例减少、S期细胞比例增加,且有显著性差异(P<0.05),各组的肝细胞周期百分比结果示于图5。由图5可知:辐射组细胞出现G0/G1期阻滞,DNA复制前的检查修复需要更长时间,与辐射致DNA损伤有关。与单因素组相比,复合组肝细胞G1期逃逸至S期,细胞周期失衡。
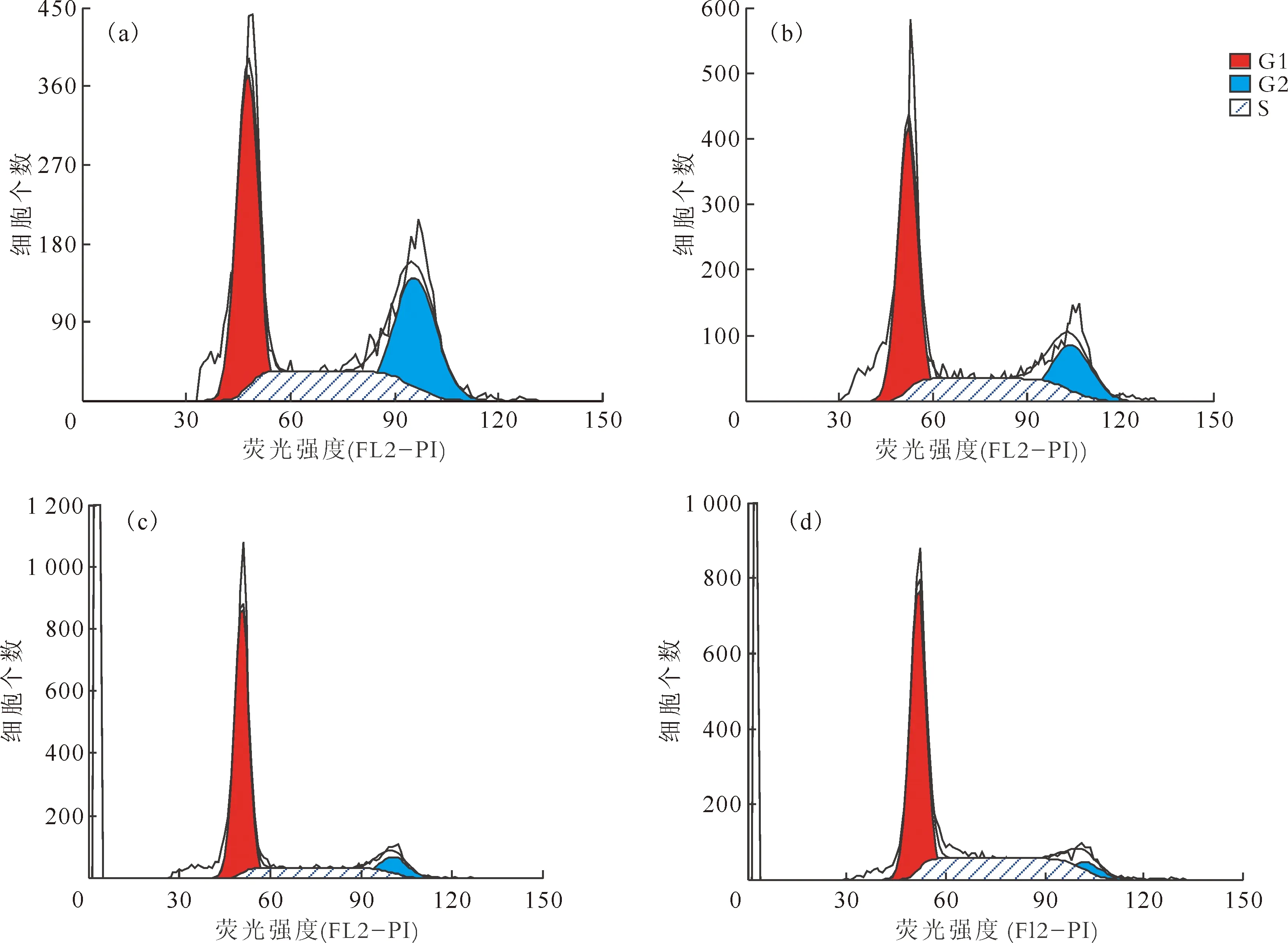
(a)——对照组,(b)——酒精组,(c)——辐射组,(d)——复合组
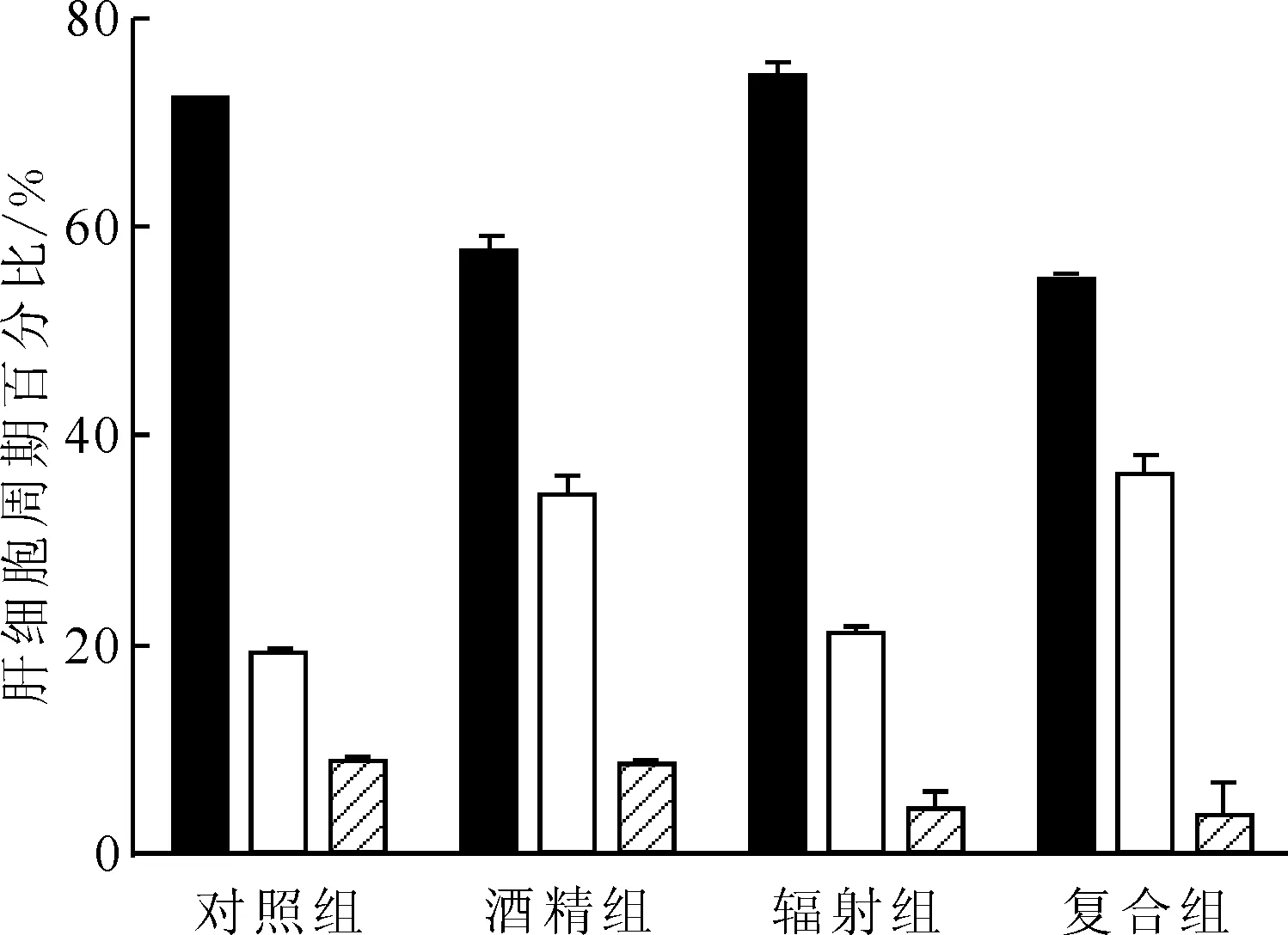
■——G0/G1,□——S,——G2/M
2.4.2细胞迁移和细胞侵袭 Transwell实验测定各实验组肝细胞发生迁移和侵袭的细胞数量示于图6。由图6可知:与对照组比较,辐射组、复合组肝细胞均发生了细胞迁移,差异有统计学意义(P<0.05);与酒精组比较,辐射组发生迁移的细胞数量增加,差异有统计学意义(P<0.05),复合组发生迁移和侵袭的细胞数量也均增加,差异有统计学意义(P<0.05、P<0.001);与辐射组比较,复合组发生侵袭的细胞数量增加,差异有统计学意义(P<0.05),复合组发生侵袭的细胞数量最大,有着明显的恶性转化趋势,提示α粒子辐照后再进行酒精处理,酒精增加了肝细胞的侵袭能力,诱导细胞发生恶性转化。
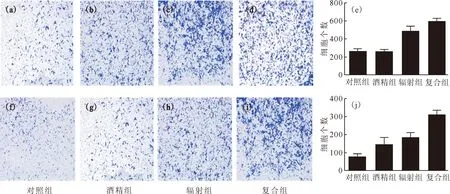
(a)—(d)、(f)—(i)为显微镜成像图片
2.4.3分子生物学效应 用实时荧光定量聚合酶链锁反应(Real-time qPCR)的方法,检测与细胞恶性转化相关的抑癌基因p53和原癌基因mdm2、细胞粘附蛋白相关基因cdh1在mRNA水平的表达,结果示于图7。由图7可知:与对照组比较,单因素和复合组细胞p53基因和cdh1基因在mRNA水平表达降低,mdm2基因表达升高,差异有统计学意义(P<0.05);与酒精组比较,复合组肝细胞p53、cdh1和mdm2基因表达有显著差异(P<0.001);与辐射组细胞比较,复合组细胞p53基因和mdm2基因表达有显著差异(P<0.05),提示α粒子和酒精均诱导肝细胞发生恶性转化趋势,复合作用明显高于单因素作用,即辐照后酒精的作用促进了肝细胞原癌基因mdm2的高表达和抑制了抑癌基因P53的表达,从分子水平介导肝细胞发生恶性转化。
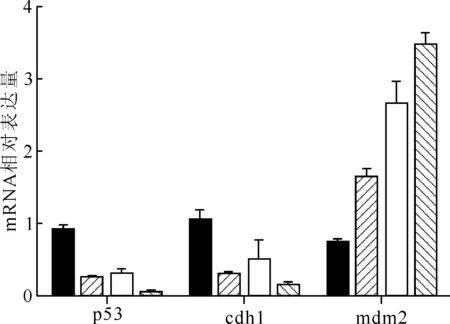
■——NC,——酒精组,□——辐射组,——复合组
3 结 论
研究发现α粒子辐射和酒精均能诱导肝细胞发生恶性转化趋势,复合因素作用下肝细胞原癌基因mdm2高表达,抑癌基因p53和细胞粘附相关基因cdh1低表达,发生明显的恶性转化趋势。提示α粒子辐照后再进行酒精作用的肝细胞发生恶性转化的风险增高,可能是酒精影响了肝细胞表面E型粘连蛋白的表达,导致细胞之间粘连性降低,促进细胞发生迁移和侵袭。因此,在评价α粒子内照射对健康的影响时需要考虑职业人员的饮酒习惯。
