人参皂苷Rg1治疗高糖损伤大鼠视神经细胞的机制研究:基于生物信息学分析△
2021-11-08唐平陈春妹陈执李蒙恩黄雄高何泽银李雨航刘梅林
唐平 陈春妹 陈执 李蒙恩 黄雄高 何泽银 李雨航 刘梅林
糖尿病视网膜病变(DR)常见于糖尿病进展的 5~10年[1],其伴随的视神经损伤常发生于视网膜病变的早期[2],患者常见症状为视物模糊,视力下降甚至失明;临床上治疗方法主要包括保护微血管治疗,抗炎治疗,降脂治疗,中医治疗。目前循证医学发现具有“活血通络”中医辨证理论的药物主要包括三七,水蛭,丹参,鸡血藤。人参是传统中药最具代表性的药物,具有“大补元气”“益肾助阳”的作用。既往研究证实人参皂苷Rg1能够调节DR诱导的视神经损伤[3-4],但具体机制尚不清楚。本研究拟通过生物信息学技术探究人参皂苷Rg1治疗高糖诱导的大鼠视神经细胞损伤的潜在靶点及作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物清洁级雄性Wistar大鼠16只,体重200~250 g,2周龄,所有实验动物确保无引起眼部缺血性病变的疾病,按照国际及本院的动物伦理法则进行实验。
1.1.2 主要试剂与仪器DMEM/F12培养基(美国Gibco公司),新生胎牛血清(美国Clark公司),CCK-8细胞增殖检测试剂盒(美国Sigma公司),胰蛋白酶消化液、青链霉素双抗、BCA蛋白定量检测试剂盒、上样缓冲液5×(北京碧云天公司),人参皂苷Rg1纯化物(北京源叶生物公司),细胞培养箱(德国Binder公司),Eclipse倒置显微镜(日本尼康公司),伯乐电泳转印系统及伯乐ECL成像系统(美国伯乐公司)。
1.2 方法
1.2.1 生物信息学分析通过PubMed compound数据库(https://www.ncbi.nlm.nih.gov/pccompound/)检索人参皂苷Rg1分子结构式,使用SwissTarget数据库(http://old.swisstargetprediction.ch)将获得的分子结构式进行疾病靶点的预测,使用PubMed 数据库(https://www.ncbi.nlm.nih.gov/gds/)检索高糖损伤视神经相关数据,设置健康人员为对照组,视神经损伤患者为损伤组,采用GEO 2R在线分析工具获取差异基因的表达并与SwissTarget数据库获得的预测基因进行集合。将获得的基因集合使用DAVID在线分析工具进行KEGG及GO富集分析,以气泡图及通路图展示获得的相关生物过程、分子功能及信号通路。
1.2.2 大鼠视神经细胞分离及原代培养饲养健康雄性Wistar大鼠,至体重达350~400 g时采用体积分数5%异氟烷进行气体麻醉,参考文献[5]行手术分离大鼠双侧视神经,使用1.25 g·L-1胰蛋白酶消化视神经20 min,去除胰蛋白酶并移至多聚赖氨酸包被的细胞培养皿中,使用含体积分数10%新生胎牛血清的DMEM/F12培养基于细胞恒温培养箱中继续培养48 h,更换培养液后继续培养48 h,通过镜下观察细胞形态学改变,如细胞轴突伸长、轴突数量增加等变化确认成功分离大鼠视神经细胞。
1.2.3 细胞分组及处理方法将获得的大鼠视神经细胞分为对照组、高糖损伤组、Rg1治疗组及Notch1抑制剂组。高糖损伤组细胞处理方法:将对数生长期的视神经细胞培养基更换为高糖DMEM/F12培养基,维持培养24 h。Rg1治疗组细胞处理方法:将对数生长期的视神经细胞培养基更换为高糖DMEM/F12培养基,同时添加终浓度为10 μg·L-1Rg1/DMSO (11000)维持培养24 h。Notch1抑制剂组细胞处理方法:将对数生长期的视神经细胞培养基更换为高糖DMEM/F12培养基,同时添加终浓度为10 μg·L-1Tangeritin(桔皮素,是Notch-1抑制剂)/DMSO(11000)维持培养24 h。
1.2.4 CCK-8法检测各组细胞增殖能力取对数生长期的各组视神经细胞按照上述处理方式分别加入96孔板中(每孔5×103个),分别继续培养24 h、48 h、72 h后,按照CCK-8细胞增殖检测试剂盒说明书,加入CCK-8稀释液,使用酶标仪在450 nm波长处检测各组细胞的吸光度(OD)。
1.2.5 免疫印迹法检测各组细胞通路蛋白的表达取对数生长期的各组视神经细胞按照上述处理方式分别加入6孔板中(每孔100×103个),继续培养24 h,使用RIPA裂解液获得细胞的全部蛋白,使用BCA法进行蛋白定量,将蛋白样品质量调整至每孔30 μg并混合终浓度1×上样缓冲液在SDS-PAGE上进行电泳(80 V电泳1 h、110 V电泳 30 min)。采用“三明治”方法将SDS-PAGE上的蛋白转印至NC膜上(110 V转膜90 min)。使用体积分数5%BSA室温封闭1 h,加入一抗过夜孵育,第2天加入体积比15000稀释的二抗室温摇育2 h,在伯乐ECL显色系统进行蛋白条带的检测,使用ImageJ软件进行相关灰度值的分析。
1.3 统计学方法采用SPSS 17.0进行统计学分析,使用单因素方差分析(ANOVA)分析各组之间的差异。在具有显著差异的情况下,使用t检验检测非配对样本间的差异。检验水准:α=0.05。
2 结果
2.1 SwissTarget 数据库预测人参皂苷Rg1治疗潜在靶点SwissTarget数据库预测结果显示,人参皂苷Rg1治疗潜在靶点共计100个,设置概率>0.01为具有统计学意义,最终获得潜在靶点16个(表1)。

表1 Rg1成分预测
2.2 Pubmed dataset数据集分析视神经损伤患者差异基因的表达检索diabetic optic neuropathy(糖尿病视神经病变)/ischemic optico-neuropathy(缺血性视神经病变)获得Pubmed dataset数据集GSE27382,使用GEO 2R工具在线分析视神经损伤患者与健康人员比较差异基因的表达,结果显示,与健康人员相比,视神经损伤患者共计出现15 480个基因差异表达,以P<0.05为数据具有统计学意义,与Rg1靶点基因进行筛选得到交叉基因分别为IL-2、PTAFR、 PSEN2 PSENEN NCSTN APH1A PSEN1 APH1B、 HSP90AA1。
2.3 Rg1潜在治疗靶点集合及KEGG、GO富集分析根据上述结果显示,将基因进行筛选,共获得31个交集基因,使用DAVID在线分析工具将获得的基因进行KEGG及GO进行富集(图1、图2),共获得生物过程15个, 细胞组分12个,分子功能2个。以P值大小作为明确相应信号通路的标志,明确 Notch 信号通路为Rg1治疗视神经高糖损伤的潜在治疗信号通路。
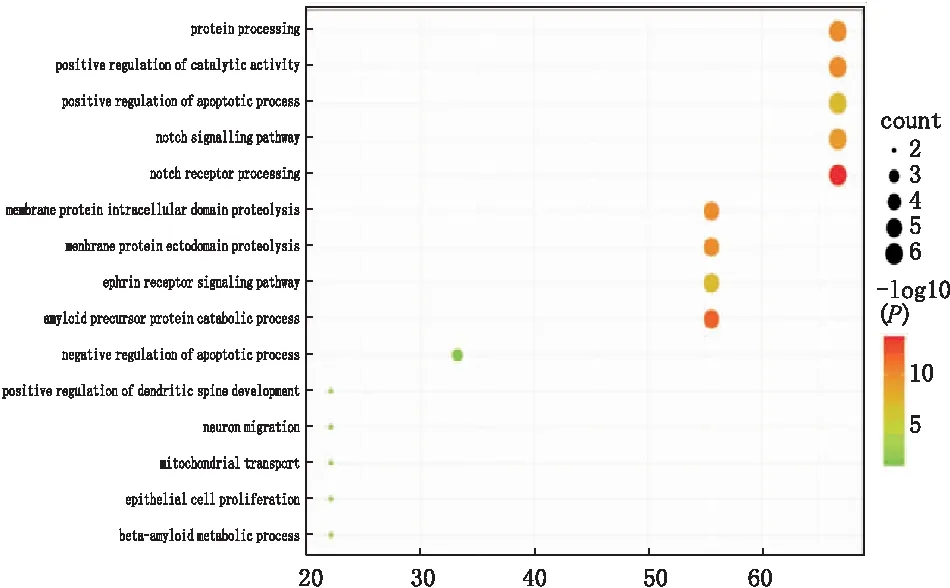
图1 Rg1潜在治疗靶点相关生物过程

图2 Rg1潜在治疗靶点相关细胞成分
2.4 各组视神经细胞增殖情况CCK-8法细胞增殖实验结果显示,与对照组相比,高糖损伤组细胞培养24 h、 48 h、 72 h后OD均减少,差异均有统计学意义(均为P<0.05)。与高糖损伤组相比,Rg1治疗组和Notch1抑制剂组细胞培养24 h、48 h、72 h后OD均增加,差异均有统计学意义(均为P<0.05)。
这表明,10 μg·L-1Rg1能够明显缓解高糖损伤引发细胞增殖活性的降低(表2)。

表2 各组大鼠视神经细胞培养24 h、48 h、 72 h后OD比较
2.5 Rg1对 Notch/MAPK 信号通路的调控作用免疫印迹法结果显示,与对照组相比,高糖损伤组Notch1受体蛋白表达下降 (P=0.002);与高糖损伤组相比,Rg1治疗组及Notch1抑制剂组Notch1受体蛋白表达均升高,差异均有统计学意义(均为P<0.05)。与对照组相比,高糖损伤组视神经细胞中MAPK、JNK、ERK1、P38受体蛋白表达均有所增加(均为P<0.05),与高糖损伤组相比,Rg1治疗组及Notch1抑制剂组视神经细胞中MAPK、JNK、ERK1、P38受体蛋白的表达均降低(图3)。灰度值分析结果显示,10 μg·L-1Rg1能够有效抑制高糖损伤诱导的Notch/MAPK信号通路的活化(表3)。

图3 各组大鼠视神经细胞中Notch/MAPK信号通路蛋白的表达

表3 各组大鼠视神经细胞中不同蛋白的条带灰度值
3 讨论
糖尿病周围神经病变(DPN)是1型、2型糖尿病的主要并发症,普遍存在于近1/3的糖尿病人群中,因缺乏早期诊断的标准及方法,通常发生在疾病进展的晚期阶段[6-7],高糖引起的视神经病变常见于DPN的晚期,临床常表现为视功能下降或障碍[8],Buranasin等[9]研究证实,高糖能够通过诱导氧化应激调控细胞的凋亡及坏死,增加心脑血管及外周血管发生病变、神经损伤及纤维化的风险。
人参皂苷Rg1 是中国传统药材人参提取物的主要成分,Chu等[10]研究发现,人参皂苷Rg1通过Nrf2/ARE信号通路能促进神经缺血性损伤的修复,Li等[11]研究证实,人参皂苷Rg1能够减少氧化应激及炎症累积诱导的神经细胞凋亡。关于Rg1治疗DPN的研究证实,Rg1能够通过降低周围神经细胞内氧化应激的产生,减弱细胞周围炎症反应,同时也有研究报道Rg1通过调控PI3K-Akt/PKB信号通路缓解DPN[3,12-14]。本研究通过SwissTarget数据库预测Rg1治疗疾病的潜在靶点共16个(表1),通过挖掘Pubmed 数据集GSE27382分析高糖损伤视神经患者群体与健康群体差异基因的表达,通过韦恩图将Rg1的潜在靶点与患病差异基因取集合得到相关基因9个,通过DAVID在线分析工具富集相关基因的生物过程、分子功能、细胞成分及信号通路,将P值的绝对值大小作为筛选条件,将Notch/MAPK信号通路选定为高糖视神经损伤的研究通路。有研究指出,Notch信号通路激活能够抑制下游的自噬及转录,加重糖尿病高糖损伤引起的坏死及凋亡[15]。
为了探索Rg1治疗DPN的机制是否与Notch/MAPK信号通路相关,采用Wistar大鼠进行视神经细胞的分离及原代培养,使用高糖培养基模拟糖尿病周围病变的视神经损伤。细胞增殖实验证实,高糖损伤组大鼠视神经细胞与对照组相比,培养24 h、48 h、72 h后细胞增殖率下降(均为P<0.05),Rg1治疗组与高糖损伤组相比,细胞增殖率出现回调(P<0.05),其趋势类似于Notch1抑制剂组,上述现象初步预测人参皂苷Rg1能够缓解高糖引起的视神经损伤。国内外多位学者研究同样证实,在Notch信号通路活化的内环境中,基因转录启动并发生活化,引起细胞的凋亡及坏死[16-18]。有文献报道,Notch激活能够诱导下游MAPK信号通路影响细胞凋亡及坏死[19-21]。为了探讨人参皂苷Rg1缓解高糖引起的视神经损伤是否通过Notch/MAPK相关信号通路,免疫印记法证实,高糖损伤组视神经细胞与对照组相比,细胞中Notch1受体蛋白表达下降,MAPK、JNK、ERK1、P38蛋白表达均上升。JNK、ERK1、P38分别作为MAPK信号通路下游关键靶点调控细胞转录,细胞因子及炎症的活化,进而影响细胞的凋亡及坏死[22-24]。Rg1治疗组的视神经细胞与高糖损伤组相比,细胞中Notch1受体蛋白表达下降趋势发生回调,细胞中MAPK、JNK、ERK1、P38蛋白表达均下降,其趋势与Notch1抑制剂组类似。这一现象证实,人参皂苷Rg1通过激活Notch1受体,影响Notch/MAPK信号通路缓解高糖引发的视神经损伤。
综上所述,本研究通过大数据分析,探究传统中药人参主要组分Rg1对高糖引发的视神经损伤的保护及作用机制,通过细胞水平机制研究证实Rg1通过影响Notch/MAPK信号通路缓解高糖引发的视神经损伤。这一现象为临床上治疗DPN引发的视神经损伤提供了新思路,但仍需进一步活体实验及临床试验证实Rg1对高糖视神经损伤的药理学作用。
综上,本研究发现人参皂苷Rg1通过激活Notch1受体影响Notch/MAPK信号通路,进而缓解高糖引起的视神经细胞损伤。
