Chemerin对恒河猴脉络膜-视网膜内皮细胞血管形成的影响及其机制研究
2021-11-08朱红军赵萌
朱红军 赵萌
糖尿病视网膜病变、老年性黄斑变性等常见致盲眼底病变均与视网膜新生血管(RNV)形成有关。 RNV的形成对人体危害较大,随着新生血管数量的增多,可能会出现玻璃体积血、视网膜脱离等不可逆转的改变,最终导致视力丧失。Chemerin属于一种脂肪细胞因子,通过与其受体ChemR23相结合作用于相应部位[1-2]。有研究表明[3-4],Chemerin可能参与糖尿病视网膜病变的发生和发展,血清Chemerin水平升高,糖尿病视网膜病变的严重程度也随之升高,但具体机制尚不清楚。也有研究表明[5-8],Chemerin能够促进内皮细胞活性氧(ROS)的表达,而ROS介导 MAPK信号通路参与细胞的多种反应,传递细胞外刺激的信号到细胞核,调节细胞的生理和病理进程,在RNV的形成过程中起着重要的调节作用。本研究通过荧光探针-二氢乙啶(DHE)法、MTT法、Western blot、基质胶(Matrigel)法、细胞划痕实验等检测Chemerin对恒河猴脉络膜-视网膜内皮细胞RF/6A血管形成的作用,并分析该作用的机制是否与ROS介导的MAPK信号通路有关,以期为Chemerin在脉络膜-视网膜新生血管形成过程中的作用提供实验依据。
1 材料与方法
1.1 细胞来源与主要试剂RF/6A细胞购买于美国模式菌种收集中心(ATCC)细胞库。Chemerin购自上海通蔚实业有限公司;ROS抑制剂N-乙酰半胱氨酸(NAC)检测试剂盒、DHE试剂盒购于江苏凯基生物公司;DMEM培养液(美国Gibco公司);基质胶(Matrigel)购于美国BD公司;一抗(GAPDH)、二抗购于武汉博士德生物工程有限公司。
1.2 细胞培养及实验分组RF/6A细胞复苏后培养于含体积分数10%胎牛血清、100×103U·L-1青霉素和100 mg·L-1链霉素的DMEM培养液中,置于37 ℃、含体积分数5%CO2培养箱中培养。当细胞密度达到80%~90%时,胰蛋白酶消化传代,用于后续实验。实验分为3组,分别为CO组:正常培养RF/6A细胞24 h;CH组:RF/6A细胞与10 μg·L-1Chemerin混合培养24 h;CN组:RF/6A细胞与10 μg·L-1Chemerin、200 μmol·L-1NAC混合培养24 h。
1.3 DHE法检测RF/6A细胞中ROS的含量将RF/6A细胞按照每孔5×105个接种于6孔板中,分组处理后,避光条件下加入含10 μmol·L-1DHE荧光探针的无血清DMEM培养液1 mL,37 ℃避光孵育1 h,清洗各组细胞,荧光显微镜下观察荧光信号强弱并拍照,记录荧光强度。每组均设6个复孔,实验重复3次。
1.4 MTT法检测RF/6A细胞增殖情况调整RF/6A细胞密度为10×103个·mL-1,以每孔200 μL细胞悬液接种到96孔板中,分组处理后,每孔加入5 g·L-1的MTT溶液20 μL,培养箱继续孵育4 h,清除培养液,每孔加入200 μL DMSO,振荡10 min,充分溶解,计算细胞增殖率。每组均设6个复孔,实验重复3次。
1.5 细胞划痕实验测定RF/6A细胞的迁移能力将RF/6A细胞按照每孔5×105个接种于6孔板中,当细胞均匀铺满底部后,用100 μL的移液枪头垂直于定位线划痕。PBS漂洗3次,倒置显微镜下拍照并记录划痕宽度(记为0 h),分组处理细胞,24 h后再进行拍照,记录划痕宽度(记为24 h),每组选取6个视野进行观测,统计3组RF/6A细胞迁移面积(像素)。每组均设2个复孔,实验重复3次。
1.6 Matrigel法检测RF/6A细胞管腔形成在超净工作台中,取96孔板,每孔加入100 μL液态Matrigel。调整RF/6A细胞至2×105个·mL-1,分组后每孔均加入细胞悬液50 μL,孵育24 h后在显微镜下观察,每组随机取5个视野照相,对形成的完整管腔计数,取平均值。每组均设置6个复孔,实验重复3次。
1.7 Western blot检测RF/6A细胞中p38MAPK蛋白含量分组处理RF/6A细胞后, PBS清洗后行细胞裂解,提取各组细胞蛋白。BCA蛋白定量,SDS-PAGE电泳后转移至PVDF膜,冰浴,加一抗(p38MAPK和GAPDH稀释度均为11000) ,第2天将膜取出后TBST洗3次,加二抗(稀释度11000)常温孵育1.5 h,滴加ECL超敏发光液,检测各组RF/6A细胞p38MAPK蛋白相对表达情况。
1.8 统计学分析数据采用SPSS 22.0软件进行分析,计量资料经检测均呈正态分布,以均数±标准差表示,多组间比较采用单因素方差分析,同一组不同时间点比较采用重复测量方差分析,组间两两比较采用LSD-t检验。检验水准:α=0.05。
2 结果
2.1 各组细胞ROS表达水平比较DHE法检测结果显示,CO组、CH组、CN组RF/6A细胞ROS表达水平分别为:19.34±1.53、209.76±19.37、103.52±9.53,3组间差异有统计学意义(P<0.05)。两两比较结果显示,CH组RF/6A细胞中ROS表达水平明显高于CO组和CN组,差异均有统计学意义(P=0.000、0.027);CN组RF/6A细胞中ROS表达水平较CO组高,差异有统计学意义(P=0.039)(图1)。
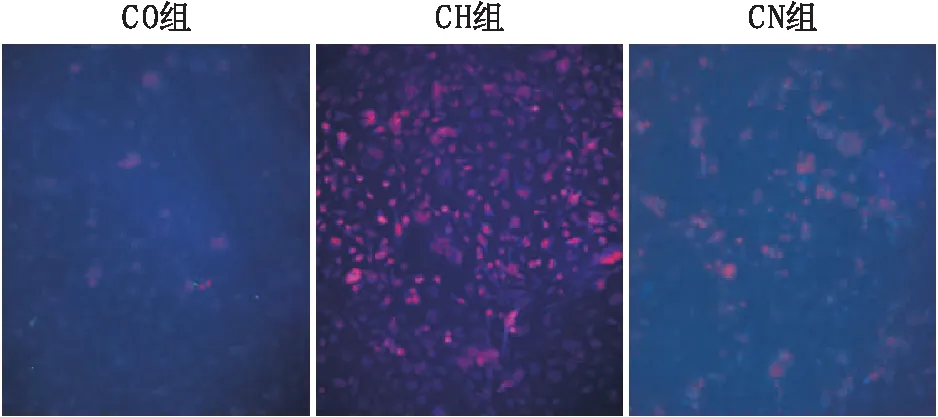
图1 各组RF/6A细胞ROS表达(×20,曝光时间2.5 s)
2.2 各组细胞增殖情况MTT法检测结果显示,CO组、CH组、CN组RF/6A细胞增殖率分别为0.276±0.097、0.982±0.209、0.509±0.115,3组间差异有统计学意义(P<0.05)。两两比较结果显示,CH组RF/6A细胞增殖能力最强,与CO组、CN组相比差异均有统计学意义(P=0.002、0.021);CN组RF/6A细胞增殖能力较CO组强,两组相比差异有统计学意义(P=0.024)。
2.3 各组细胞迁移能力细胞划痕实验结果显示,CO组、CH组、CN组RF/6A细胞迁移面积(像素)分别为31 268±1397、56 489±2653、39 684±1864,3组间差异有统计学意义(P<0.05)。两两比较结果显示,CH组RF/6A细胞迁移能力显著高于CO组、CN组,差异均有统计学意义(P=0.005、0.017);CN组RF/6A细胞迁移能力高于CO组,两组相比差异有统计学意义(P=0.029)(图2)。

图2 各组RF/6A细胞划痕实验检测结果
2.4 各组细胞管腔形成Matrigel法检测结果显示,CO组、CH组、CN组RF/6A细胞管腔形成数量分别为(1.06±1.12)个、(6.04±2.24)个、(3.08±3.67)个,3组间差异有统计学意义(P<0.05)。两两比较结果显示,CH组RF/6A细胞管腔形成数量显著高于CO组、CN组,差异均有统计学意义(P=0.012、0.032);CN组RF/6A细胞管腔形成数量高于CO组,差异有统计学意义(P=0.034)(图3)。

图3 Matrigel法检测各组RF/6A细胞管腔形成情况(×200)
2.5 Western blot检测RF/6A细胞中p38MAPK的蛋白表达Western blot检测结果(图4)显示,CO组、CH组、CN组RF/6A细胞中p38MAPK蛋白相对表达量分别为0.42±0.06、1.09±0.09、0.73±0.07,3组间差异有统计学意义(P<0.05)。两两比较结果显示,CH组RF/6A细胞中p38MAPK蛋白相对表达量显著高于CO组、CN组,差异均有统计学意义(P=0.002、0.007);CN组RF/6A细胞中p38MAPK蛋白相对表达量高于CO组,两组相比差异有统计学意义(P=0.009)。

图4 各组RF/6A细胞中p38MAPK蛋白表达
3 讨论
RNV多与眼部组织缺血缺氧及炎症反应形成有关[9],与正常的眼部血管构造不同,RNV结构不稳定,易破裂出血,从而导致玻璃体积血、视网膜脱离等,若治疗不及时很容易造成失明[10]。在糖尿病视网膜病变中RNV的出现预示着糖尿病视网膜病变进入增生期,患者的病情加重。RNV形成原因复杂,具体机制尚不明确,可能与多种因素相关,其基本过程是血管内皮细胞被激活,使血管舒张、通透性增加,进而血管内皮细胞增殖、迁移,新生血管管腔形成,最后形成血管外膜[11]。
本研究结果显示,CH组RF/6A细胞增殖率显著高于CO组,CH组RF/6A细胞迁移能力显著高于CO组,CH组RF/6A细胞管腔形成数量显著高于CO组(均为P<0.05),说明Chemerin可以促进RF/6A细胞的增殖、迁移和新生血管管腔形成;而CN组RF/6A细胞的增殖率、迁移能力、管腔形成数量均较CH组降低,说明抑制Chemerin表达可抑制RNV形成。
Chemerin在糖尿病视网膜病变患者体内发挥显著作用,其原理可能是高糖促进患者体内ROS/p38MAPK的表达,进而促进ChemR23受体的表达,使视网膜血管内皮新生细胞加速生长[12-13]。连海燕等[14]研究显示,氧化应激中产生的ROS在多种条件下都是自噬的重要调节因子,它能诱导自噬发生,而自噬能通过不同的信号通路来缓解氧化应激造成的损伤,从而保护细胞存活。Zhao等[15]研究表明,Chemerin通过提高内皮细胞中线粒体ROS的产生速率提高ROS的含量,增加氧化应激水平,上调MAPK等信号通路蛋白表达,促进新生血管形成。ROS是介导新生血管形成的关键信号分子,ROS水平的增加可能也是Chemerin促进新生血管形成的机制之一。近年来多项研究发现,Chemerin与自噬之间存在激活关系,自噬在新生血管形成中起到关键作用,通过抑制自噬能够抑制动脉血管内皮细胞新生血管的形成[16-17]。ROS是激活细胞自噬的重要条件,自噬能够通过清除被ROS损伤的细胞器、蛋白质,从而减轻ROS对细胞造成的损害,对细胞起保护作用。在体内,如果ROS 清除系统出现问题导致ROS增加,机体就会相应地升高自噬水平从而降解ROS。如果自噬过程被阻断,就会引起细胞内ROS 水平的升高,因而自噬是促进RNV形成的重要因素[18]。本研究中,CH组RF/6A细胞中ROS表达水平明显比CO组和CN组高,p38MAPK的蛋白含量也显著高于CO组和CN组。可见,细胞内自噬的平衡以及ROS介导的自噬与内皮细胞增殖之间的关系对视网膜血管性疾病的发展至关重要。
综上所述,Chemerin导致RF/6A细胞ROS水平升高,激活p38MAPK蛋白表达,促进RNV形成;抑制ROS后,p38MAPK活性降低,提示Chemerin促进RNV的机制与ROS介导的MAPK通路激活有关。
