lncRNA EGOT靶向miR-320a对LPS诱导肺泡上皮细胞炎症反应和细胞凋亡的影响
2021-11-08吴云飞张智慧梁鸿章陈旭源
吴云飞,钟 海,张智慧,梁鸿章,陈旭源,李 想,吴 旭
急性肺损伤(ALI)是一种流行性炎症性肺疾病,是急性呼吸窘迫综合征(ARDS)的重要原因,其发病率和重症病人死亡率均很高。尽管在治疗策略方面已取得重大进展,但ARDS和ALI的年死亡率仍为40%,且医疗费用较高[1]。ALI作为一种进展性疾病,以促炎性因子的过度产生、炎症细胞浸润以及肺泡上皮细胞的凋亡为主要特征[2]。因此,有效地控制肺泡上皮细胞炎症和凋亡对改善病人预后意义重大。长链非编码RNA(lncRNA)通过染色体重塑、转录和转录后加工等多种方式参与调节基因表达,在广泛的生物学领域具有重要功能[3-4]。研究[5]证实,在低氧诱导的心肌细胞损伤中lncRNA嗜酸性粒细胞转录因子(EGOT)低表达,脑钠肽能通过促进lncRNA EGOT表达,抑制促凋亡蛋白表达从而缓解低氧诱导的心肌细胞损伤。lncRNABase网站在线预测显示,EGOT与miR-320a之间存在结合位点。既往研究[6]显示,高氧刺激后肺泡上皮细胞微泡中miR-320a表达增加促进巨噬细胞介导的肺部炎性反应。基于以上研究,本研究探讨lncRNA EGOT、miR-320a在ALI/ARDS中的作用及可能机制,以期为ALI/ARDS提供有效的临床治疗策略。
1 材料与方法
1.1 材料 肺泡上皮细胞A549购自中科院上海细胞库;RPMI-1640、胎牛血清购自北京索莱宝生物;脂多糖(LPS)购自美国Sigma公司;miR-320a抑制物(anti-miR-320a)及其阴性对照(anti-miR-NC)、EGOT过表达质粒(pcDNA-EGOT)、质粒空载体(pcDNA)、miR-320a模拟物(miR-320a mimics)及其阴性对照(miR-NC)、EGOT小干扰RNA(si-EGOT)及其阴性对照(si-NC)、双荧光素酶报告基因载体购自广州锐博生物;白细胞介素(IL)-6、IL-1β酶连免疫吸附测定(ELISA)试剂盒购自北京博凌科为生物;Annexin V-FITC/PI凋亡检测试剂盒购自南京凯基生物;兔抗人B淋巴瘤-2(Bcl-2)抗体、兔抗人Bcl相关X蛋白(Bax)抗体、兔抗人甘油醛-3-磷酸脱氢酶(GAPDH)抗体、羊抗兔IgG购自上海艾博抗生物公司。
1.2 方法
1.2.1 细胞培养和实验分组 A549细胞采用含10%胎牛血清的RPMI-1640培养基置于含5% CO2、37 ℃培养箱中培养。将对数期A549按照2×105个/孔接种24孔板,1 h后加入LPS使其终浓度为10 mg/L孵育细胞24 h,记为LPS组[7],同时设置不加LPS对照(Con)组,收集细胞进行后续试验。为证实lncRNA EGOT、miR-320a在LPS诱导的A549细胞炎症反应和凋亡中的作用,利用脂质体转染法将pcDNA、pcDNA-EGOT、anti-miR-NC、anti-miR-320a、pcDNA-EGOT+miR-NC、pcDNA-EGOT+miR-320a mimics分别转染A549细胞,用含10 mg/L LPS的细胞培养液处理转染成功的细胞24 h,依次记为LPS+pcDNA组、LPS+pcDNA-EGOT组、LPS+anti-miR-NC组、LPS+anti-miR-320a组、LPS+pcDNA-EGOT+miR-NC组、LPS+ pcDNA-EGOT+miR-320a组,收集细胞进行后续试验。
1.2.2 实时荧光定量PCR(RT-qPCR)检测lncRNA EGOT和miR-320a表达 使用Trizol试剂盒提取总RNA含量。PrimeScript RT试剂盒将总RNA反转录为cDNA,应用SYBR®Premix Ex TaqTMⅡ试剂盒通过ABI7500系统进行RT-qPCR。U6作为miR-320a的内参,GAPDH作为lncRNA EGOT内参,2-△△CT法计算lncRNA EGOT和miR-320a相对表达量。U6引物F:5′-GTG ATC ACT CCC TGC CTG AG-3′,R:5′-GGA CTT CAC TGG ACC AGA CG-3′;GAPDH引物F:5′-CCG CAT CTT CTT GTG CAG TG-3′,R:5′-CCC AAT ACG GCC AAA TCC GT-3′;miR-320a引物F:5′-AAG GGA TCG CGG GCG-3′,R:5′-TGC GTG TCG TGG AGT C-3′;EGOT引物F:5′-CAC TGC ACA GGG AAA CAC AAA-3′,R:5′-ACC CTG TTC ATA AGC CCT GAT G-3′。
1.2.3 ELISA检测IL-6和IL-1β水平 将未转染或转染后A549细胞调整为4×105个/毫升,取500 μL细胞悬液加至24孔板中,1 h后,按照LPS终浓度为10 mg/L加入LPS再培养24 h。1 500 r/min离心10 min,收集上清液参照ELISA试剂盒说明书检测IL-6和IL-1β水平。
1.2.4 流式细胞术检测细胞凋亡 采用结合缓冲液将LPS处理24 h的各组细胞调整为1×105个/毫升单细胞悬液。取100 μL细胞悬液加入到流式管,按照凋亡检测试剂盒说明书加入Annexin V-FITC和PI试剂进行染色,避光反应15 min,1 h内上级检测细胞凋亡。
1.2.5 Western blotting检测Bcl-2和Bax表达 用细胞裂解液提取各组细胞总蛋白。定量后,将30 μg蛋白质上样到聚丙烯酰胺电泳凝胶上,恒流转移至聚偏氟乙烯膜。将膜用含5%脱脂牛奶封闭液封闭1 h,并与稀释的兔抗Bcl-2、兔抗Bax抗体4 ℃孵育过夜。将膜在洗膜缓冲液中洗涤2次后,与HRP偶联的羊抗兔二抗在室温下孵育2 h。加入化学发光试剂显色、定影,图像处理软件分析各条带灰度值,Bcl-2和Bax表达相对表达量以其灰度值与内参灰度值比值表示。
1.2.6 双荧光素酶报告基因实验 应用lncRNABase在线预测显示lncRNA EGOT与miR-320a存在结合位点。基于预测结合位点合成EGOT野生型(WT)和突变型(MUT)序列,将上述序列分别克隆pmirGLO荧光素酶载体构建WT-EGOT、MUT-EGOT。将miR-320a mimics、miR-NC与WT-EGOT或MUT-EGOT分别共转染至A549细胞48 h后,双荧光素酶报告基因检测试剂盒测定相对荧光素酶活性。将pcDNA-EGOT、pcDNA、si-EGOT、si-NC分别转染A549细胞,转染48 h RT-qPCR法检测miR-320a表达水平。
1.3 统计学方法 采用t检验、方差分析和q检验。
2 结果
2.1 lncRNA EGOT和miR-320a在LPS刺激的肺泡上皮细胞中的表达 与Con组相比,LPS组A549细胞中lncRNA EGOT表达明显降低(P<0.01),miR-320a表达明显升高(P<0.01)(见表1)。

表1 lncRNA EGOT和miR-320a在LPS刺激的肺上皮细胞中的表达
2.2 lncRNA EGOT过表达对LPS诱导的肺泡上皮细胞炎症因子表达的影响 与Con组相比,LPS组A549细胞中EGOT表达降低(P<0.05),培养液中IL-6和IL-1β水平均升高(P<0.05);与LPS+pcDNA组相比,LPS+pcDNA-EGOT组A549细胞中EGOT表达升高(P<0.05),培养液中IL-6和IL-1β水平均降低(P<0.05)(见表2)。

表2 lncRNA EGOT过表达对LPS诱导的肺泡上皮细胞炎症因子表达的影响
2.3 lncRNA EGOT过表达对LPS诱导的肺泡上皮细胞凋亡的影响 与Con组相比,LPS组A549细胞凋亡率、Bax蛋白表达均升高(P<0.05),Bcl-2蛋白表达降低(P<0.05);与LPS+pcDNA组相比,LPS+pcDNA-EGOT组A549细胞凋亡率、Bax蛋白表达均降低(P<0.05),Bcl-2蛋白表达升高(P<0.05)(见图1~2、表3)。
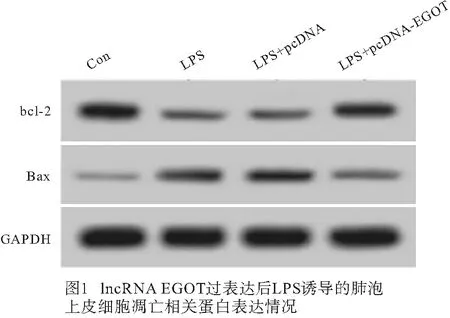
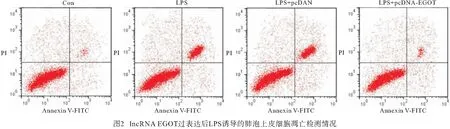

表3 lncRNA EGOT过表达对LPS诱导的肺泡上皮细胞凋亡的影响
2.4 lncRNA EGOT靶向调控miR-320a的表达 LncBase Predicted v.2在线预测分析显示,miR-320a与EGOT之间存在结合位点(见图3)。双荧光素酶报告实验显示,与miR-NC和WT-EGOT共转染组相比,miR-320a mimics和WT-EGOT共转染组A549细胞相对荧光素酶活性降低(P<0.05);与miR-NC和MUT-EGOT共转染组相比,miR-320a mimics和MUT-EGOT共转染组A549细胞相对荧光素酶活性变化差异无统计学意义(P>0.05)(见表4)。与pcDNA组相比,pcDNA-EGOT组A549细胞miR-320a表达水平降低(P<0.05);与si-NC组相比,si-EGOT组A549细胞miR-320a表达水平升高(P<0.05)(见表5)。


表4 双荧光素酶报告实验结果
表5 lncRNA EGOT靶向调控miR-320a的表达
2.5 抑制miR-320a表达对LPS诱导的肺泡上皮细胞炎症因子和细胞凋亡的影响 与LPS+anti-miR-NC组比较,LPS+anti-miR-320a组A549细胞miR-320a表达、Bax蛋白表达、细胞凋亡率均明显降低(P<0.01),Bcl-2蛋白表达明显升高(P<0.01),培养液中IL-6和IL-1β水平均明显降低(P<0.01)(见图4~5、表6)。
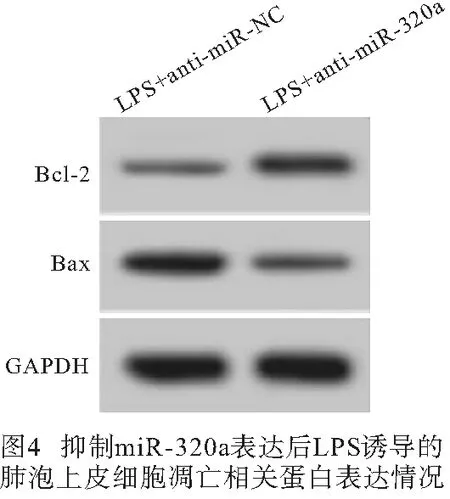
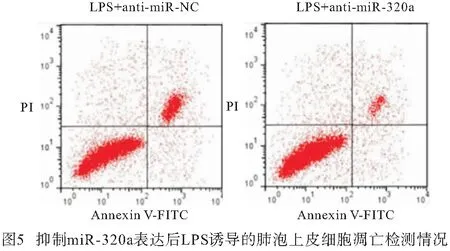

表6 抑制miR-320a表达对LPS诱导的肺泡上皮细胞炎症因子和细胞凋亡的影响
2.6 miR-320a过表达逆转lncRNA EGOT过表达对LPS诱导的肺泡上皮细胞炎症因子和细胞凋亡的作用 与LPS+pcDNA-EGOT+miR-NC组比较,LPS+pcDNA-EGOT+miR-320a组A549细胞miR-320a表达、Bax蛋白表达、细胞凋亡率均明显升高(P<0.01),Bcl-2蛋白表达明显降低(P<0.01),培养液中IL-6和IL-1β水平均明显升高(P<0.01)(见图6~7、表7)。
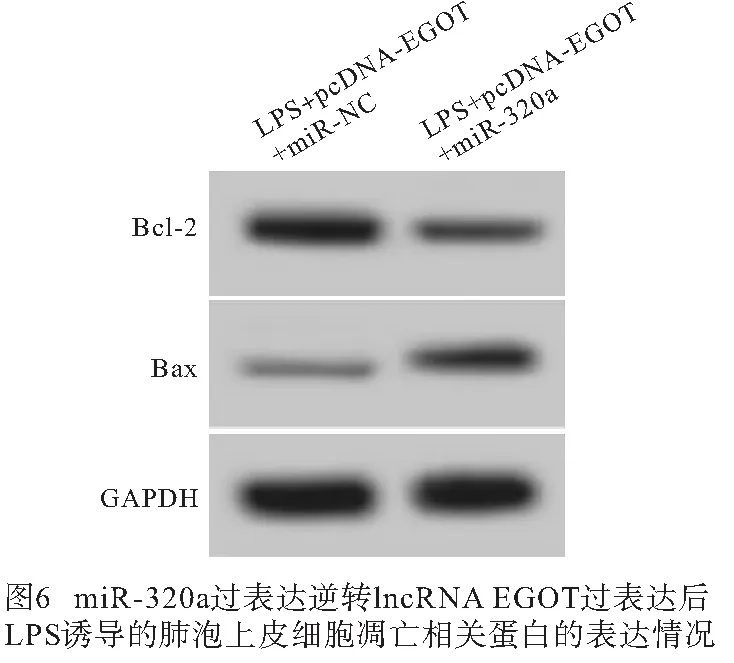
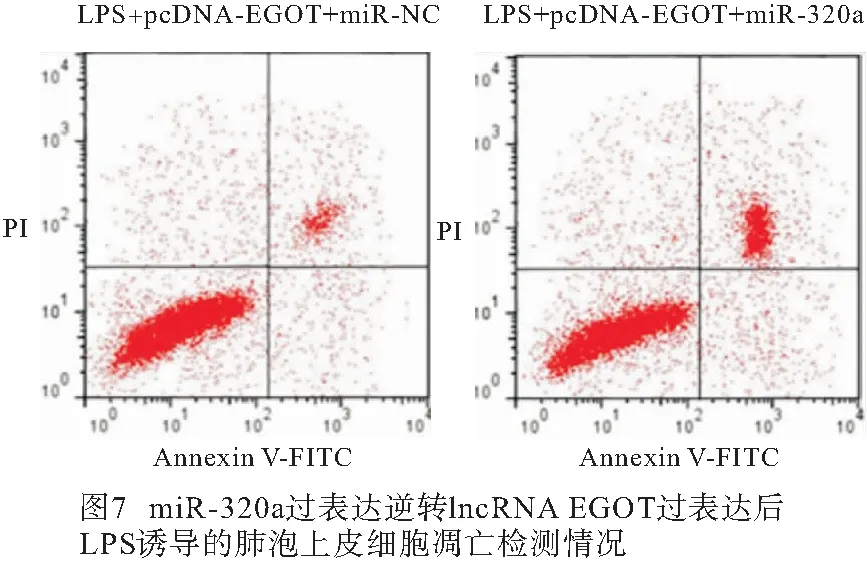

表7 miR-320a过表达逆转lncRNA EGOT过表达对LPS诱导的肺泡上皮细胞炎症因子和细胞凋亡的作用
3 讨论
革兰阴性菌引起的感染是ALI的重要病因,其可诱导剧烈的炎症反应和凋亡,导致呼吸膜的形态和功能损伤。本研究以脂多糖诱导肺泡上皮细胞A549损伤模拟ALI,探讨与ALI进展有关的基因和可能机制,以期为基于对抗肺泡上皮细胞损伤提供有效策略。
研究[8]显示,人脑利钠肽可提高缺氧条件下心肌细胞活力、减轻细胞凋亡和自噬进而改善缺氧诱导的心机细胞损伤,其机制与促进lncRNA EGOT表达有关。lncRNA EGOT通过调控基因表达还可抑制缺氧诱导肾小管的自噬防止急性损伤[9]。本研究显示,LPS诱导后A549细胞凋亡率、培养液中IL-6和IL-1β水平均明显升高,而lncRNA EGOT表达显著降低,提示lncRNA EGOT低表达可能与LPS诱导的A549炎症反应和凋亡有关。一般认为ALI的实质为炎症介质的释放导致肺部过度的炎症反应,鸢尾素通过抑制IL-6和IL-1β等炎性介质的产生可减轻肺部炎症损伤[10]。Bcl-2家族蛋白在细胞凋亡的信号转导中起着重要调节作用,Bax/Bcl-2比例失衡可导致细胞中线粒体膜电位的变化,促进线粒体细胞色素C释放到细胞质,然后激活caspase-3,最终导致细胞凋亡[11-13]。本研究显示,转染pcDNA-EGOT上调EGOT表达后,LPS诱导的A549中促凋亡蛋白Bax表达、凋亡率降低,抗凋亡蛋白Bcl-2表达增加,培养液中IL-6和IL-1β水平降低,说明lncRNA EGOT减轻LPS诱导的A549炎症反应和凋亡,是ALI临床治疗的潜在靶标。
生物信息学在线分析显示,lncRNA EGOT与miR-320a之间存在结合位点。miRNA是基因表达的重要调节剂,其在细胞增殖、代谢、凋亡等生物学过程中具有重要作用[14-15]。研究[16-17]显示,miR-320a高表达参与糖尿病肾病肾功能紊乱、骨关节炎进展。在阿霉素诱导的心脏损伤中miR-320a高表达,抑制miR-320a具有缓解阿霉素心脏损伤的作用[18]。此外,lncRNA MALAT1通过下调miR-320a表达还可减轻缺氧复氧诱导的血管内皮细胞损伤[19]。本研究显示,LPS诱导的A549细胞miR-320a表达显著升高,转染miR-320a抑制物下调miR-320a表达可减轻LPS诱导的A549细胞炎症反应和凋亡,与前人报道miR-320a的促炎结论类似[5]。此外,本研究发现lncRNA EGOT对miR-320a具有靶向负调控作用,且上调miR-320a表达还可逆转lncRNA OIP5-AS1对LPS诱导的A549细胞炎症反应和凋亡的影响,这为lncRNA OIP5-AS1/miR-320a分子轴参与LPS诱导的A549细胞炎症反应和凋亡提供了重要证据。
综上所述,lncRNA OIP5-AS1通过靶向miR-320a可减轻LPS诱导肺泡上皮细胞炎症反应和凋亡,进而可能减轻ALI严重程度。因此,lncRNA OIP5-AS1/miR-320a分子轴有望成为ALI的新型治疗靶点。
