芫花水提物对斑马鱼肝脏毒性机制研究
2021-11-07赵崇军李二文李芝奇范琦琦魏静赵霞林瑞超
赵崇军 李二文 李芝奇 范琦琦 魏静 赵霞 林瑞超
芫花(FlosGenkwa)为瑞香科植物芫花的干燥花蕾,广泛分布于中国长江流域各省和黄河流域的部分地区,具有泻水逐饮、杀虫疗疮的功效[1]。现代药理学研究表明,芫花具有镇痛抗炎[2-3]、免疫调节[4]、抗肿瘤[5]等诸多药理作用,但毒性限制了其临床应用。现有研究表明芫花对多个脏器存在毒性作用,向丽华等[6]研究24种中药的长期毒性,表明芫花对肝脏、肺、肾脏、卵巢等七个脏器存在毒性作用;赵一等[7]研究表明芫花对家兔具有显著的皮内刺激性和眼结膜刺激作用。可见芫花的毒性越来越受重视。肝脏是药源性损伤的主要靶器官之一,而中药是引起慢性药物肝损伤的重要原因之一[8],目前基于传统用药方式对芫花水提物的肝损伤研究尚且有限。本实验室前期工作中基于斑马鱼模型已完成多种有毒中药的评价,并且通过评价斑马鱼肝脏表型、肝面积、部分酶活性等指标,已确定芫花水提物会诱导斑马鱼幼鱼肝脏肿大、出血、肝细胞凋亡等[9],但其对斑马鱼肝脏的毒性具体机制尚不明确,本研究基于斑马鱼模型对芫花水提物的肝毒性机制进行深入探讨,以期对芫花的临床应用和推广提供参考。
1 材料与方法
1.1 材料
斑马鱼循环水养殖系统(北京爱生科技公司);BX51荧光显微镜(日本奥林巴斯集团);200 μL、1 mL、5 mL移液器(德国Eppendorf公司);LRH-250Z型恒温生化培养箱(广州沪瑞明仪器有限公司);RJLDL-50G型离心机(无锡瑞江分析仪器有限公司);HZQ-QX型全温振荡箱(哈尔滨市东联电子技术开发有限公司);HQ10-20H超纯水仪(长沙聚丰环保科技有限公司);Epoch2微孔板分光光度计酶标仪(美国伯腾仪器有限公司);UV-2000紫外-可见分光光度计(尤尼柯上海仪器有限公司)。Nanodrop 2000凝胶电泳结合紫外分光光度(美国赛默飞世尔科技公司);QuantStudio 3荧光定量PCR仪(美国赛默飞世尔科技公司)。
Caspase-3活性检测试剂盒(北京拜尔迪生物技术有限公司,批号G015),TransZol Up Plus RNA Kit (北京天根生化科技有限公司,批号ER501),FastKing cDNA第一链合成试剂盒(北京天根生化科技有限公司,批号KR116),RNA保护液(北京拜尔迪生物技术有限公司,批号r1100),4%多聚甲醛(北京生物科技有限公司,批号p1110),油红O染料(北京拜尔迪生物技术有限公司,批号s19039-100g),丙二醇(北京拜尔迪生物技术有限公司,批号0575-4l),丙三醇(北京虹湖联合化工产品有限公司,批号1198677873),甲酰胺(北京兰博利德商贸有限公司,批号v900064-500 mL),20×SSC缓冲液(pH=7.0,北京拜尔迪生物技术有限公司,批号r21057-100 mL),苏木素—伊红染液(北京拜尔迪生物技术有限公司,批号d006)。芫花由安国圣山药业有限公司提供,经北京中医药大学刘春生教授鉴定为瑞香科植物芫花的干燥花蕾,且符合药典规定。
斑马鱼亲本购于中国科学院武汉水生生物研究所,实验用野生AB系斑马鱼由本实验室斑马鱼养殖系统繁育。
1.2 芫花样品的制备
芫花水提物的制备:称取50 g芫花置平底烧瓶中,加10倍量水回流提取2小时,过滤,再加10倍量水提取两次,每次1小时。合并提取液,抽滤,浓缩,真空干燥,得芫花水提物16.59 g,得率为33.19%。
芫花水提物贮备液的配制:精密称取研磨后的芫花水提物粉末0.1 g,置于50 mL离心管中,精密加入50 mL斑马鱼胚胎培养水,超声60分钟,配置成2000 mg/L的贮备液,分装,置于-20℃的冰箱中保存备用。
芫花样品暴露给药溶液的配制:用胚胎培养水将贮备液稀释至所需浓度即可。
1.3 斑马鱼幼鱼的养殖与选取
斑马鱼的养殖:斑马鱼的养殖和繁育参照Zebrafish Book[10]。实验操作遵循经济合作与发展组织标准。斑马鱼保持在循环水养殖系统中,水温(28±1)℃,pH值7.0~7.2,电导率450~550 μs/cm,光照/黑暗周期为14小时/10小时。成年斑马鱼每日喂食3次丰年虾幼虫。斑马鱼胚胎通过自然成对交配产生。选取成年斑马鱼雌雄(1∶1)放入带隔板的产卵缸,次日早晨给予光照抽取隔板完成交配。将鱼卵收集于无菌培养皿中,在显微镜下去除死的和未受精的胚胎,并用培养液清洗,加培养液置于生化培养箱中培养96小时,每24小时更换一次培养液。斑马鱼胚胎培养水的配置:按照Zebrafish Book标准配制[10],0.137 mol/L的NaCl、5.4 mol/L的KCl、0.25 mol/L的Na2HPO4、0.44 mol/L的K2HPO4、1.3 mol/L的CaCl2、1.0 mol/L的MgSO4、4.2 mol/L的NaHCO3水溶液。
斑马鱼的选取:选取发育正常、无畸形的4 dpf AB系野生斑马鱼幼鱼,随机放于12孔细胞培养板中,每孔20条,加入适量等体积的胚胎培养水。
1.4 斑马鱼幼鱼的药物暴露处理
根据前期实验结果,选择200 mg/L、150 mg/L、100 mg/L浓度的药液对斑马鱼进行暴露处理,每组尾数为20(实验重复3次)。按照“1.2”药液的配制原则,将贮备液稀释成不同浓度的药液。将装有幼鱼的12孔板中的培养水依次吸出,并快速加入4 mL不同浓度的药液,孔板中的最终暴露浓度为高浓度组200 mg/L、中浓度组150 mg/L、低浓度组100 mg/L,空白对照组为等体积新鲜胚胎水。每个浓度含有2个复孔。加盖标记后,将孔板置于可控温光照培养箱中(28.5℃)24小时(黑暗与光照时间比为5∶7),实验终点即完成药物暴露。
1.5 斑马鱼幼鱼肝脏病理组织状态的分析
为了观察斑马鱼经药物处理后肝脏组织的病理学形态,对其做石蜡切片以进行观察。按照上述“1.4”的方法进行药液暴露处理,在实验终点将12孔板中的斑马鱼幼鱼用其胚胎培养水清洗3次,转入预先称重的1.5 mL离心管中,每个浓度20条幼鱼,PBS清洗3次,移除PBS,将收集好的鱼体固定于4%的多聚甲醛缓冲液中12小时,流水冲洗4小时。然后进行脱水、透明处理,石蜡包埋,切成6 μm的薄片,苏木精—伊红(hematoxylin-eosin staining,HE)染色法,处理温度为室温。最后置于显微镜下观察[11]。
1.6 斑马鱼幼鱼肝脏脂肪堆积状态的观察
按照上述“1.4”的方法进行药物暴露处理,在实验终点将12孔板中的斑马鱼幼鱼用其胚胎培养水清洗3次,转入预先称重的1.5 mL离心管中,每个浓度80条幼鱼,磷酸缓冲盐溶液(phosphate buffer saline,PBS)清洗3次,移除PBS,将收集好的鱼体固定在4%的多聚甲醛中,4℃条件下过夜。固定之后,将幼鱼转移到12孔板中,使用1×PBS冲洗后,使用混合溶液进行漂白:6 mL无菌水、30%的双氧水3.3 mL、0.5 mL甲酰胺、20×SSC的缓冲液0.25 mL。使用1×PBS冲洗后,依次使用85%和100%的丙二醇进行渗透,每次10分钟,随后浸没在0.5%油红O中,在黑暗的条件下过夜染色。随后依次使用100%和85%丙二醇进行冲洗,脱色,每次30分钟。随后用1×PBS进行冲洗,保存在80%丙三醇中[12],置于显微镜下观察拍照,观察是否有脂肪的堆积。所有油红染色操作都需要在常温下的缓慢振荡器中进行。
1.7 斑马鱼幼鱼基因表达的分析
按照上述“1.4”的方法进行药液暴露处理,在实验终点将12孔板中的斑马鱼幼鱼用胚胎培养水清洗3次,转入含有1 mL RNA保护液的1.5 mL离心管中,每个浓度80条幼鱼,在-80℃下贮存至测定。使用TransZol Up Plus RNA Kit提取总RNA。通过凝胶电泳和UV分光光度计验证RNA样品的完整性。使用FastKing cDNA第一链合成试剂盒将来自不同组的等量总RNA样品逆转录为cDNA。使用CFX96 Touch Systems和TransStart Top Green qPCR Super Mix进行定量实时PCR分析。所有过程均根据不同套件提供的制造商说明进行。用于PCR的斑马鱼特异性引物使用Primer Premier 5.0软件(表1)设计并由生物医学(北京博迈德基因技术有限公司)生产。两步PCR扩增方案如下:95℃ 3分钟、95℃ 30秒、60℃ 60秒,然后40个循环。

表1 引物序列
1.8 斑马鱼幼鱼Caspase-3活性检测
按照上述“1.4”的方法进行药液暴露处理,在实验终点将12孔板中的斑马鱼幼鱼用其胚胎培养水清洗3次,转入预先称重的1.5 mL离心管中,每个浓度80条幼鱼,PBS清洗3次,移除PBS,迅速称重并将样本保存于-80 ℃,按照每50 mg样本组织加入50 μL裂解工作液将斑马鱼组织样本裂解匀浆,4℃、12000 r/min离心5分钟,吸取上清液转移至新的离心管中,立即测定Caspase-3的酶活性,同时取少量样本用Bradford法测定蛋白浓度。Caspase-3酶活性的测定步骤按照试剂盒操作说明进行,最后用酶标仪测定405 nm处的吸光值。
1.9 统计学处理

2 结果
2.1 斑马鱼幼鱼肝脏组织病理学的改变
实验结果显示,空白对照组肝脏区域的细胞完整,细胞质均匀,细胞核成规则圆形;高浓度组中,肝脏细胞结构改变,肝实质细胞减少,出现萎缩变形,部分区域可见胞质溶解造成空泡化,排列松散,肝脏区域部分界线模糊。如图1所示。

注:A:空白对照组×100;B:空白对照组×400;C:高浓度组×100;D:高浓度组×400
实验结果显示,空白对照组斑马鱼肝脏部分未被着色,高浓度组斑马鱼肝脏区域呈现红色。如图2所示。

注:A:空白对照组;B:高浓度组。
2.2 斑马鱼幼鱼基因表达的改变
实验结果显示,相对于空白对照组,给药组中内质网应激相关基因包括激活转录因子4(activating transcription factor 4,atf4a)、活化转录因子6(activating transcription factor 6,ATF6)、90KDA热休克蛋白Β,内质网核心信号1(endoplasmic reticulum to nucleus signalling 1,ern1)、热休克蛋白70成员5[heat shock protein family A (Hsp70) member 5,hspa5]、真核翻译起始因子2A激酶3(recombinant eukaryotic translation initiation factor 2 alpha kinase 3,eif2ak3)、EIF2S1蛋白磷酸化抗体对(protein phosphorylation antibody pair,eif2s1)的mRNA表达水平显著上调;三羧酸循环相关基因丙酮酸脱氢酶E1α亚单位基因(pyruvate dehydrogenase E1 α-subunit A,pdha1a)和糖酵解相关基因肝红细胞丙酮酸激酶(recombinant human pyruvate kinase, Liver And RBC,pklr)在给药组中表达下调;肝型脂肪酸结合蛋白基因肝型—脂肪酸结合蛋白(liver-fatty acid binding protein,L-FABP)的mRNA表达水平上调;瘦素受体(leptin receptor,Lepr)和视黄醇结合蛋白4(retinol binding protein 4,RBP4)基因的mRNA表达水平上调;解偶联蛋白2(uncouplingprotein 2,ucp2)和超氧化物歧化酶(superoxide dismutase 1,sod1)基因的mRNA表达水平下调;炎症细胞因子白细胞介素-1β(interleukin-1β,IL-1β)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)上调;自噬相关基因自噬基因(beclin)、自噬相关蛋白3(autophagy related 3 homolog,ATG3)下调;B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)家族成员中抑制细胞凋亡的Bcl-2基因表达下调,促进细胞凋亡的Bid基因表达上调。实验结果如表2所示。
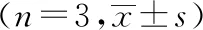
表2 不同浓度芫花水提物对斑马鱼幼鱼基因相对表达量的影响
2.3 斑马鱼幼鱼Caspase-3活性检测
实验结果表明,与空白对照组相比,芫花水提物高浓度组的斑马鱼幼鱼Caspase-3活性升高,并具有显著性差异(P<0.05)。如表3所示。

表3 不同浓度芫花水提物对斑马鱼幼鱼
3 讨论
国际上常规的毒理学研究终点均因传统评价模型的灵敏性、稳定性和特异性较差而无法成为肝毒性早期诊断的标准。而本实验采用斑马鱼为模型,斑马鱼作为新兴的药物安全性评价的模式生物,介于体外细胞等实验和体内整体动物实验之间,既具有细胞等体外实验用药量少、实验费用低、周期短、高通量等特点,又具备整体动物实验可观察多个器官、可评价药效学及药动学、可评价代谢物活性等优势,其繁殖快、易饲养、胚胎及幼鱼透明且便于观察等优势也不可忽视[13],非常适合在药物开发的早期阶段预测药物的肝毒性,并且斑马鱼与人类基因组的相似度高达87%,有与人类近似的毒性特征和信号传导通路,对外源化学物质的防御机制与哺乳动物相当,包括酶的诱导和氧化应激[14]。
实验室前期工作探究芫花提取物的毒性作用,实验结果发现从斑马鱼幼鱼的表型、生化指标等的变化证明芫花对斑马鱼造成肝脏损伤,再从其生化指标超氧化物歧化酶、过氧化氢酶推测其可能是通过破坏机体的氧化应激平衡造成肝损伤[9],但具体的损伤程度及机制尚不明确,本研究紧接着对芫花肝脏毒性机制做进一步探讨。通过病理切片和脂肪堆积状态的结果可以看出,芫花对斑马鱼肝脏的毒性作用表现在肝脏细胞结构改变,部分区域严重空泡变性,排列松散;肝脏及卵黄囊处有脂肪堆积。为了明确这一病理变化,本课题组研究了芫花水提物对斑马鱼幼鱼的潜在毒性机制,结果表明,其潜在机制与内质网应激,线粒体功能障碍,氧化应激,先天免疫应答和细胞凋亡等相关。
内质网是细胞加工蛋白质和贮存Ca2+的主要场所,其对蛋白质的合成、折叠以及转运等过程发挥重要作用。但一些病理因素可能会破坏内质网功能,从而诱发内质网应激反应(endoplasmic reticulum stress,ERS),甚至是造成细胞的凋亡。内质网应激反应主要激活3条细胞信号通路:未折叠蛋白反应(unfolded protein response,UPR)、内质网超载反应(endoplasmic reticulum-overload response,EOR)及固醇调节级联反应。其中,URP是内质网应激反应中最重要的信号通路[15]。ERS和URP相关的基因包括atf4a, hsp90b1, eif2s1,在芫花水提物的诱导下,这些基因在斑马鱼中显著上调。而且,有研究表明,内质网应激在脂肪肝的发生发展中起着重要的作用[16],表明斑马鱼幼鱼脂肪堆积也与内质网应激相关。L-FABP在肝细胞中可大量表达,其主要功能包括脂肪酸的转运、核信号传导及脂代谢作用[17],给药组中L-FABP表达上调,可能是由于斑马鱼脂质堆积增强了L-FABP的表达。Rbp4是一种脂肪细胞分泌因子,它在人类肝脏组织中表达最高,并且肥胖患者体内,Rbp4表达是升高的[18]。因此,L-FABP和rbp4的表达上调也说明斑马鱼体内有脂质堆积。
线粒体的主要功能包括调节氧化磷酸化生成三磷酸腺苷(adenosine triphophate,ATP)、活性氧(reactive oxygen species,ROS)的生成、Ca2+稳态等,并且参与多种重要营养物质的代谢[19]。三羧酸循环是在线粒体中进行的,本研究结果表明其相关基因pdha1a在芫花水提物诱导的斑马鱼肝脏中下调,表明三羧酸循环受阻,即线粒体功能可能受损。糖酵解途径是将葡萄糖和糖原降解为丙酮酸并伴随ATP生成的一系列途径,产生的丙酮酸将进入线粒体继续氧化分解,通过三羧酸循环及电子传递链彻底氧化成二氧化碳和水,并生成ATP。因此糖酵解会影响线粒体产生能量,其相关基因pklr表达水平的下调说明糖酵解受到抑制,影响线粒体产能。Ucp-2是线粒体膜内阴离子载体超家族的成员。它通过一种不完全明确的机制调节脂肪酸代谢和活性氧的生成,以减少线粒体电子传输过程中ROS的生成[20]。超氧化物歧化酶具有特殊的生理活性,能消除生物体在新陈代谢过程中产生的有害物质,是氧自由基的自然天敌。本研究结果显示芫花水提物诱导ucp2和sod1基因表达的下降,ROS增多,导致斑马鱼体内的氧化和抗氧化作用失衡,从而导致氧化应激。在内质网应激和氧化应激的损伤下,对免疫应答相关基因和自噬相关基因进行研究,发现IL-1β、TNF-α表达在给药斑马鱼组中上调,Beclin和ATG3则下调。IL-1β和TNF-α分别作为白介素IL-1家族中的促炎活性因子和参与全身性炎症的肿瘤坏死因子,其表达水平的上调与肝脏损伤密切相关。Bcl-2定位于自由基生成的位点,作为抗氧化应激的明显抗氧化剂,可以防止细胞凋亡[21];Caspase-3是最为关键的细胞凋亡执行者,在细胞凋亡过程中起着不可替代的作用[22]。Bcl-2基因表达水平的下调,促进细胞凋亡的Bid基因表达上调及Caspase-3活性的升高均说明芫花水提物诱导斑马鱼幼鱼的肝脏细胞凋亡。
综合实验结果,芫花水提物诱导斑马鱼幼鱼的肝损伤,造成肝脏代谢功能异常,导致脂肪堆积。基因结果显示其可能通过诱导内质网应激,破坏线粒体功能,诱导氧化应激及产生炎症反应最终导致细胞凋亡。本研究结果更加清楚地了解了芫花在斑马鱼幼鱼中的毒性作用及潜在机制,为后续的研究工作及芫花的临床应用推广提供一定的参考依据。
