NaF-K2 TiF6-TiO2 体系中直接电解制备钛的可行性研究
2021-11-06刘瑛鑫颜恒维刘战伟杨鹏臣
刘瑛鑫,颜恒维,刘战伟,秦 博,杨鹏臣
(昆明理工大学 冶金与能源工程学院,云南 昆明 650093)
0 引言
金属钛及其合金由于具有密度小、质量轻、比强度高、耐腐蚀性好以及生物相容性好等优点,被广泛应用于航空、航天、航海、化工、建筑和医学等领域[1-2].尽管全球钛资源储量丰富,截止2017年底,全球钛资源已超过20亿t(以TiO2为当量计)[3].但钛工业目前的生产现状(主要以“Kroll”为主)使得海绵钛的价格一直居高不下,从而限制了钛及其合金的大规模应用.而熔盐电解制备金属的方法具有能耗低、污染小的优点,因此,熔盐电解制备钛的方法一直都是科研人员关注和研究的重点.
熔盐电解法制钛的工艺与较为主流的OS法[4]、USTB法[5]以及FFC剑桥法[6-9]相比,OS工艺虽然在理论上的能耗仅为传统工艺的一半,但产物和电解质难以分离的缺点使得产物含有较高杂质,这限制了该工艺实现工业化的脚步;而FFC剑桥法凭借独特的脱氧机理,缩短了金属钛制备工艺的流程,被视为现阶段最有可能取代传统钛制备方法的工艺,但仍存在着难点需要攻克,如电流效率偏低、产物含氧率较高以及石墨阳极污染等问题;USTB工艺尽管克服了OS法和FFC剑桥工艺生产出来的阴极产物含氧量高且易引入杂质的问题,但阳极的消耗和制备仍是必需要解决的难题.
以往熔盐电解法制备钛工艺的电解质体系大多为氯化物,主要以CaCl2-CaO体系为主,兼有添加NaCl、MgCl2、LiCl、KCl等物质[10-15].而相较于氯化物体系,氟化物体系有着不易吸潮、电化学窗口宽、金属溶解损失小、电能效率高等优点,但目前对氟化物体系的研究大多限于钛离子的阴极过程,对其电解过程探究的报道相对较少[16-18].钛源的添加多以钛的氟化物、氧化物或氯化物为主,其中K2TiF6作为常见的钛源添加物更是被众多科研人员所关注[19-20],但以K2TiF6作为钛源的电解会在沉积钛的过程中阳极生成氟气,对环境造成污染,倘若将K2TiF6作为熔盐电解质,添加二氧化钛作为钛源将有效的改善这一缺点.
因此,本文对以NaF-K2TiF6体系作为熔盐电解质,以TiO2作为钛源添加,对直接电解制备金属钛的可行性进行了探究,通过热分析法(步冷曲线)探究不同摩尔比NaF-K2TiF6的初晶温度及TiO2加入后对初晶温度的影响,并在探究TiO2在体系中的溶解度以及在体系熔盐电解热力学计算的基础上,进行了循环伏安测试及恒流电解实验.
1 实验部分
1.1 材料与试剂
实验原料为阿拉丁试剂公司购买分析纯的NaF(99%)、K2TiF6(99.5%)和TiO2(99%),为消除药品中水分对实验的影响,将药品放入真空干燥箱中,在200℃下保温360 min,并按不同摩尔比混合研磨均匀,放入密封袋,置于干燥皿内备用.
1.2 实验方法
1.2.1 初晶温度测定方法
采用热分析法(步冷曲线)进行初晶温度的测量,将配好的熔盐装入石墨坩埚中,并置于竖式管状电阻炉中,通入氩气进行保护,加热到熔盐完全熔融并保温30min.将装有不锈钢保护套的镍-铬热电偶插入熔融盐中并用石墨搅拌棒对熔盐进行搅拌,而后以1℃/min的速率降温.通过电脑记录的温度随时间变化的曲线以确定熔盐的初晶温度,温度变化曲线中的平台或拐点即为体系的初晶温度.
1.2.2 二氧化钛溶解度及溶解机理
对于二氧化钛溶解度及溶解机理的研究流程如图1所示.将压制成块的二氧化钛放入熔融盐中,用不锈钢棒对溶解不同时间的上清液进行取样,整个实验过程中通入氩气以确保整个实验装置处于惰性气氛条件下.而后对所取样品进行氧元素分析以推算二氧化钛的溶解度(体系内氧元素的变化因TiO2的溶解所致,根据溶解前后氧元素质量分数可推算TiO2溶解度,计算公式如(1)所示);并对样品进行XRD分析以探究二氧化钛在该熔盐体系中的溶解机理.通过添加不同质量分数(1%~5%)的二氧化钛以探究其对熔盐体系初晶温度的影响.TiO2的溶解度如公式(1)所示:

图1 二氧化钛溶解度测定流程Fig.1 The process of determining the solubility of titanium dioxide

式中:S(TiO2)—TiO2溶解度;Δw(O)—溶解前后氧元素质量分数差;1.75为TiO2分子量和O2分子量比值.
它包含了一系列关联性和差异性的隐喻或象征的集合并存在于美学、符号学、直觉描述、认识交流以及媒介分析等领域。这是一种鲜明的复合形式,混合了文字和图像的超文本。
1.2.3 熔盐电解实验及产物分析
熔盐电解制备钛的研究是以303不锈钢作为阴极,以石墨坩埚作为阳极、极距1cm、以摩尔比为1.5∶1的NaF-K2TiF6为电解质,并加入高于体系溶解度的TiO2、电解温度为785℃,用直流电源进行3 h的恒流电解,并记录电压随时间变化曲线.整个电解过程处于氩气气氛条件下.所做电化学实验采用三电极体系,工作电极及参比电极皆选用金属Mo棒,对电极则采用高纯石墨棒,所用电化学工作站为德国札纳电化学公司的Zahner E.电解后对电解产物进行XRD(D/MAX-2200pc)、扫描电镜(JSM-6701F)及能谱分析(Thermo NS7).电解装置图如图2所示.

图2 直流电解原理图Fig.2 Schematic diagram of DC electrolysis
2 结果与讨论
2.1 NaF-K2TiF6体系初晶温度及TiO2对体系初晶温度的影响
图3所示为不同摩尔配比NaF-K2TiF6体系的初晶温度,从图中可以发现,熔盐体系的初晶温度在加入少量的氟化钠后会有显著的下降,但随着氟化钠添加量的增多,熔盐体系的初晶温度开始升高.这是由于随着氟化钠的加入会在原体系的基础上形成新的低熔点化合物,从而降低体系的初晶温度,但随着氟化钠的不断加入,体系的初晶温度会再次升高.这是因为NaF的熔点(993℃)明显高于K2TiF6(780℃)的熔点,随着加入的NaF摩尔分数的提高,整个熔盐体系的初晶温度再次受NaF的加入量主导.

图3 不同摩尔比NaF-K2TiF6体系初晶温度Fig.3 Initial crystallization temperature of NaF-K2TiF6 system with different molar ratios
图4所示为添加不同二氧化钛后熔盐体系的初晶温度,所选熔盐体系为摩尔比1.5∶1的NaF-K2TiF6.从图中可以看出,在二氧化钛添加量较低的条件下,随着二氧化钛添加量的不断增多,体系的初晶温度呈下降趋势,这可能是由于二氧化钛加入后和体系内的物质形成了初晶温度更低的化合物,而在之后的物相分析中也检测到K2NaTiOF5的出现.二氧化钛添加量质量分数为4%和5%时,体系初晶温度变化不大,可能是由于此时接近体系的饱和溶解度,再添加二氧化钛,对体系的初晶温度影响不大.

图4 二氧化钛添加量对电解质体系初晶温度的影响Fig.4 The effect of titanium dioxide addition on the primary crystal temperature of the electrolyte system
2.2 二氧化钛溶解度及溶解机理
表1所示为不同摩尔配比KF-Na2TiF6体系在相应实验温度下的二氧化钛溶解度,根据表中的数据可以发现二氧化钛在该电解质体系下的溶解度的范围大约在质量分数5%~7%,二氧化钛溶解度较高,可以满足熔盐电解的需要.溶解180 min和溶解300 min的溶解度变化不大,说明在180 min时几乎达到了饱和溶解度.从表中数据来看,摩尔比为1.2∶1、1.5∶1和2∶1的熔盐体系对熔盐钛电解都适宜.故后续实验皆选用摩尔比为1.5∶1的熔盐体系.

表1 二氧化钛在不同摩尔比KF-Na2TiF6中的溶解度Tab.1 The solubility of titanium dioxide in different molar ratios of KF-Na2 TiF6
为明确二氧化钛在该体系中的溶解机理,对摩尔比为1.5∶1的熔盐体系中溶解二氧化钛5 min、60 min和300 min的上清液进行取样检测,物相分析如图5所示.根据XRD的分析结果来看,随着溶解时间的增加,K2NaTiOF5和Na2Ti3O7含量不断增加,K2TiF6含量不断减少,推测可能在TiO2的溶解过程中发生式(2)反应,当溶解达到300 min时,熔盐内的主要物相为K2NaTiOF5和少量的Na2Ti3O7,K2TiF6已经完全被消耗,并出现TiO2相,说明此时体系内已经达到二氧化钛的饱和溶解度,新物相的生成说明二氧化钛的溶解主要以化学溶解为主,其融入形式以K2NaTiOF5为主,以Na2Ti3O7为辅.
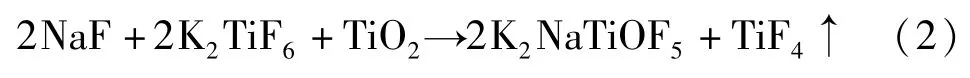

图5 TiO2加入后体系物相分析Fig.5 Phase analysis of the system after adding TiO2
2.3 TiO2-K2TiF6-NaF体系热力学计算
表2为活性碳阳极的条件下,体系中可能发生的各类反应的标准吉布斯自由能及理论分解电压(数据来源于HSC6.0,标准吉布斯自由能及理论分解电压计算公式如式(3)和(4)所示).对比表2的数据可以发现,以氧化物形式存在的钛离子相较于以氟钛酸钾形式存在的更容易被还原为单质钛;钛的氧化物随着钛的价态降低变得更难以还原;理论上二氧化钛的还原是逐级还原的.

表2 785℃条件下各反应发生的标准吉布斯自由能和理论分解电压Tab.2 Standard Gibbs free energy and theoretical decomposition voltage of each reaction at 785℃

2.4 TiO2-K2TiF6-NaF循环伏安曲线
对未加入二氧化钛的NaF-K2TiF6体系和加入质量分数5%二氧化钛的NaF-K2TiF6体系进行循环伏安测试,该曲线从开路电位向负扫描,然后再正向扫描,扫描速率为100 mV/s.其测试结果如图6所示,结果显示,添加二氧化钛后,循环伏安图谱中出现两对明显的氧化还原峰(1/1*和2/2*).还原峰2和氧化峰2*出现在图谱0 V(vs.Mo-QRE)附近,通过对比之前的热力学计算,推断氧化峰2和还原峰2*对应的为TiF62-/TiF63-的氧化还原过程.对于氧化还原峰1/1*,通过查阅文献[18,20]可知,在纯的氟化物体系中,Ti3+在Mo电极上的还原为一步还原,结合热力学计算可推断,还原峰 1*对应的为TiO2-NaF-K2TiF6体系中Ti3+在Mo电极上发生的三电子转移的电化学过程.

图6 TiO2-K2 TiF6-NaF循环伏安曲线Fig.6 Cyclic Voltammetry of TiO2-K2TiF6-NaF
2.5 恒流电解曲线及阴极产物
图7所示为恒流电解180 min电压随时间变化曲线,从图中可以发现,电压变化曲线呈现先上升后下降再上升的趋势,并伴随着电压波动,曲线在开始时成上升趋势可能是由于电解过程中阳离子向正极移动,阴离子向负极移动,体系内离子的移动使得阴阳极发生极化,需施加更高的电压以满足电解.随着金属钛的不断沉积,阴阳极极距的减少导致电压的下降.最后随着电解时间的延长,溶解的二氧化钛被不断地消耗,体系初晶温度开始升高,从而导致电解电压再一次上升.而在此过程中电压的不断波动可能是由于钛的沉积过程中所沉积物质掺杂钛的低价氧化物,钛的低价氧化物附着在阴极表面导致阴极电阻增加,而附着的氧化物脱氧后又导致电阻降低,从而电解电压出现波动.

图7 0.87 A/c2恒流电解曲线Fig.7 Constant current electrolysiscurve(0.87 A/cm2)
图8所示为电流密度为0.87A/cm2的阴极产物的XRD图.根据分析结果来看,电解产物的主要成分为金属钛和K2NaTiF6,以及少量的含水氟化钾和低价氧化钛.氟化钾在空气中吸水性较强,致使在电解产物的处理过程中引入结晶水.而阴极产物中夹杂的大量的K2NaTiF6可能是由于电解沉积的钛和体系中的钾离子再次发生反应所致,反应方程式如(5)所示:
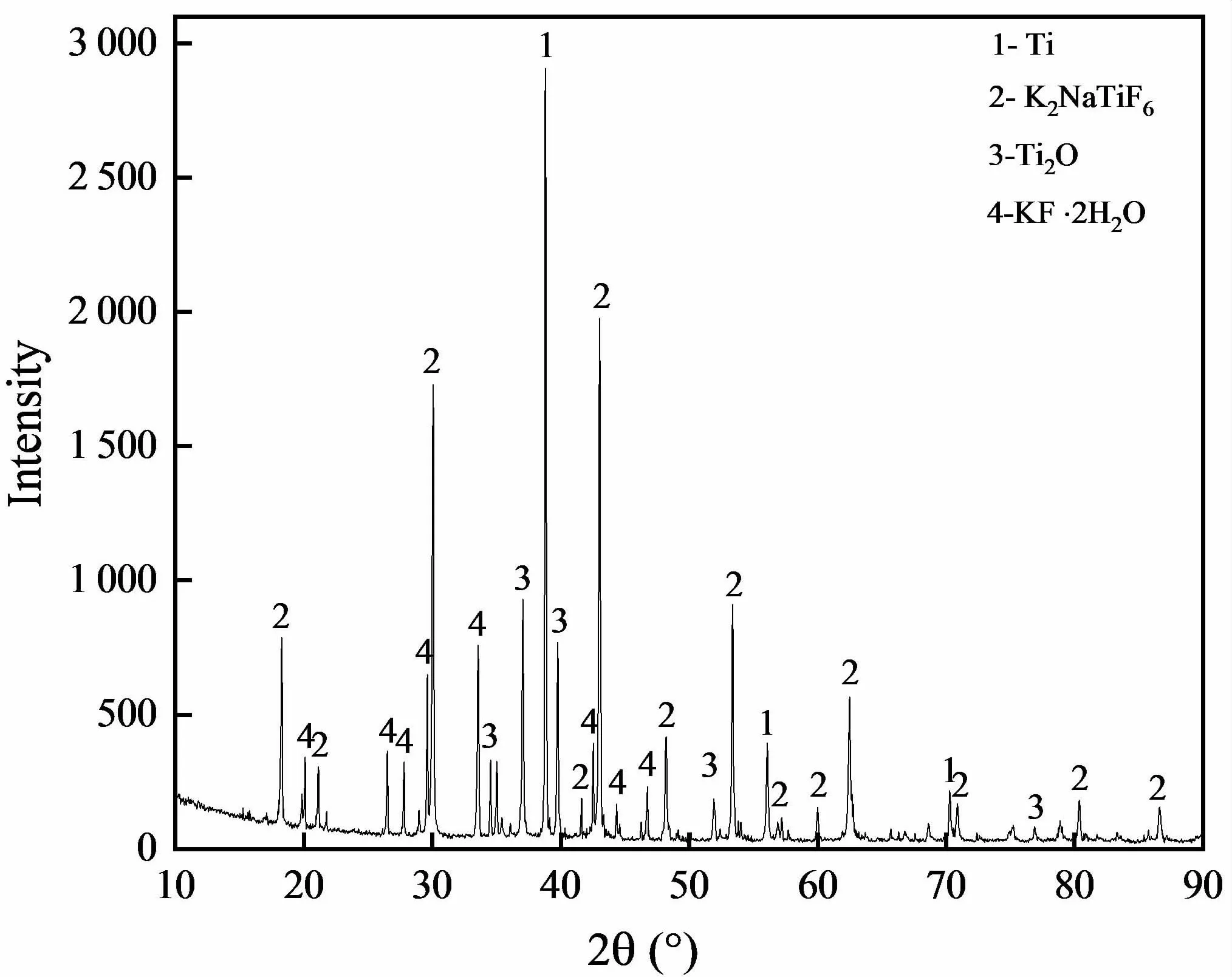
图8 0.87A/cm2恒流电解阴极产物相分析Fig.8 Phase analysis of cathode products in constant current electrolysis(0.87 A/cm2)

随后对电流密度为0.87 A/cm2的阴极产物进行了能谱和扫描电镜分析,图9所示为电解产物的能谱图及电镜图.图9a)所示为电解产物的整体扫描,可以发现整个产物大体分为颜色较亮的白色区域和颜色较暗的黑色区域,因此对较暗的黑色区域和较亮的白色区域进行了点分析(取点为点1和点2);图9 b)为点1的分析结果,可以发现该点的主要元素为氟元素和钠元素,以及少量的钛元素和钾元素,分析为电解产物中夹杂的氟化钠;图9 c)为点2的分析结果,该区域的主要元素为钛、氟、钠和钾等.综合上文的XRD结果来看,该区域的物质组成为金属钛、K2NaTiF6以及氟化钾.图9d)所示为该区域的SEM图,可以发现电解产物以颗粒状形貌存在.
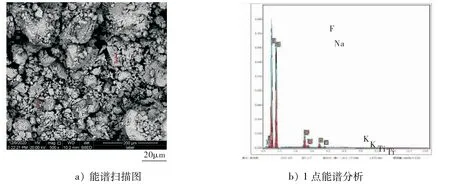
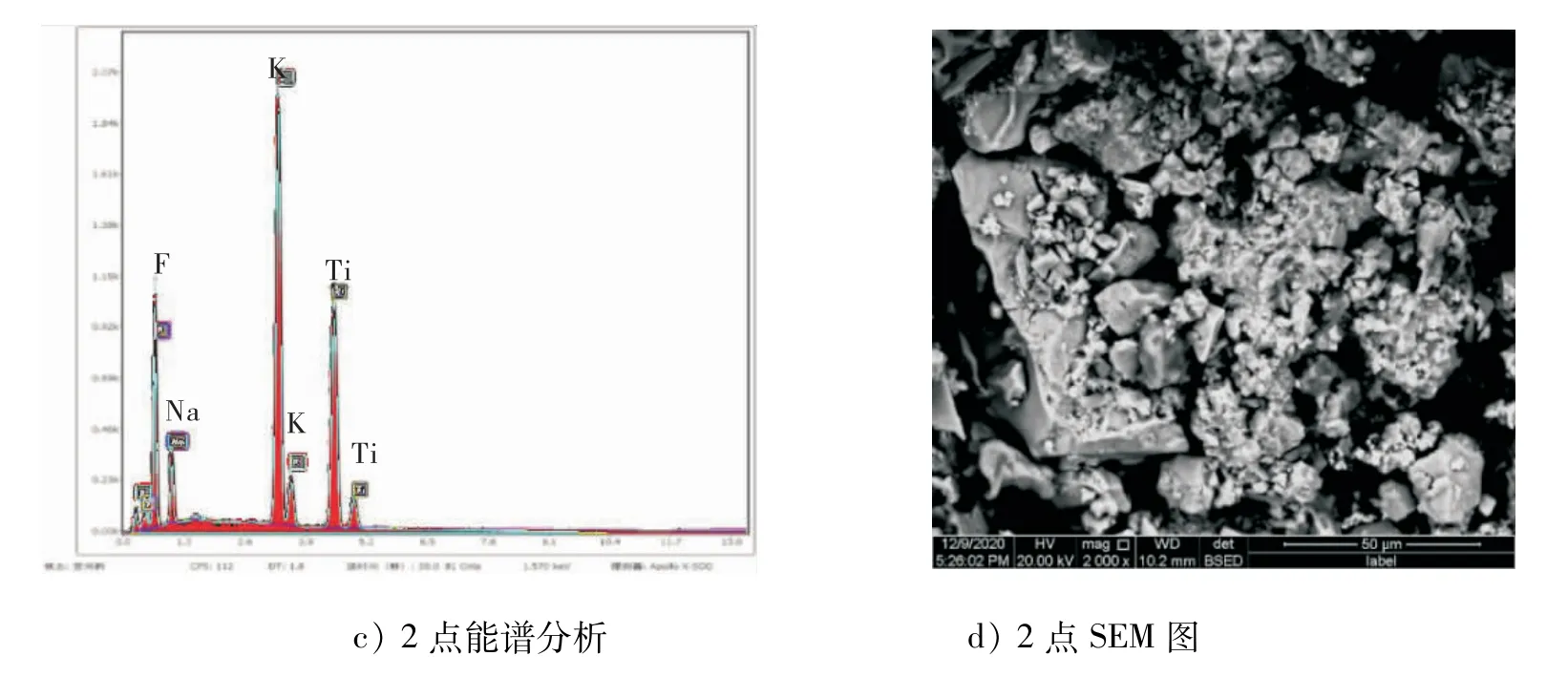
图9 电解产物能谱图和SEM 图Fig.9 SEM image and an EDSscan of electrolysis product a)EDS scan;b)EDS analysis of point 1;c)EDS analysis of point 2;d)SEM image of point 2
3 结论
通过以上的分析,得出如下结论:
1)通过探究不同摩尔比NaF-K2TiF6的初晶温度及其对TiO2的溶解度发现,摩尔比为1.5∶1的体系有着较为适宜的初晶温度和TiO2溶解度,初晶温度和溶解度分别为762.5℃和质量分数6%左右.
2)TiO2在熔盐体系中的溶解以化学形式为主,其融入形式以K2NaTiOF5为主,以Na2Ti3O7为辅,且少量TiO2溶解后会降低熔盐体系的初晶温度.
3)该体系的热力学计算发现,理论上以氧化物形式存在的钛优先发生电解分离,二氧化钛的还原是逐级进行的.循环伏安测试推测该体系钛离子的阴极过程分为两个阶段:TiF62-/TiF63-;Ti3+→Ti.恒流电解的阴极产物为钛金属颗粒并夹杂着一定量的电解质.
