紫鸭跖草CpBURP的克隆、表达及生物信息学分析
2021-11-06彭国颖卢山黄超杨坤万玮黄长干
彭国颖 卢山 黄超 杨坤 万玮 黄长干
(1. 江西农业大学/南昌市植物资源化学利用重点实验室,南昌 330045;2. 江西农业大学校友办,南昌 330045)
重金属污染日益成为影响农作物产量的重要因素,铜作为重金属污染物之一,在污染土壤时具有毒性和高持久性,而植物修复技术[1]是一种很有潜力、且环保的清除环境污染的绿色技术,通过超积累植物吸收污染物来达到修复土壤、水及空气的目的。目前,国内外研究较多的超积累植物有东南景天(Sedum alfredii)[2]、蜈 蚣 草(Pteris vittata)[3]、蓝 遏 菜(Thlaspi arvens)[4]、印 度 芥 菜(Brassica juncea)[5]、车前草(Herba plantaginis)[6]等植物。紫鸭跖草(Commelina purpurea)是一种超积累铜植物[7],其耐受铜离子的能力强于其他普通植物,在修复铜污染的土地具有一定的潜力。因此,从分子水平上研究紫鸭跖草的耐铜机制具有重要的意义。
BURP蛋白为植物特有蛋白,由一类具有相似的初级结构且含有BURP保守结构域的蛋白质[8],在植物生长过程中,BURP蛋白不仅参与植物种子的生长发育,而且在植物抵抗非生物胁迫时也具有重要的作用[9]。BURP蛋白是由BNM2(小孢子蛋白)、USP(种子非储存蛋白)、RD22(脱水反应蛋白)和PG1β(多聚半乳糖醛酸酶同工酶)4种蛋白质共同组成[10],甘蓝型油菜中的BNM2会参与甘蓝型油菜的小孢子的产生及发育[11];蚕豆种子中的USP参与种子的发育,Vokkaliga等[12]发现拟南芥USP基因的异位表达会影响种子的生长发育;RD22的发现源于拟南芥的脱水反应蛋白,其是植物应在非生物胁迫中的重要蛋白。José等[13]发现大豆GmRD22蛋白的异源表达会提高水稻对盐胁迫的抗逆性,钟活权[14]研究表明拟南芥受铜胁迫后,通过上调AtRD22的表达而提高自身的抗胁迫能力;番茄PG1β通过调节果实成熟过程中果胶的溶解的程度参与到果胶代谢中[15]。
目前,还未有关于紫鸭跖草BURP基因的报道。本研究依据紫鸭跖草的全长转录组数据库,应用HMMER 3.0程序筛选出CpBURP,并克隆出CpBURP,通过运用生物信息学软件对CpBURP蛋白的理化性质、保守结构域、磷酸化位点、二/三级结构、信号肽、跨膜结构、亚细胞定位及对同源蛋白构建系统进化树等方面进行探究分析,并利用qRT-PCR分析在Cu2+胁迫下紫鸭跖草根、茎、叶中的CpBURP表达量,为后期紫鸭跖草的BURP基因的深入研究奠定基础。
1 材料与方法
1.1 材料
剪取紫鸭跖草的嫩茎,用5 g/L高锰酸钾溶液消毒后放进霍格兰氏营养液中培养,待培养30 d后,嫩根长成,分别在0、50、100和300 μmol/L Cu2+的霍格兰氏营养液中培养4 d,以各Cu2+营养液培养的紫鸭跖草根、茎、叶为试验材料,取样后迅速用液氮冷冻,-80℃保存备用。
以紫鸭跖草全长转录组数据作为筛选BURP基因的数据库。
1.2 方法
1.2.1 基因的筛选与克隆 从Pfma数据库中下载BURP基因家族保守结构域的隐马尔可夫模型(Pfam:PF03181),运用HMMER 3.0程序在紫鸭跖草的蛋白质数据库进行搜索筛选出一个基因,再利用SMART确定其编码的蛋白具有BURP结构域,利用NCBI确定其具有完整的开放阅读框,将该基因命名为CpBURP。
采取Trizol法提取紫鸭跖草的总RNA,以反转录的cDNA为模板,依据转录组数据设计CpBURP引物(CpBURP-F:5'-AACCCCTTCACTGCAAAGGC-3',CpBURP-R:5'-ATCCGCGACGGTCCATGT-3'),进行基因PCR扩增。用1.5%琼脂糖凝胶检测、回收,将目的基因与载体pMDTM19-T连接,转入大肠杆菌感受态细胞DH5α,筛选阳性克隆进行菌液扩增并测序(普洛麦格克公司)。
1.2.2 CpBURP的生物信息学分析 运用Expasy在线软件分析蛋白质的理化性质;运用MotifSearch在线软件分析蛋白质的保守结构域;运用NetPhos 3.1 Server在线软件分析蛋白质的磷酸化位点;运用Prabi在线软分析蛋白质的二级结构;运用SWISSMODEL在线软件分析蛋白质的三级结构;运用TMHMM在线软件分析蛋白质的信号肽;运用SignalP 4.1 Server在线软件分析蛋白质的跨膜结构域;运用PSOR在线软件分析蛋白质的亚细胞定位;在NCBI中检索拟南芥、苹果(Malus domestica)、黄瓜(Cucumis sativus)、香瓜(Cucumis melo)、野大豆(Glycine soja Sieb)、花生(Arachis hypogaea)、木豆(Cajanus cajan)、水稻(Oryza sativa)、玉米(Zea mays)、刺毛黧豆(Mucunapruriens)、辣椒(Capsicum annuum)、甘蓝型油菜、小兰屿蝴蝶兰(Phalaenopsis equestris)等13个物种的BURP蛋白,运用MEGA7软件(neighbour joining tree法)将13个物种BURP蛋白与CpBURP蛋白构建系统进化树、并运用EVOLVIEW在线软件美化。
1.2.3 CpBURP的qRT-PCR分析 选取泛素连接酶(Ubiquitin,UBI)基因(UBI-F:5'-AGCACTCTTCACCTCGTCC-3';UBI-R:5'-CTTCGCCTTCACATTCTC-3')作为内参基因,分析CpBURP(F:5'-TTTGAAGTTTAGTAACTATGATGCG-3';R:5'-CATTCCCATCTTGCGCATAGTTCAT-3')的表达。利用实时荧光定量仪LightCycler 480 System进行反应,每个反应进行3次生物学重复。qRT-PCR反应程序如图1,运用2-△△Ct法计算基因的相对表达量。

图1 qRT-PCR扩增程序Fig.1 Amplification procedure of qRT-PCR
2 结果
2.1 CpBURP的克隆
以紫鸭跖草的cDNA为模板,以CpBURP-F和CpBURP-R为引物扩增出一条1 383 bp的特异性条带(图2-A),经菌液PCR检测(图2-B)和测序,结果表明,该条带为目的基因。
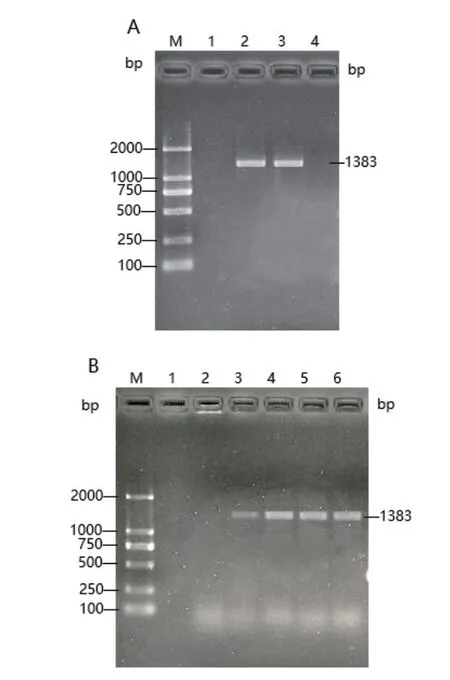
图2 CpBURP的扩增和PCR检测Fig.2 Amplification and PCR detection of CpBURP
2.2 CpBURP蛋白理化性质分析
CpBURP可编码含460个氨基酸的蛋白(图3),分子量为49.3 kD,分子式为C2153H3260N594O710S15,脂肪系数为56.37。带负电荷的残基总数(Asp+Glu)为51,带正电荷的残基总数(Arg+Lys)为42,等电点(pI)为5.46。CpBURP的不稳定系数为26.91,为稳定蛋白;CpBURP蛋白的总平均亲水系数为-0.448,为亲水蛋白(图4)。

图3 CpBURP核苷酸序列及其编码的氨基酸序列Fig. 3 CpBURP nucleotide sequence and its encoded amino acid sequence
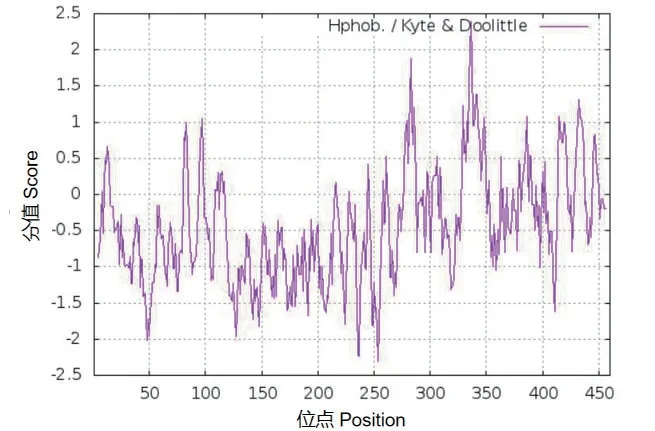
图4 CpBURP蛋白的亲疏水性分析Fig.4 Hydrophilic and hydrophobic analysis of CpBURP protein
2.3 CpBURP蛋白保守结构域
通过分析CpBURP蛋白的保守结构域(图5),发现CpBURP蛋白的氨基酸序列具有一个BURP保守结构域,说明CpBURP属于BURP基因家族。
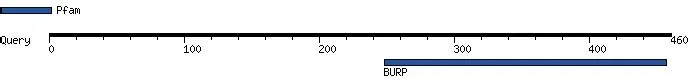
图5 CpBURP蛋白的保守结构域Fig.5 Conserved domain of CpBURP protein
2.4 CpBURP蛋白的磷酸化位点
CpBURP蛋白共含有50个磷酸化位点(图6),分别是31个丝氨酸(serine)位点、14个苏氨酸(threonine)位点和5个酪氨酸(tyrosine)位点。
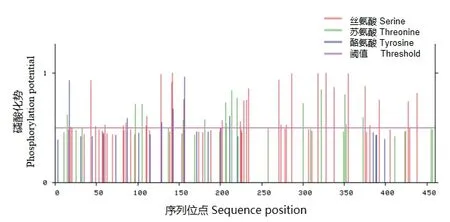
图6 CpBURP蛋白的磷酸化位点Fig. 6 Phosphorylation sites of CpBURP protein
2.5 CpBURP蛋白的二、三级结构
CpBURP蛋白的二、三级结构如图7所示,CpBURP蛋白的二级结构是由21.09%的α螺旋、27.39%的延伸链、6.74%的β转角和44.78%无规卷曲组成。
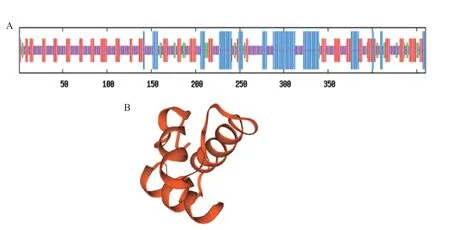
图7 CpBURP蛋白的二、三级结构分析Fig.7 Analysis of the secondary and tertiary structure of CpBURP protein
2.6 CpBURP蛋白的信号肽及跨膜结构域分析
跨膜结构预测图(图8-A)显示CpBURP蛋白不含跨膜结构,表明CpBURP蛋白不是跨膜蛋白;信号肽预测图(图8-B)显示CpBURP蛋白不含信号肽,表明CpBURP蛋白不是分泌蛋白。
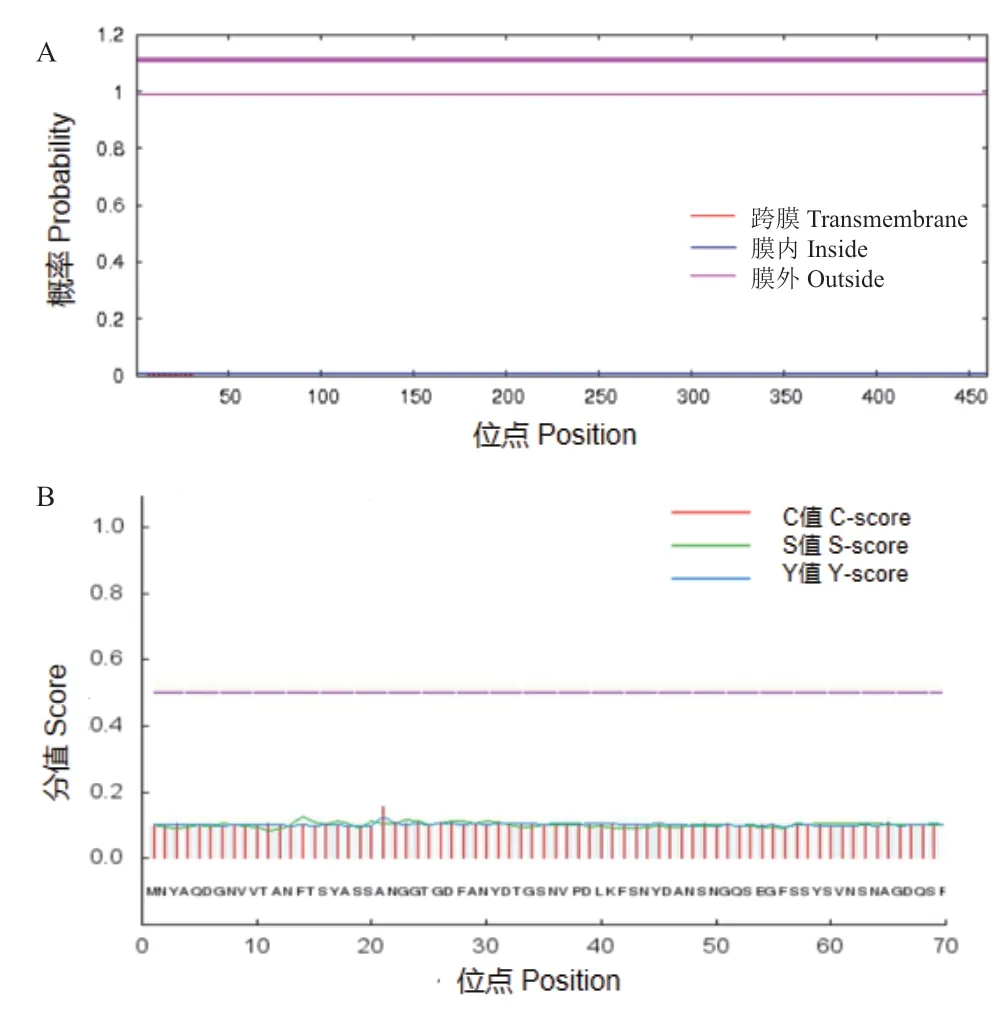
图8 CpBURP的跨膜结构和信号肽分析Fig.8 Transmembrane structure and signal peptide prediction of CpBURP
2.7 CpBURP蛋白亚细胞定位
CpBURP蛋白的亚细胞定位分析表明:CpBURP蛋白定位在细胞质的可能性最高,概率为0.450;其次是过氧化物酶体,概率为0.449;定位在线粒体基质和溶酶体可能性较低,概率均为0.100。因此,推断CpBURP蛋白作用于细胞质和过氧化酶体中的可能性较大。
2.8 构建BURP蛋白的系统进化树
为了探究紫鸭跖草CpBURP蛋白与其他植物BURP蛋白之间的亲缘关系,将CpBURP蛋白与13种植物的BURP蛋白构建系统进化树(图9)。系统进化树显示,14个物种的53个BURP蛋白分为6个亚类,其中CpBURP蛋白与甘蓝型油菜的BURP蛋白亲缘性最高,其次是拟南芥的BURP蛋白。
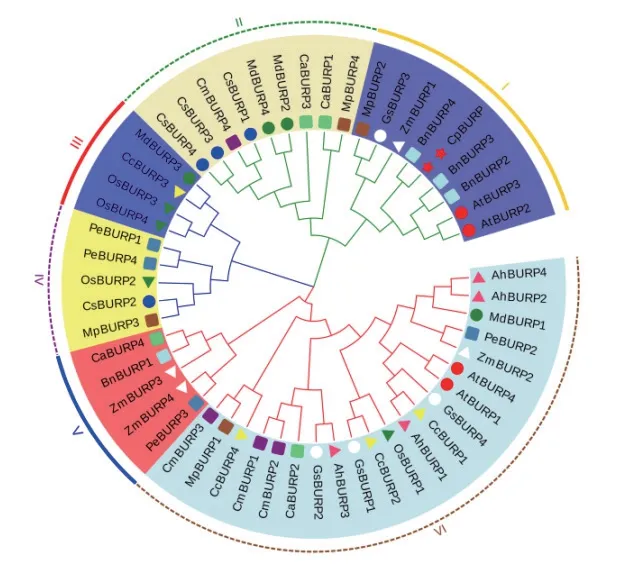
图9 不同物种BURP蛋白与CpBURP蛋白的系统进化树分析Fig.9 Phylogenetic tree analysis of BURP proteins and CpBURP protein of different species
2.9 Cu2+胁迫下CpBURP的表达差异分析
qRT-PCR分析结果如图10所示,CpBURP在根中表达量最高,其次是叶和茎。随着Cu2+浓度的增加,根、茎、叶中的CpBURP表达量均是先升高再降低,其中,根中CpBURP在100 μmol/L Cu2+胁迫后表达量最高,较对照组(0 μmol/L Cu2+)的表达量增加了约1倍,说明CpBURP在紫鸭跖草抵抗Cu2+胁迫中具有一定的调控作用。

图10 CpBURP在Cu2+胁迫下的表达变化Fig.10 Expression changes of CpBURP under Cu2+ stress
3 讨论
BURP蛋白在许多植物中已被鉴定出,这类蛋白质在植物无融合生殖、种子的生长发育、果胶代谢以及在重金属离子、盐、外源脱落酸、干旱等胁迫应激反应中发挥重要的功能[16]。目前对BURP基因的研究大多集中于模式植物(拟南芥)[17]、粮食作物(水稻、玉米等作物)[18]和经济作物(甘蓝型油菜、蚕豆和番茄等作物)[19],随着越来越多植物成为基因材料研究的对象及新植物的基因组测序完成,更多物种的BURP基因将会被发掘并报道出,BURP基因的功能及作用机制也将进一步被扩展。紫鸭跖草作为一种超积累铜植物,且BURP蛋白具有抗铜胁迫的功能,因此研究CpBURP对深入了解紫鸭跖草的耐铜机制具有一定的推动作用。
因紫鸭跖草暂无基因组数据库,本研究采用紫鸭跖草转录组数据库,利用BURP蛋白的Pfam模型在HMMER 3.0程序搜索并筛选出CpBURP。本研究从紫鸭跖草中克隆出CpBURP,再利用生物信息学分析了CpBURP蛋白结构特征、功能,运用qRTPCR分析CpBURP的表达模式。CpBURP蛋白是稳定蛋白和亲水蛋白;含磷酸化位点和BURP保守结构域,不含跨膜结构和信号肽结构,预测CpBURP蛋白定位于细胞质和过氧化酶体中的概率较大。CpBURP蛋白与拟南芥和甘蓝型油菜的BURP蛋白亲缘性较高,进一步确定CpBURP是BURP基因。CpBURP在紫鸭跖草各组织中均有表达,在Cu2+胁迫时,根的CpBURP表达量明显增加,说明根中CpBURP表达有利于紫鸭跖草抵抗Cu2+胁迫。
与动物相比,植物不能进行迁移,因此在应对生长发育过程中的各种外界环境因素的胁迫时,植物都会具有自己独特的防御系统及应对机制,例如马铃薯(Solanum tuberosum)调节WRKY应对干旱胁迫[20]、葡萄(Vitis vinifera)调节MATE应对盐胁迫[21]、马蔺(Iris lactea)调节HMA3应对重金属镉胁迫[22]、小黑杨(Opulus simonii×Populus nigra)调节CCH10应对重金属铜的胁迫[23]等。BURP基因作为一种植物特有基因,不仅参与应对环境胁迫,还在植物的生长发育过程中起着重要的作用。到目前为止,还没有关于对紫鸭跖草BURP基因/蛋白的研究分析,本研究首次从紫鸭跖草中分离出CpBURP,并运用生物学工具及qRT-PCR对其进行全面分析,为后续深入解析超积累铜植物紫鸭跖草的BURP基因功能及作用机制上提供参考依据。
4 结论
克隆了全长为1 383 bp的CpBURP,其编码的CpBURP蛋白含有BURP保守结构域,为亲水蛋白,与甘蓝型油菜的BURP蛋白具有较高同源性。CpBURP在根中的表达量最高,且Cu2+胁迫明显能提高紫鸭跖草根的CpBURP表达量。CpBURP极有可能参与紫鸭跖草的耐铜应答。
