秋葵黄酮的超声辅助循环提取工艺及其稳定性的研究
2021-11-06周婧琦高愿军秦令祥崔胜文
周婧琦,高愿军,秦令祥,崔胜文
(1.漯河食品职业学院,河南漯河462300;2.郑州轻工业大学食品与生物工程学院,河南郑州450002;3.漯河市食品研究院有限公司,河南漯河462300)
秋葵(Okra)又称咖啡黄葵、羊角豆[1],属锦葵科、秋葵属草本植物[2],含有丰富的营养成分,例如多糖、黄酮、氨基酸、矿物质等,有“绿色人参”之称[3-4],可降血脂、增强免疫力、抗氧化、降血糖、抗癌、抗炎、防衰老等[5-11]。秋葵黄酮是秋葵中含有的一种重要的功效成分,其可抗氧化、抑菌、防肿瘤、抗病毒等[12-13],被广泛用于食品、保健食品、医药和化妆品等领域,具有很好的应用价值和前景。
超声辅助循环提取是目前功能性成分提取较为先进的和最具发展前景的技术,该技术一是利用超声波的“空化作用”和“高频机械振动”,促进功效成分向溶剂的扩散和溶出,提高功效成分的溶出率,缩短提取时间;二是利用超声场作用于循环流动状态的物料的均匀性,提高物料提取处理量。该技术具有高效、低温、快速、提取率高等优点[14-17]。本文以超声辅助循环提取秋葵黄酮,并对其提取工艺进行优化;同时对其稳定性进行研究,为秋葵黄酮的提取与应用提供参考。
1 材料与方法
1.1 材料与试剂
秋葵:市售;NaOH、HCl、蔗糖、柠檬酸、偏重亚硫酸钠、山梨酸钾、抗坏血酸、无水乙醇、葡萄糖等(均为分析纯):天津德恩化学试剂有限公司。
1.2 仪器与设备
CTXW-2B超声循环提取机:北京弘祥隆生物技术开发有限公司;PHS-3E pH计:上海仪电科学仪器股份有限公司;DK-98-ⅡA水浴锅:天津市泰斯特仪器有限公司;UV-2450紫外可见分光光度计:上海元析仪器有限公司;RE-2000B旋转蒸发仪:济南来宝医疗器械有限公司;FC-18A真空冷冻干燥机:河北国辉实验仪器有限公司;CWF-A中药粉碎机:长沙万德机械设备有限公司;EYG-3004实验室超声波清洗机:北京宇翔超声工业设备有限公司;TGL-20M高速冷冻离心机:爱来宝(济南)医疗科技有限公司。
1.3 方法
1.3.1 原料预处理
选取完好、无损、无虫蛀的鲜秋葵,切成2 mm薄片,真空冷冻干燥24 h,用中药粉碎机粉碎,过100目筛,备用。
1.3.2 秋葵黄酮的提取方法
秋葵干粉→乙醇溶液→超声辅助循环提取[18]→提取液离心(6 000 r/min,15 min)→上清液浓缩(旋转蒸发仪)→秋葵黄酮浸膏→真空冷冻干燥→粉碎→秋葵黄酮粉末→AB-8大孔树脂纯化[19]→浓缩→冷冻干燥→纯化后的秋葵黄酮粉
1.3.3 秋葵黄酮目标波长的确定
将纯化后的秋葵黄酮粉溶于70%乙醇溶液中,制成浓度为20 μg/mL的溶液。然后,用紫外可见分光光度计扫描其光谱,波长设置在200 nm~400 nm,获取最大吸收波长。
1.3.4 秋葵黄酮的测定
采用李加兴等[8]的方法,根据芦丁标准曲线和回归方程计算秋葵黄酮的含量。
1.3.5 秋葵黄酮得率的计算
秋葵黄酮得率/%=(提取液中的黄酮含量/秋葵干粉质量)×100
1.3.6 超声循环技术提取秋葵黄酮的试验设计
1.3.6.1 超声辅助循环提取秋葵黄酮的单因素试验设计
称取10g秋葵干粉5份,按1.3.2的方法,进行超声辅助循环提取,考察各因素的影响。本试验采用体积分数70%的乙醇溶液,固定旋转速度为800 r/min,超声间歇比为 1∶3,料液比 1∶25(g/mL),提取时间 40 min,提取温度50℃,超声波功率400 W进行试验。分别设定料液比为 1∶10、1∶15、1∶20、1∶25 和 1∶30(g/mL),提取时间为 30、35、40、45 和 50min,提取温度为 35、40、45、50和55℃,超声功率为100、200、300、400和500 W,进行单因素试验,每个试验重复3次。
1.3.6.2 超声辅助循环提取秋葵黄酮的正交试验设计因素与水平见表1。

表1 正交试验因素水平Table 1 Factor levels table of orthogonal experimental design
1.3.7 秋葵黄酮的稳定性试验设计
设置不同的温度、pH值和金属离子等条件,测量最大波长处吸光度的变化,并扫描曲线,观察不同条件对其影响。
1.3.7.1 温度对秋葵黄酮稳定性的影响
取具塞试管10个,各加入含量为20 μg/mL的秋葵黄酮待测液 4mL,分别置于0℃冰浴和 10、20、30、40、50、60、70、80、90℃水浴下保温1h,然后放置到自然室温25℃,并对不同温度的样液分别扫描200 nm~400 nm下的光谱曲线,测260 nm和350 nm下的吸光度,并记录数据。
1.3.7.2 pH值对秋葵黄酮稳定性的影响
用HCl和NaOH制成pH1~13的溶液,各加入秋葵黄酮粉末,至其浓度为20 μg/mL,静置1 h,然后对不同pH值的样液分别扫描200 nm~400 nm下的光谱曲线,测260 nm和350 nm下的吸光度,并记录数据。
1.3.7.3 金属离子对秋葵黄酮稳定性的影响
在秋葵黄酮溶液中(秋葵黄酮浓度20 μg/mL)各添加 0.02%~0.1%的 Na+、K+、Ca2+、Fe3+、Cu2+等 5 种金属离子,摇匀后静置1 h,并对加入不同离子的样液分别扫描200 nm~400 nm下的光谱曲线,测260 nm和350 nm下的吸光度,并记录数据。
1.4 数据处理
利用Excel和正交设计助手ⅡV3.1软件对数据进行分析。
2 结果与分析
2.1 超声辅助循环提取秋葵黄酮工艺条件优化
2.1.1 料液比对秋葵黄酮得率的影响
料液比对秋葵黄酮得率的影响见图1。

图1 料液比对黄酮得率影响Fig.1 Effect of solid-liquid ratio on the yield of flavonoids
由图1可知,黄酮得率随着溶剂量的增大不断升高后趋于稳定。这是因为溶剂量的增大,秋葵黄酮与溶剂间的有效成分浓度差增大,增加了扩散推动力,黄酮得率升高。但当料液比超过1∶25(g/mL)后,溶剂再继续增多,得率也不会明显升高,而趋于平缓。因此,选取料液比1∶25(g/mL)进行后续试验。
2.1.2 提取时间对秋葵黄酮得率的影响
提取时间对秋葵黄酮得率的影响见图2。
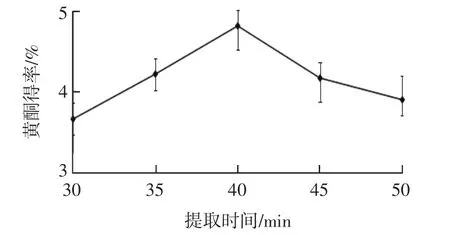
图2 提取时间对黄酮得率的影响Fig.2 Effect of extraction time on the yield of flavonoids
由图2可知,黄酮得率随着提取时间的延长先升高再降低。这是因为,提取时间过短,超声波的作用不完全,黄酮溶出少,得率较低;提取时间过长,超声波作用时间也过长,黄酮稳定性变差,会发生部分分解,得率降低。因此,选取提取时间40 min进行后续试验。
2.1.3 提取温度对秋葵黄酮得率的影响
提取温度对秋葵黄酮得率的影响见图3。
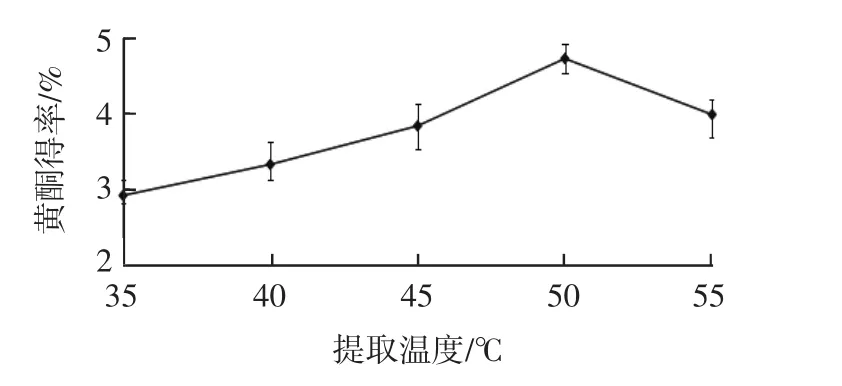
图3 提取温度对黄酮得率的影响Fig.3 Effect of extraction temperature on the yield of flavonoids
由图3可知,黄酮得率随着提取温度的升高呈现先升高后降低的趋势。这是因为,升高提取温度,扩散系数增大,功效成分溶出速度加快,得率升高;但是温度过高,秋葵黄酮的结构会被部分破坏,导致得率降低。因此,选取提取温度50℃进行后续试验。
2.1.4 超声功率对秋葵黄酮得率的影响
超声功率对秋葵黄酮得率的影响见图4。

图4 超声功率对黄酮得率的影响Fig.4 Effect of ultrasonic power on the yield of flavonoids
由图4可知,在超声功率100 W~400 W范围内,随着超声功率的增加,黄酮得率不断升高,但当超声功率超过400 W后,黄酮得率会略有下降。这是因为,增加超声功率,其空化和机械作用加强,秋葵细胞壁破坏增多,黄酮溶出增多,得率升高;但超声功率超过400 W后,黄酮溶出基本溶出完全,再继续增加超声功率,超声波会对黄酮结构造成部分破坏,导致得率略有下降。因此,选取超声功率400 W进行后续试验。
2.1.5 超声辅助循环提取秋葵黄酮的正交试验结果
超声辅助循环提取秋葵黄酮正交试验结果见表2,方差分析结果见表3。
由表2、表3分析可知,各因素影响关系为:D>A>B>C,最优组合为D2A2B3C3。超声功率和料液比对黄酮得率的影响较大,达到显著水平,其它不显著。最佳工艺参数为:超声功率 400 W,料液比 1∶25(g/mL),提取时间45 min,提取温度55℃。在最佳条件下做验证试验,平行验证3次,秋葵黄酮平均得率为4.62%。
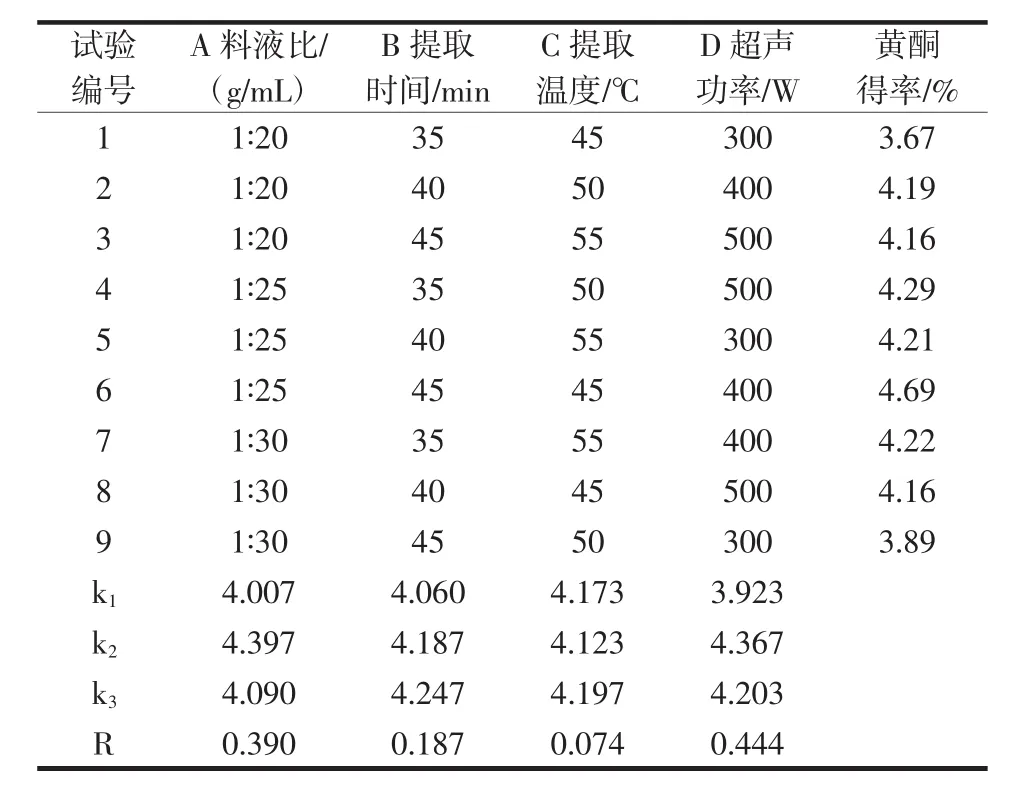
表2 正交试验结果Table 2 The result of orthogonal experimental design

表3 方差分析结果Table 3 The variance analysis results
2.2 秋葵黄酮稳定性的影响
2.2.1 秋葵黄酮光谱特性与目标波长的测定秋葵黄酮的紫外光谱见图5。
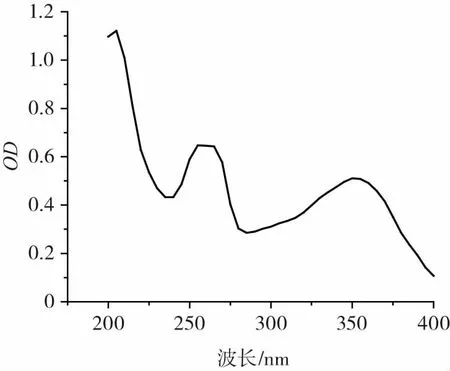
图5 秋葵黄酮的紫外光谱吸收曲线Fig.5 The UV absorption curve of okra flavonoids
由图5可知,在240 nm~280 nm和290 nm~380 nm两个波长区域,秋葵黄酮有两个吸收带,这与黄酮类化合物的基本特征相一致。其中240nm~280nm区域的吸收带为Ⅱ带,290nm~380nm区域的吸收带为Ⅰ带,其中两个吸收带的最大吸收波长分别为350 nm和260 nm,因此,选取这两个波长的吸光度来研究其稳定性。
2.2.2 温度对秋葵黄酮稳定性的影响
温度对秋葵黄酮待测液吸光度的影响见表4。
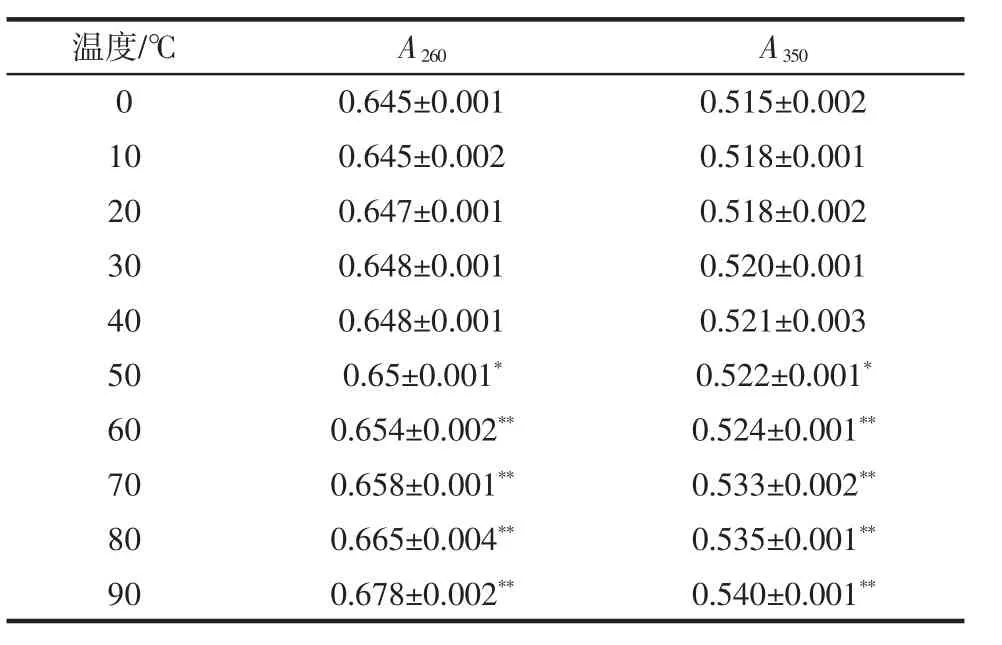
表4 温度对秋葵黄酮待测液吸光值的影响Table 4 Influence of temperature on absorbancy of okra flavonoids
由表4可以看出,采取SPSS17.0对获取的数据进行独立样本T检验,结果表明,在0℃~40℃下,秋葵黄酮保温1 h,其吸光度变化不明显,稳定性好,50℃以上吸光度变化明显,因此,判断秋葵黄酮低于50℃温度下保温1 h,结构无改变,吸光度略微增加的原因可能是溶剂的轻微蒸发造成的,但温度越高吸光度变化越明显,90℃时吸光度变化最明显,说明结构有发生改变趋势,因此,在50℃以下加工为宜。
2.2.3 pH值对秋葵黄酮稳定性的影响
不同pH值对秋葵黄酮待测液吸光度的影响见表5。

表5 不同pH值对秋葵黄酮待测液吸光值的影响Table 5 Influence of pH on absorbancy of okra flavonoids
由表5可知,与对照组相比,在酸性环境下,秋葵黄酮在260 nm和350 nm处吸光度没有变化,表明其结构在酸性条件下不改变;但是,用中性试剂制备的黄酮样液在350 nm处,吸光度变化显著,且随着溶剂pH值的增加,在260 nm和350 nm处的吸光度变化都极显著,表明秋葵黄酮结构在碱性条件下易被破坏,在酸性条件下稳定性良好。因此,秋葵黄酮应在弱酸性条件下储存为宜。
2.2.4 金属离子对秋葵黄酮稳定性的影响
金属离子对秋葵黄酮待测液吸光度的影响见表6和表7。
由表 6和表 7可知,当 Na+、K+、Ca2+浓度低于0.08%时,秋葵黄酮在260 nm和350 nm处的吸光度没有显著影响,表明秋葵黄酮在Na+、K+、Ca2+浓度低于0.08%时,其结构不发生变化,稳定性较好;而当溶剂中有Fe3+、Cu2+离子时,各离子浓度的秋葵黄酮在260 nm和350 nm处的吸光度均明显变小,表明其结构发生改变。因此,在加工秋葵黄酮时,应避免与Fe3+、Cu2+离子接触。

表6 金属离子Na+、K+和Ca2+对秋葵黄酮待测液吸光度的影响Table 6 Influence of metal ion Na+,K+and Ca2+on absorbancy of okra flavonoids

表7 金属离子Fe3+和Cu2+对秋葵黄酮待测液吸光度的影响Table 7 Influence of metal ion Fe3+and Cu2+on absorbancy of okra flavonoids
3 结论
本试验采用超声辅助循环提取秋葵黄酮,得到最优工艺参数为:超声功率 400 W,料液比 1∶25(g/mL),提取时间45 min,提取温度55℃,该条件下,秋葵黄酮得率为4.62%。同时对秋葵黄酮稳定性的影响进行了研究,结果表明:秋葵黄酮溶液具有较好的耐热性,其化学结构在50℃以下保持不变;在酸性条件下,秋葵黄酮稳定性良好;当金属离子Na+、K+、Ca2+浓度低于0.08%时,对秋葵黄酮的稳定性无显著影响,而Fe3+、Cu2+对其稳定性有显著影响。本试验可为秋葵黄酮的深加工提供一定参考。
